Совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой)
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
№1 Термодинамическая система — это совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой). Термодинамическое состояние — совокупность макроскопических параметров, характеризующих состояние термодинамической системы. Внутренняя энергия термодинамической системы – энергия, заключенная в самой системе. Термодинамические параметры – физические величины, характеризующие со-стояние термодинамической системы (температура, объем, плотность, давление, масса, намагниченность, электрическая поляризация, теплоемкость при постоянном объеме и другие), т.е. любые признаки, имеющие количественную меру и относящиеся к системе в целом или к ее макроскопическим частям (кроме характеристик потоков энергии и массы, в размерность которых входит время). При описании макросостояний используются функции состояния — это функции, однозначно определённые в состоянии термодинамического равновесия и не зависящие от предыстории системы и способа её перехода в равновесное состояние.  ТЕПЛОТА с точки зрения термодинамики – это энергия молекулярного движения. Под работой в термодинамике, в зависимости от контекста, понимают как действие обмена энергией между термодинамической системой и окружающей средой  Изобари́ческий— термодинамический изопроцесс, происходящий в системе при постоянных давлении и массе газа. Изохо́рный, — термодинамический изопроцесс, который происходит при постоянном объёме.  №2 Первое начало термодинамики является обобщением закона сохранения и превращения энергии для тепловых процессов. Пер-вое начало было установлено, после того как экспериментально была доказана взаимосвязь теплоты и работы. Первое начало термодинамики: количество теплоты, по-лученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами. Математическое выражение первого закона термодинамики. В изолированной системе сумма всех видов энергии (U) постоянна; при их взаимопревращениях энергия не теряется и не создается вновь: U = const, dU = 0. Энтальпи́я — функция состояния. термодинамической системы, определяемая как сумма внутренней энергии. и произведения давления. на объём. Буферные системы – совокупность нескольких веществ в растворе, сообщающих ему буферные свойства, т.е. способность противостоять изменению активной реакции среды (pH) при разбавлении, концентрировании раствора или при добавлении к нему небольших количеств сильной кислоты или щёлочи. 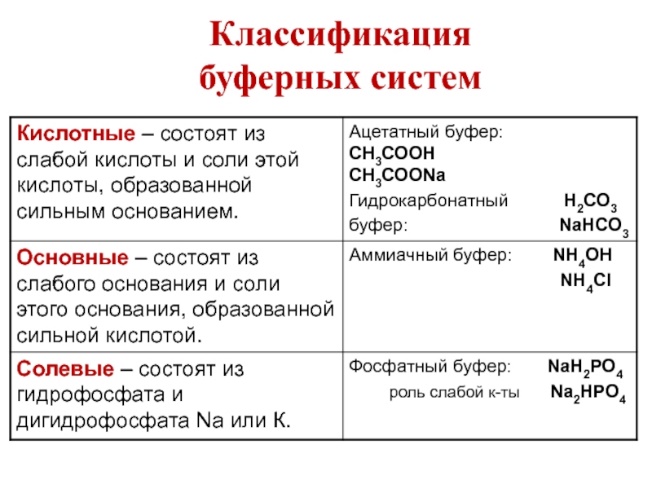     Буферная ёмкость раствора — способность раствора сохранять постоянной концентрацию определённых ионов буферные систе́мы кро́ви — физиологические системы и механизмы, обеспечивающие заданные параметры кислотно-основного равновесия в крови.  Щелочной резерв» — это количество бикарбоната (NaHC0) (точнее объем С0, который может быть связан плазмой крови) Ацидоз (от лат. acidus — кислый) — смещение кислотно-щелочного баланса организма в сторону увеличения кислотности (уменьшению рН). Алкало́з — увеличение pH крови (и других тканей организма) за счёт накопления щелочных веществ №3 Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре). Стандартной энтальпией сгорания ΔНoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан.   №4 Под макросостояниями понимают любое состояние, которое задано с указанием плотности, энергии и других параметров для всех термодинамически малых участков системы. Под микросостояниями понимают любые состояния системы, которые совершенно точно или почти точно определены указанием для каждой молекулы системы положения в пространстве этой молекулы и ее скорости. Термодинамическая вероятность – число микросостояний данной системы, с помощью которых можно реализовать данное макросостояние системы (Р, Т, V). Энтропи́я -обозначающий меру необратимого рассеивания энергии или бесполезности энергии (потому что не всю энергию системы можно использовать для превращения в какую-нибудь полезную работу).   Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов. Ио́нное произведе́ние воды́ K W (константа автопротолиза воды) — произведение концентраций ионов водорода Н + и гидроксид-ионов OH − в воде или в водных растворах. Величина ионного произведения воды возрастает с повышением температуры, так как при этом увеличивается степень электролитической диссоциации воды и возрастают концентрации ионов гидроксония и гидроксид-ионов. водоро́дный показа́тель — мера определения кислотности водных растворов.   Кисло́тность желу́дочного со́ка — характеристика концентрации соляной кислоты в желудочном соке. №5  Планка постулат — утверждение, что при абсолютном нуле темп-ры энтропия индивидуального вещества в состоянии кристалла без дефектов внутренней структуры равна нулю Абсолютная энтропия (S) вещества или процесса — это изменение доступной энергии при теплопередаче при данной температуре (Btu/R, Дж/К). стандартная молярная энтропия-это содержание энтропии в одном моле чистого вещества при стандартном состоянии давления и любой интересующей температуре. Энтропией реакции называется изменение энтропии ΔS, сопутствующее превращению реагентов в продукты реакции   Растворы электролитов, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Электролитическая диссоциация — процесс распада вещества на ионы при растворении или при плавлении. По степени диссоциации электролиты делят на делят на сильные и слабые . Сильные электролиты (α≈1): 1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH 3 COOK, формиат натрия HCOONa и др.) 2. Сильные кислоты: HCl, HI, HBr, HNO 3 , H 2 SO... Чит Основные положения теории: собственными размерами ионов можно пренебречь по сравнению с расстоянием между ними, поскольку растворы разбавленные учитываются только кулоновские взаимодействия между ионами и не учитываются другие виды взаимодействия (ион-дипольное, образование ассоциатов за счет водородной связи и т. д.) электростатическое взаимодействие между ионами рассматривается как взаимодействие между центральным ионом и его ионной атмосферой вследствие кулоновского взаимодействия ионы в растворе расположены упорядочено, а растворы являются неидеальным Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Активность − эффективная концентрация иона Xi, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов учитывает все виды взаимодействия между ионами. Коэффициент активности иона показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита. Коэффициент физической активности — величина, равная соотношению затрат энергии человека в период активности к затратам в состоянии покоя (величине основного энергетического обмена). |
