Аружан. Строение и синтез коллагена. строение и синтез коллагена
 Скачать 1.53 Mb. Скачать 1.53 Mb.
|
|
Ф КГМУ 4/3-04/03 ИП №6 от 14 июня 2007г. КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА БИОХИМИИ МЕТОДИЧЕСКОЕ ПОСОБИЕ МОДУЛЬ «ОПОРНО-ДВИГАТЕЛЬНАЯ СИСТЕМА, КОЖА И ПРИДАТКИ КОЖИ» ТЕМА: «СТРОЕНИЕ И СИНТЕЗ КОЛЛАГЕНА» Дисциплина: Bioh 2202 биологическая химия Специальность 5B130100 - Общая медицина Курс: 3 Объемных учебных часов: 2 ч. Составители: к.б.н. Позднякова Е.В. Караганда 2017 Обсуждена и утверждена на заседании кафедры________________ Дата «___» «____» _____год Протокол №__________ План: строение молекул коллагенов фибриллообразующие коллагены синтез коллагена гидролиз коллагена эластин коллагенозы тесты лабораторной диагностики при заболеваниях соединительной ткани  Рис. Строение соединительной ткани СТРОЕНИЕ МОЛЕКУЛ КОЛЛАГЕНОВ  Рис. Строение молекулы коллагена Молекулы коллагенов имеют трехспиральную структуру, полученную при скручивании трех полипептидных α – цепей, где отдельные цепи связаны между собой водородными связями. Количество аминокислот в каждой из α – цепей около 1000 Особенности аминокислотного состава коллагена Полипептидная цепь коллагена состоит из повторяющихся триплетов: [ГЛИ-Х-Y] где Гли – глицин, Х и Y могут быть любыми аминокислотами, но чаще всего: Х –пролин или аланин, Y - гидроксипролин или гидроксилизин. Коллаген содержит 33% глицина.  Рис. Цепь коллагена (аминокислотные остатки глицина окрашены в черный цвет, а других аминокислот – в белый) Схематически цепь коллагена может быть представлена следующим образом: Гли-Ала-ГиПро-Гли-Про-ГиЛиз-Гли-Ала-ГиПро  Рис. Строение коллагена Глицин обеспечивает плотность укладки трех полипептидных цепей т.к. глицин не имеет радикала и находится внутри тройной спирали. Изгибы полипептидной цепи вызывает аминокислотный остаток пролина. Коллаген содержит в основном заменимые аминокислоты, очень мало метионина, тирозина и гистидина и почти не содержит цистеина и триптофана.  Рис. Строение коллагена Основу межклеточного матрикса составляет семейство коллагеновых белков, относящихся к гликопротеинам и содержащих в большом количестве остатки глицина, пролина и гидроксипролина. Коллагены представлены 20 белками, из которых часть является собственно коллагенами, а другие содержат только коллагеноподобные домены. Все типы коллагенов в зависимости от структуры делят на несколько групп: фибриллообразующие, ассоциированные с фибриллами коллагена, сетевидные, микрофибриллы, заякоренные фибриллы и др. 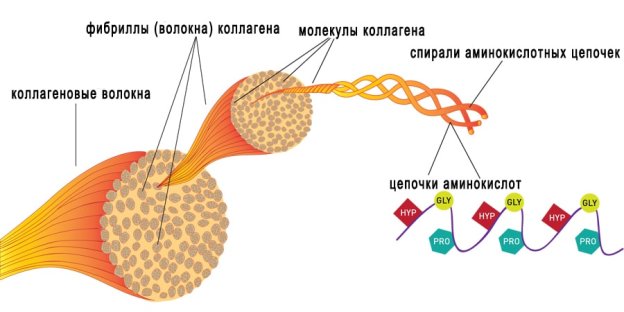 Рис. Строение коллагеновых волокон ФИБРИЛЛООБРАЗУЮЩИЕ КОЛЛАГЕНЫ Все фибриллобразующие коллагены отличаются по аминокислотному составу и содержанию углеводов. Молекулы коллагенов I, II, III, V, XI типов имеют форму фибрилл и построены из структурных единиц, называемых тропоколлагенами. Молекулы тропоколлагена (Мr 300 кДа) имеют толщину 1,5 нм и длину 300 нм. Они образованы тремя полипептидными цепями, обозначаемые как а-цепи. Каждая цепь содержит около 1000 аминокислотных остатков и представляет собой плотную левозакрученную спираль, содержащую три аминокислотных остатка на виток. Одна треть аминокислотных остатков в коллагене представлена глицином (30%), одна пятая часть пролином в сумме с 3- и 4- гидроксипролином (21%), поэтому первичную структуру коллагена можно представить в виде схемы гли - х - у-, где х - чаще всего пролин или гидроксипролин, а у - другие аминокислоты (рис. 1.2). Всего в а-цепи встречается около 330 таких повторов. Глицин повторяющейся последовательности гли - х - у- необходим для формирования фибриллярной структуры, так как радикал любой другой аминокислоты не помещается между тремя пептидными цепями в центре тройной спирали. Пролин и гидроксипролин ограничивает вращение полипептидной цепи. Радикалы аминокислот, располагающиеся в положении - х - и -у-, находятся на поверхности тройной спирали. Распределение кластеров радикалов по длине коллагеновой молекулы обеспечивает самосборку многомолекулярных коллагеновых структур. Три а-цепи образуют структуру, слегка закрученную в спираль. Формируя фибриллы, молекулы тропоколлагена (тримеры) располагаются ступенчато, смещаясь относительно друг друга на одну четверть длины, что придает фибриллам характерную исчерченность. Депонируясь в тканях, сформированные фибриллы коллагена стабилизируются посредством образования ковалентных поперечных связей.
Коллаген I типа [a1(I)]2 а2 содержит 33% глицина, 13% пролина, 1% гидроксилизина и малое количество углеводов. Определяется в составе костей, дентина, пульпы зуба, цемента, периодонтальных волокон. Этот тип коллагеновых волокон участвует в процессах минерализации. Коллаген II типа [α1(II)]3 присутствует в хрящах и образуется в нехрящевых тканях на ранних стадиях развития. Данный тип коллагена содержит небольшое количество 5 -гидроксилизина (менее 1%) и отличается высоким содержанием углеводов (более 10%). Коллаген III типа [α1(III)]3 присутствует в стенках кровеносных сосудов. Отличительной особенностью этого коллагена является наличие большого количества гидроксипролина. В составе α-цепей присутствует цистеин, а сама молекула коллагена слабо гликозилирована. Коллаген V типа [α(V)α2(V)α3(V)] представляет собой гибридную молекулу, состоящую из различных цепей, а именно: α1(V), α2(V) и α3(V). Фибриллярные коллагены также могут иметь в своём составе 2 и более различных типов коллагенов. Так, в некоторых тканях присутствуют гибридные молекулы, содержащие цепи коллагена V и XI типов. СИНТЕЗ КОЛЛАГЕНА Коллаген синтезируют и поставляют в межклеточный матрикс почти все клетки (фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты, кератобласты и др.). Синтез и созревание коллагена является сложным многоэтапным процессом, который начинается в клетке и заканчивается в межклеточном матриксе. Нарушения синтеза коллагена, обусловленные мутацией в генах, а также в процессе трансляции и пост- трансляционной модификации сопровождаются появлением дефектных коллагенов. 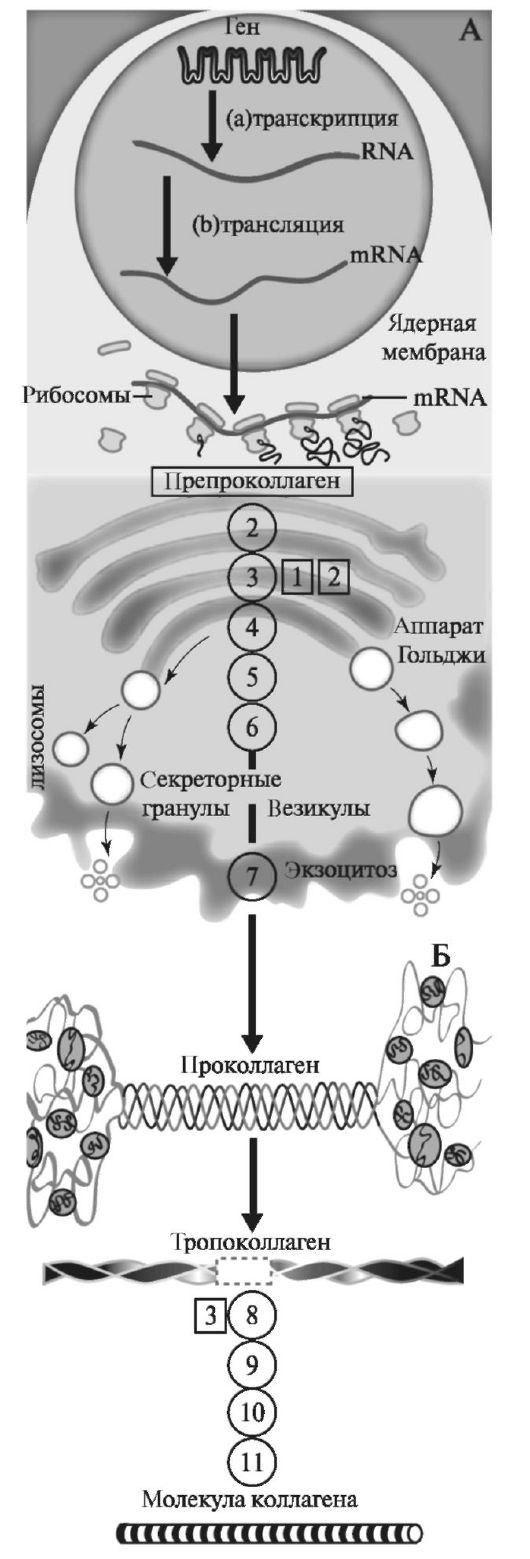 Синтез коллагена включает два этапа. На внутриклеточном этапе происходит трансляция и посттрансляционная модификация полипептидных цепей, и на внеклеточном - Внутриклеточный этап синтеза коллагена. Пептидные α-цепи коллагена синтезируются на полирибосомах, связанных с мембранами эндоплазматической сети. Её синтезированные пептидные цепи в цистернах подвергаются посттрансляционной модификации, которая включает: • удаление сигнального пептида проколлагеновой цепи при участии специфической протеиназы; • гидроксилирование остатков пролина и лизина, которое начинается в период трансляции полипептидной цепи вплоть до её отделения от рибосом. Реакции гидроксилирования катализируют оксигеназы: прокол- лагенпролил-4-диоксигеназа (пролил-4-гидроксилаза), проколлаген- пролил-3-диоксигеназа (пролил-3-гидроксилаза) и проколлагенлизил- 5-диоксигеназа (лизил-5-гидроксилаза). В реакции гидроксилирования используются О2 и 2-оксоглутарат, а в качестве кофактора участвует аскорбиновая кислота. Гидроксилазы пролина и лизина в активном центре содержат Fе2+, а аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту, необходима для сохранения атома железа в ферроформе (модификации белка, завершающаяся образованием коллагеновых волокон.) В реакциях гидроксилирования один атом кислорода присоединяется к четвёртому атому углерода в остатке пролина, а второй атом кислорода включается в янтарную кислоту, которая образуется при декарбоксилировании 2- оксоглутарата. Рис. Синтез коллагена Наряду с гидроксилированием пролина происходит гидроксилирование остатков лизина с образованием 5-гидроксилизина. В дальнейшем гидроксилированные остатки лизина подвергаются гликозилированию.  Рис. Гликозилированные участки α-цепи молекулы проколлагена При участии гликозилтрансфераз образуются ковалентные О-гликозидные связи между 5-ОН группой гидроксилизина и остатком галактозы или дисахаридом галактозилглюкозой. К амидной группе аспарагина присоединяются молекулы N-ацетилглюкозамина или маннозы. Одновременно с гидроксилированием пролина формируется стабильная трёхспиральная структура коллагена. Гидроксипролин необходим для стабилизации этой тройной спирали коллагена, поскольку его гидроксильные группы участвуют в образовании водородных связей между α-цепями. По окончании гидроксилирования и гликозилирования все про-α-цепи соединяются между собой водородными связями, а в области С-концевых пропептидов формируются дисульфидные мостики. Из эндоплазматической сети молекулы проколлагена перемещаются в аппарат Гольджи, где они включаются в секреторные пузырьки и в их составе секретируются во внеклеточное пространство. Внеклеточный этап - модификация молекул проколлагена. В межклеточном пространстве при участии протеолитических ферментов от молекулы проколлагена отщепляются N- и С-концевые пептиды и освобождается тройная спираль коллагена (тропоколлагена). Далее происходит процесс самосборки коллагеновых фибрилл, фиксированных межмолекулярными ковалентными связями (сшивками). В формировании этих связей участвуют остатки лизина и 5-гидроксили- зина и их альдегидные производные, которые образуются вследствие окислительного дезаминирования. Окислительное дезаминирование лизина и 5-гидроксилизина происходит с участием лизилоксидазы. Особенностью этого фермента является присутствие Cu2+ в активном центре. Молекулы лизилоксидазы синтезируются в клетке в виде проферментов и после связывания с ионами Cu2+ упаковываются в везикулы, которые покидают клетку. На клеточной поверхности молекула пролизилоксидазы подвергается ограниченному протеолизу и в сфор- мировавшемся активном центре при участии ионов Cu2+ происходит окисление остатка тирозина до тирозинхинона. Образовавшаяся в активном центре хиноидная структура связывает остатки лизина в молекуле проколлагена с образованием фермент-субстратного комплекса. 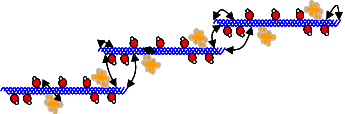 Рис. Сшивки тропоколлагена (схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и межмолекулярных сшивок, которые изображены в виде стрелок) На следующем этапе аллизин и 5-гидроксиаллизин конденсируются вместе с лизиловыми и гидроксилизиловыми остатками; формируются внутри- и межмолекулярные поперечные связи. В реакции конденсации аллизина с остатком лизина другой цепи образуется основание Шиффа. В случае альдольной конденсации двух остатков аллизина образуются альдольные межмолекулярные связи (лизиннорлейцин).  Рис. Aльдольные межмолекулярные связи Альдольная конденсация характерна для коллагена костной ткани и дентина, а основания Шиффа наиболее часто встречаются в коллагенах сухожилий. Около 25% молекул тропоколлагена распадается, не образуя фибрилл. Получившиеся фрагменты выполняют сигнальные функции и стимулируют коллагеногенез. Пространственная организация фибрилл завершается при участии фибронектина, протеогликанов и коллагенов, ассоциированных с фибриллами.  Рис. Общая схема синтеза коллагена ГИДРОЛИЗ КОЛЛАГЕНА Распад коллагена происходит медленно под действием коллагеназ. Основной фермент - Са 2+, Zn 2+ - зависимая коллагеназа (металлопротеиназа) расщепляет пептидные связи в определенных участках коллагена. Образующиеся фрагменты спонтанно денатурируют и становятся доступными для действия других протеолитических ферментов. Основной маркер распада коллагена Важнейший метаболитом, характеризующим скорость распада коллагена, является гидроксипролин. Повышение содержания гидроксипролина в плазме крови свидетельствует нарушениях созревания коллагена и распаде коллагена. 85-90% этой аминокислоты освобождается в результате гидролиза коллагена. Нарушения синтеза и распада коллагена может приводить к развитию патологий (коллагенозы и фиброзы).  Рис. Стадии гидролиза коллагена ЭЛАСТИН Эластиновые волокна обладают очень важными свойствами: они могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв, и возвращаться в первоначальное состояние после снятия нагрузки. Резиноподобные свойства названных тканей обеспечиваются основным белком эластином - гликопротеином с мол. массой 70 кДа.  Рис. Строение эластина Эластин содержит около 27% глицина, 19% аланина, 10% валина, 4,7% лейцина. Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи эластина не формируют регулярные вторичную и третичную структуры, а принимают в межклеточном матриксе разные конформации с примерно равной свободной энергией Нативные волокна эластина построены из относительно небольших, почти сферических молекул, соединённых в волокнистые тяжи с помощью жёстких поперечных сшивок - десмозина и изодесмозина, а также лизиннорлейцина. В образовании поперечных сшивок участвуют 4 остатка лизина, 3 из которых предварительно окисляются до соответствующих альдегидов при участии лизилоксидазы. Десмозин и изодесмозин формируются остатками, принадлежащими, по крайней мере, двум цепям, однако они могут быть образованы также остатками, находящимися в трёх и четырёх цепях. В образовании лизиннорлейцина участвуют 2 остатка лизина расщепляет связи, образованные карбоксильными группами алифатических аминокислот. Она активна в слабощелочной среде (рН 7,5-8,5) и гидролизует во внеклеточном пространстве не только эластин, но и другие белки - протеогликаны, гемоглобин, коллаген, иммуноглобулины. Активность эластазы ингибирует белок α1-антитрипсин (α1-АТ). Наибольшее количество α1-АТ синтезируется печенью и находится в крови. В тканях α1-АТ синтезируется макрофагами. Изменения структуры эластина при патологических процессах При нарушении образования десмозинов, изодесмозинов и лизиннорлейцина снижается предел прочности эластических тканей на разрыв, появляются такие нарушения, как истончённость, вялость, растяжимость, то есть утрачиваются их пластичные свойства. Изменения в структуре эластина могут быть обусловлены снижением активности лизилоксидазы при наследственных и приобретённых заболеваниях, дефиците меди. Нарушения структуры эластина могут проявляться сердечно-сосудистыми изменениями в виде аневризм и разрывов аорты, дефектов клапанов сердца, частыми пневмониями и эмфиземой лёгких. 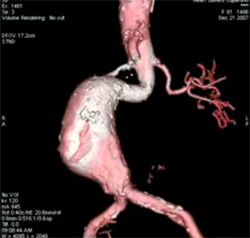 Рис. Аневризма аорты 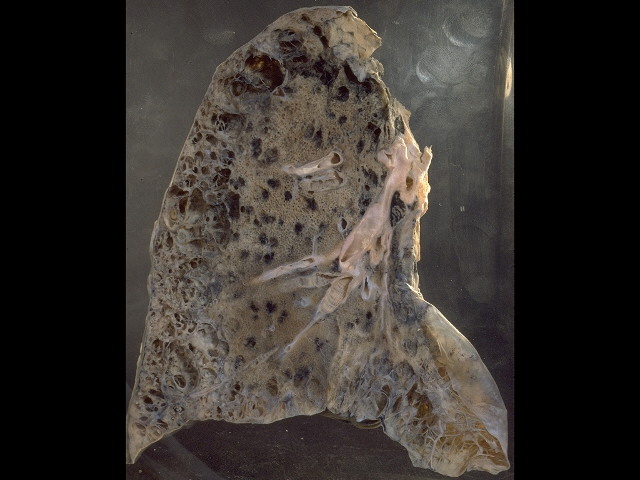 Рис. Эмфизема легких КОЛЛАГЕНОЗЫ Системная красная волчанка (СКВ). Системная склеродермия. Дерматомиозиты. Болезнь Шегрена. Синдром Рейтера. Ревматизм. Системная красная волчанка Системная красная волчанка (СКВ, болезнь Либмана-Сакса) — диффузное заболевание соединительной ткани, характеризующееся системным иммунокомплексным поражением соединительной ткани и её производных, с поражением сосудов микроциркуляторного русла. 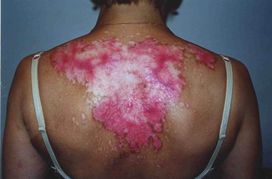 Рис. СКВ Системная склеродермия Системная склеродермия — прогрессирующее заболевание с характерным изменением кожи, опорно-двигательного аппарата и внутренних органов. В основе заболевания лежит воспалительное поражение мелких сосудов всего организма.  Рис. Системна склеродермия Дерматомиозиты Дерматомиозит (син. болезнь Вагнера) — тяжелое прогрессирующее системное заболевание соединительной ткани, скелетной и гладкой мускулатуры с нарушением её двигательной функции, кожных покровов в виде эритемы и отёка, и сосудов микроциркулятоного русла с поражением внутренних органов, нередко осложняющееся кальцинозом и гнойной инфекцией. 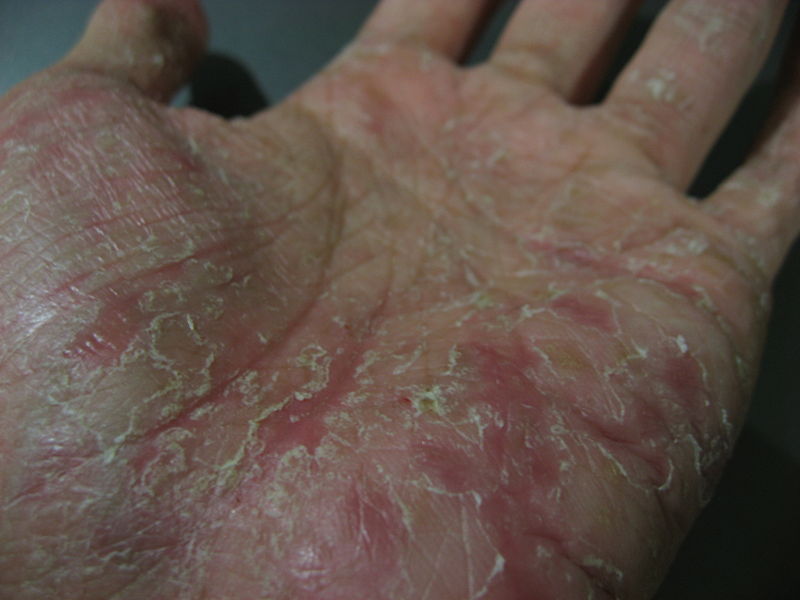 Рис. Дерматомиозиты Болезнь Шегрена Системное аутоиммунное заболевание, относящееся к болезням соединительной ткани; характеризуется поражением многих секретирующих желез, главным образом слюнных и слезных. Причины заболевания неизвестны. Большинство рассматривают болезнь как следствие иммунопатологических реакций на вирусную инфекцию, предположительно ретровирусную   Рис. Болезнь Шегрена Синдром Рейтера Синдром Рейтера — аллергическое реактивное состояние в большинстве случаев постинфекционного характера (после энтерита) с триадой: уретрит, конъюнктивит, артрит. Часто развиваются кератит и ирит. Также синдром Рейтера часто вызывается хламидиями и гонококками. 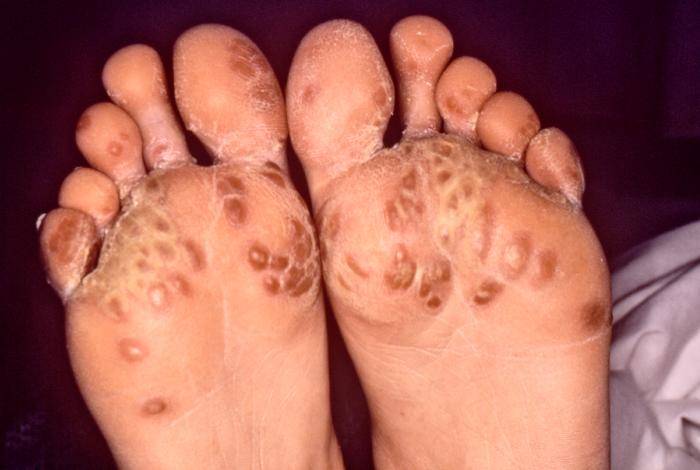  Рис. Синдром Райтера Ревматизм Ревматизм (РБ) - системное воспалительное заболевание соединительной ткани, характеризующееся преимущественной локализацией процесса в сердечно-сосудистой системе. Сопровождается нарушением иммунитета. Причины Генетический ф-р (гены локуса D/DR (DR-2,DR-3,DR-4)). инфекция, вызванная бета-гемолитическим стрептококком группы А. Иммунологические ф-ры (Иммунологические маркеры, и их связь с локусом R главного комплекса HLA)  Рис. Ревматизм ТЕСТЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ПРИ ЗАБОЛЕВАНИЯХ СОЕДИНИТЕЛЬНОЙ ТКАНИ СОЭ эритроциты (гиперхромная анемия), , лейкоциты (N,, ) антитела к стрептококковым антигенам (антистрептолизин-О) антигиалуронидаза, антистрептокиназа) антинуклеарные факторы (в сыворотке пожилых людей в 15% случаях) СРБ ( альфа- глобулин ) Fе Сu комплемент (в большинстве случаев) LЕ - клетки Ig(J,A,M,E) белок в моче ( протеинурия) 1-антитрипсин 2 -макроглобулин. фибриноген, серомедиоид ревматоидный фактор В суставной жидкости: белок ревматоидный фактор лейкоциты фагоциты коллагеназа суставной жидкости и крови Эритроциты Лейкоциты (сдвиг влево) СОЭ 2 глобулин (СРБ, церуллоплазмин, гаптоглобин) 1 серомукоид глобулин (IgJ, IgA, IgM) фибриноген гиалуроновая кислота дифениламиновая проба атистрептолизин-О антистрептогиалуронидаза антистрептокиназа оксипролин крови и мочи трансаминазы (АСТ, АЛТ) КФК ЛДГ4, ЛДГ5 Гидроксибутиратдегидгогеназа Холинэстераза Ссылки на литературу и рисунки Литература: СТРОЕНИЕ МОЛЕКУЛ КОЛЛАГЕНОВ. [Электронный ресурс]: Биохимия соединительной ткани. Автор – доцент кафедры биохимии Е.А. Рыскина. URL: http://web-local.rudn.ru/web-local/prep/rj/files.php?f=pf_27c1c8a22af249436cf85a12c58c7c77 (дата обращения: 17.08.2017) (дата обращения: 17.08.2017) ФИБРИЛЛООБРАЗУЮЩИЕ КОЛЛАГЕНЫ. [Электронный ресурс]: Сообщество студентов Кировского ГМА. URL:http://vmede.org/sait/?page=4&id=Biohimija_tkanei_vavilova_2008&menu=Biohimija_tkanei_vavilova_2008 (дата обращения: 17.08.2017) СИНТЕЗ КОЛЛАГЕНА. [Электронный ресурс]: Сообщество студентов Кировского ГМА.URL:http://vmede.org/sait/?page=4&id=Biohimija_tkanei_vavilova_2008&menu=Biohimija_tkanei_vavilova_2008 (дата обращения: 17.08.2017) ГИДРОЛИЗ КОЛЛАГЕНА. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) ЭЛАСТИН. [Электронный ресурс]: Сообщество студентов Кировского ГМА.URL:http://vmede.org/sait/?page=4&id=Biohimija_tkanei_vavilova_2008&menu=Biohimija_tkanei_vavilova_2008 (дата обращения: 17.08.2017) КОЛЛАГЕНОЗЫ. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) ТЕСТЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ПРИ ЗАБОЛЕВАНИЯХ СОЕДИНИТЕЛЬНОЙ ТКАНИ. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Ссылки на рисунки Рис. Синтез протеогликанов. [Электронный ресурс]: Сообщество студентов Кировского ГМА. URL:http://vmede.org/sait/?page=4&id=Biohimija_tkanei_vavilova_2008&menu=Biohimija_tkanei_vavilova_2008 (дата обращения: 17.08.2017) Рис. Строение молекулы коллагена. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Цепь коллагена. [Электронный ресурс]: Биохимия соединительной ткани. Автор – доцент кафедры биохимии Е.А. Рыскина. URL: http://web-local.rudn.ru/web-local/prep/rj/files.php?f=pf_27c1c8a22af249436cf85a12c58c7c77 (дата обращения: 17.08.2017) (дата обращения: 17.08.2017) Рис. Строение коллагена. [Электронный ресурс]: Биохимия соединительной ткани. Автор – доцент кафедры биохимии Е.А. Рыскина. URL: http://web-local.rudn.ru/web-local/prep/rj/files.php?f=pf_27c1c8a22af249436cf85a12c58c7c77 (дата обращения: 17.08.2017) (дата обращения: 17.08.2017) Рис. Строение коллагена. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Строение коллагеновых волокон. [Электронный ресурс]: Sportlif.Ru URL: http://sportlif.ru/kollagen-i-kollagenovye-dobavki-dlya-sustavov.html (дата обращения: 17.08.2017) Рис. Строение соединительной ткани. [Электронный ресурс]: Mezoroll.Ru URL: http://mezoroll.ru/Structure_of_the_skin (дата обращения: 17.08.2017) Рис. Синтез коллагена. [Электронный ресурс]: Сообщество студентов Кировского ГМА. URL:http://vmede.org/sait/?page=4&id=Biohimija_tkanei_vavilova_2008&menu=Biohimija_tkanei_vavilova_2008 (дата обращения: 17.08.2017) Рис. Гликозилированные участки α-цепи молекулы проколлагена. [Электронный ресурс]: Сообщество студентов Кировского ГМА. URL: http://vmede.org/sait/?page=4&id=Biohimija_tkanei_vavilova_2008&menu=Biohimija_tkanei_vavilova_2008 (дата обращения: 17.08.2017) Рис. Сшивки тропоколлагена. [Электронный ресурс]: Биохимия соединительной ткани. Автор – доцент кафедры биохимии Е.А. Рыскина. URL: http://web-local.rudn.ru/web-local/prep/rj/files.php?f=pf_27c1c8a22af249436cf85a12c58c7c77 (дата обращения: 17.08.2017) (дата обращения: 17.08.2017) Рис. Aльдольные межмолекулярные связи. [Электронный ресурс]: Сообщество студентов Кировского ГМА. URL: http://vmede.org/sait/?page=4&id=Biohimija_tkanei_vavilova_2008&menu=Biohimija_tkanei_vavilova_2008 (дата обращения: 17.08.2017) Рис. Общая схема синтеза коллагена. [Электронный ресурс]: Биохимия соединительной ткани. Автор – доцент кафедры биохимии Е.А. Рыскина. URL: http://web-local.rudn.ru/web-local/prep/rj/files.php?f=pf_27c1c8a22af249436cf85a12c58c7c77 (дата обращения: 17.08.2017) (дата обращения: 17.08.2017) Рис. Стадии гидролиза коллагена. [Электронный ресурс]: Sportlif.Ru URL: http://sportlif.ru/kollagen-i-kollagenovye-dobavki-dlya-sustavov.html (дата обращения: 17.08.2017) Рис. Строение эластина. [Электронный ресурс]: Sportlif.Ru URL: http://sportlif.ru/kollagen-i-kollagenovye-dobavki-dlya-sustavov.html (дата обращения: 17.08.2017) Рис. Аневризма аорты. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Эмфизема легких. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. СКВ. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Системна склеродермия. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Дерматомиозиты. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Болезнь Шегрена. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Синдром Райтера. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) Рис. Ревматизм. [Электронный ресурс]: ГБОУ ВПО УГМУ Минздрава РФ, Кафедра биохимии, лекция «Биохимия соединительной ткани», Гаврилов И.В., Екатеринбург, 2015г URL: http://ppt-online.org/41736 (дата обращения: 17.08.2017) |
