Шпаргалки по предмету Строение вещества. Шпоры на экз. Структурные изомеры
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
|
Молекула. Структурная изомерия и топология. Молекула - электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов. Устойчивость молекулы обусловлена электростатическим взаимодействием электронов и ядер. Структурные изомеры – это соединения, имеющие одинаковую молекулярную формулу, но отличающиеся друг от друга порядком связывания атомов в молекуле. Структурная изомерия подразделяется на изомерию углеродной цепи, изомерию положения и изомерию функциональных групп.  Топология. Как известно, топология — это раздел математики, который изучает свойства тел, не зависящие от их формы и размеров, или неметрические свойства. Молекулы же обладают как метрическими (длины химических связей, углы между ними и т.п.), так и неметрическими (могут быть циклическими и нециклическими, как бензол и н-бутан соответственно, и т.п.) свойствами. Топология молекулярных систем связана с их свойствами. Топология. Как известно, топология — это раздел математики, который изучает свойства тел, не зависящие от их формы и размеров, или неметрические свойства. Молекулы же обладают как метрическими (длины химических связей, углы между ними и т.п.), так и неметрическими (могут быть циклическими и нециклическими, как бензол и н-бутан соответственно, и т.п.) свойствами. Топология молекулярных систем связана с их свойствами.Молекула. Координация атомов. Молекула – электрически нейтральная частица, образованная из 2 или более связанных ковалентными связями атомов Координационные соединения (комплексные соед.), содержат катионный, анионный или нейтральный комплекс, состоящий из центр. Атома (или иона) и связанных с ним молекул или ионов - лигандов. Центр. Атом (комплексообразователь) - обычно акцептор, а лиганды - доноры электронов, и при образовании комплекса между ними возникает донорно-акцепторная, или координационная, связь. Число атомов лигандов, координированных центр. атомом, - координационное число (к. ч.) - обычно превышает его степень окисления. Лиганды, связанные с центр. атомом, образуют внутр. координац. сферу комплексного соединения. Анионы или катионы (противоионы), входящие вместе с комплексом в состав координационного соединения, образуют вторую (внешнюю) сферу. Комплексы, в к-рых лиганды связывают два или более центр. ионов, наз. би- или полиядерными. Полиядерные комплексы, имеющие хим. связи между центр. атомами, наз. Кластерами. Координации атомов зависит от гибридизации атомных орбиталей. (А – центральный атом; X – лиганд, с которым центральный атом образует химическую связь, то есть даёт связывающие электронные пары, n – число связывающих электронных пар): АХ2 – линейная, угловая; АХ3 - Плоский треугольник, Тригональная пирамида, Т-форма; АХ4 – квадрат, тетраэдр, бисфеноид; АХ5 – тригональная бипирамида, квадратная пирамида; АХ6 – окатэдр; АХ7 – пентагональная бипирамида, одношапочная тригональная призма; АХ8 – куб, квадратная антипризма, треугольный додэкаэдр. Молекула. Хиральность. Молекула – электрически нейтральная частица, образованная из 2 или более связанных ковалентными связями атомов Хиральность – свойство молекулы не совмещаться со своим зеркальным отображением Виды: Центральная (а) Возникает в результате наличия в молекуле центра хиральности (хирального центра), которым, как правило, является асимметрический атом углерода, имеющий 4 различных заместителя. Аксиальная (б) Возникает в результате неплоского расположения заместителей относительно некоторой оси — оси хиральности Планарная (в) Присутствует в производных ферроцена, замещённых парациклофанах и др. При помощи данного термина описывают хиральное расположение внеплоскостных элементов молекулы относительно плоскости хиральности Спиральная (г) Характерна для соединений, имеющих элементы в форме спирали, пропеллера или винта, например для гелиценов. Шесть ароматических колец в гексагелицене не могут уложиться в одной плоскости, поэтому образовывают спираль, которая может быть закручена влево или вправо. Данный вид хиральности наблюдается также в белках и нуклеиновых кислотах. Топологическая (д) Связана с наличием структурной несимметричности, характерной для супрамолекул, например, катенанов, ротаксанов, молекулярных узлов. Молекула. Стереохимическая конфигурация. Молекула – электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов. Устойчивость молекулы обусловлена электростатическим взаимодействием электронов и ядер. Взаимодействия: валентные (Ковалентная полярная, Ковалентная неполярная, ионная, металлическая), невалентные: водородная, Ван-дер-Ваальсова (ориентационная, индукционная, дисперсионная) Определенное расположение атомов или атомных групп вокруг хираль-ных центров, или диссимметричных частей молекулы, составляет ее стерео-химическую конфигурацию Абсолютная конфигурация - это истинное расположение в пространстве заместителей при каждом асимметрическом атоме молекулы; чаще всего ее обозначают буквами D или L. Конфигурация - это порядок расположения атомов в пространстве без учёта различий, возникающих в следствии вращения вокруг одинарных свя-зей. Конфигурационные изомеры: энантиомеры - это стереоизомеры, относящиеся друг к другу как предмет и не совместимое с ним зеркальное отображение; диастиамеры - это стереоизомеры, не относящиеся друг к другу как предмет и не совместимое с ним зеркальное отображение. Молекула. Конформация. Молекула – электрически нейтральная частица, образованная из 2 или более связанных ковалентными связями атомов Конформация - пространственное расположение атомов и атомных групп, возникающее при внутреннем вращении вокруг простых связей без их разрыва.  Внутримолекулярные взаимодействия и их влияние на структуру молекулы. Под внутримолекулярным взаимодействием понимают различные виды химической связи, обеспечивающие существование многоатомных соединений (ионов, молекул, кристаллических веществ и др.). Химическая связь — это физико — химическое явление взаимодействия атомов, при котором перекрываются электронные облака связывающихся частиц и уменьшается энергия системы. Под внутримолекулярным взаимодействием понимают различные виды химической связи, обеспечивающие существование многоатомных соединений (ионов, молекул, кристаллических веществ и др.). Химическая связь — это физико — химическое явление взаимодействия атомов, при котором перекрываются электронные облака связывающихся частиц и уменьшается энергия системы. Химические связи(внутримолекулярные): Ковалентная связь. Это связь, образованная в результате обобществления электронных пар двумя атомами. Ковалентная связь характерна абсолютному большинству неорганических и органических соединений. Разновидностью ковалентной связи является донорно - акцепторная связь. При ней один атом представляет для образования связи пару электронов, другой атом ее принимает. Результатом взаимодействия является общая электронная пара. Ионная связь. Это связь, обуславливающая электростатическое взаимодействие катионов и анионов в соединении. Возникает, если значение электроотрицательности атомов сильно отличаются. Ионная связь ненаправлена и ненасыщаема. Металлическая связь. Характерна только для конденсированного состояния вещества. Это многоцентровая связь с дефицитом электронов в твердом или жидком веществе, основанная на обобществлении внешних электронов атомов. Внутримолекулярные водородные связи. Возникают в одной молекуле между атомами водорода и отрицательными атомами полярных групп. Для образования внутримолекулярных водородных связей в молекуле должны быть атомы водорода Н с выраженным положительным зарядом +δ (группы −O −H) и электродонорные атомы (например, =O). Молекула в классическом представлении. Энергия молекулы в классической теории. Молекула образована атомами, масса которых сосредоточена в ядрах. Электроны обеспечивают образование химической связи. В целом можно представить молекулу как систему материальных точек, имеющих какую-то равновесную геометрическую конфигурацию ("шарики на пружинках"). Молекула может сдвигаться в пространстве как целое (с сохранением относительного расположения ядер), вращаться как целое, или совершать колебательные движения. Соответственно, энергия молекулы – сумма поступательной энергии центра масс и внутренней энергии молекулы (т.е. суммы электронной, вращательной и колебательной энергий молекулы). По классическим представлениям испускание или поглощение излучения связано с ускоренным изменением дипольного момента (при равномерном движении заряженных частиц энергия не излучается). Если дипольный момент отсутствует, например, из-за симметрии, как в случае молекулы H2, то при вращении ни излучения, ни поглощения энергии не будет. Если при колебаниях молекулы дипольный момент не меняется (пример: молекула водорода), то и при колебательном движении ни поглощения, ни испускания излучения происходить не будет Аналогичным образом нет поглощения или излучения при равномерном поступательно движении центра масс молекулы (дипольный момент, если и меняется, то равномерно). Энергия молекулы: Кинетическая  Tt Tr Tv, Trv Tt Tr Tv, TrvTt – кинетическая энергия поступательного движения молекулы Tr – кинетическая энергия вращательного движения Tv – кинетическая энергия колебательного движения Trv – Кориолисово взаимодействие Кориолисово взаимодействие выражает связь между колебанием и вращением. При малых колебаниях им пренебрегают (T= Tt +Tr +Tv ) Потенциальная Потенциальная энергия молекулы – функция параметров координат атомов Rα (скорости движения атома α в системе координат OXYZ) и колебательных координат qα. Если поверхность потенциальной энергии имеет хотя бы один достаточно глубокий минимум, то молекула может существовать как единая устойчивая частица. Потенциальная поверхность двухатомной молекулы – кривая. Число степеней свободы = 3N-5=3*2-5=1 Молекула в классическом представлении. Гармонический осциллятор. • Молекула образована атомами, масса которых сосредоточена в ядрах. Электроны обеспечивают образование химической связи. В целом можно представить молекулу как систему материальных точек, имеющих какую-то равновесную геометрическую конфигурацию. Молекула может сдвигаться в пространстве как целое, вращаться как целое, или совершать колебательные движения. Соответственно, энергия молекулы – сумма поступательной энергии центра масс и внутренней энергии молекулы (т.е. суммы электронной, вращательной и колебательной энергий молекулы). По классическим представлениям испускание или поглощение излучения связано с ускоренным изменением дипольного момента (при равномерном движении заряженных частиц энергия не излучается). Гармонический осциллятор – две массы, которые колеблются друг относительно друга. Двухатомная молекула как гармонический осциллятор Это значит, что два атома молекулы совершают колебания относительно их общего центра. Колебательные состояния многоатомной молекулы В многоатомной молекуле из N атомов существует 3N-6 колебательных степеней свободы (3N-6 колебаний) Степень свободы – расстояние между атомами Нормальным называется колебание, при котором изменения N координат атомов происходит с одной и той же частотой. Число нормальных колебаний соответствует числу колебательных степеней свободы. Молекула в классическом представлении. Жёсткий ротатор. • Молекула образована атомами, масса которых сосредоточена в ядрах. Электроны обеспечивают образование химической связи. В целом можно представить молекулу как систему материальных точек, имеющих какую-то равновесную геометрическую конфигурацию. Молекула может сдвигаться в пространстве как целое, вращаться как целое, или совершать колебательные движения. Соответственно, энергия молекулы – сумма поступательной энергии центра масс и внутренней энергии молекулы (т.е. суммы электронной, вращательной и колебательной энергий молекулы). По классическим представлениям испускание или поглощение излучения связано с ускоренным изменением дипольного момента (при равномерном движении заряженных частиц энергия не излучается). Жесткий ротатор – два объекта, закрепленные друг относительно друга и вращающиеся вокруг общего центра. Квантово-механическое представление молекулы. Уравнение Шредингера. В соответствии с квантовой механикой молекула – это система из ядер и электронов. Поскольку можно ожидать, что под действием сил взаимодействия ядер и электронов более тяжелые ядра (протон в 1836.152 раз тяжелее электрона) будут двигаться намного медленнее, чем легкие электроны, энергия молекулы при фиксированном положении радиус-векторов ядер будет практически такой же, как и при учете движений ядер. В соответствии с квантовой механикой молекула – это система из ядер и электронов. Молекулярное уравнение Шредингера: Квантово-механическое представление молекулы. Энергетические состояния молекул. В соответствии с квантовой механикой молекула – это система из ядер и электронов. Поскольку можно ожидать, что под действием сил взаимодействия ядер и электронов более тяжелые ядра (протон в 1836.152 раз тяжелее электрона) будут двигаться намного медленнее, чем легкие электроны, энергия молекулы при фиксированном положении радиус-векторов ядер будет практически такой же, как и при учете движений ядер. Энергетическое состояние молекулы зависит не только от орбитали, на которой находятся валентные электроны, но и от колебательных и враща-тельных движений молекулы или ее частей. Квантово-механическое представление молекулы. Поверхность потенциальной энергии. В соответствии с квантовой механикой молекула – это система из ядер и электронов. Поскольку можно ожидать, что под действием сил взаимодействия ядер и электронов более тяжелые ядра (протон в 1836.152 раз тяжелее электрона) будут двигаться намного медленнее, чем легкие электроны, энергия молекулы при фиксированном положении радиус-векторов ядер будет практически такой же, как и при учете движений ядер. Поверхность потенциальной энергии ( ПЭС ) - описывает энергию системы, в частности набор атомов, с точки зрения некоторых параметров, как правило, положения атомов. Поверхность может определять энергию как функцию одной или нескольких координат; если есть только одна координата, поверхность называется кривой потенциальной энергии или профилем энергии . Примером может служить потенциал Морзе / дальнего действия . Интерпретация геометрического строения молекулы на основе модели ОЭПВО и концепции гибридизации. Модель отталкивания электронных пар валентной оболочки Гил-лепси-Найхольма (ОЭПВО) 1. Пространственная направленность связей атома А в молекуле определяется расположением его валентных электронных пар (ЭП), связывающих (В) и неподеленных (Е). Если В n-штук, а E m-штук, то общее число пар q=n+m. 2. ЭП размещаются на электронной оболочке так, что их взаимное отталкивание минимально (удаление друг от друга максимально 3. Отталкивание пар понижается в ряду (E-E)>(E-B)>(B-B) Пр: молекула (СН3)2РF3. 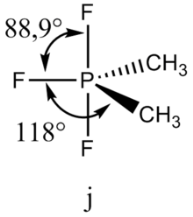 Валентные углы в этой молекуле уменьшаются в порядке СРС > СРF > FPF, соответствующем порядку возрастания электроотрицательности лигандов 4. B-пары занимают меньший объем, чем Е-пары. Размеры В-пары уменьшаются с ростом электроотрицательности лиганда. 5. Две или три пары двойной или тройной связи занимают в полиэдре одно место, их объем больше объема ЭП простой связи.  Гибридизация : sp sp2 sp3d sp3 sp3d3 Электрический дипольный момент молекулы. Влияние симметрии и конформационной подвижности молекулы на величину дипольного момента. Система, состоящая из равных по абсолютному значению, но противо-положных по знаку зарядов (q), расположенных на расстоянии друг от друга называется электрический диполь. При повышении температуры дипольный момент конформационно-подвижной молекулы возрастает. Конформационно-жесткая молекула не зависит от температуры. При уменьшении температуры возрастает количество (устойчивость) транс- конформеров, с увеличением температуры – гош- конформеров и по-являются молекулы с заслоненной конформмацией. Мультиполи - системы зарядов, имеющие несколько полюсов Монополь – один уникальный заряд Монополь-монопольное взаимодействие (например: К+- К+) Монополь-дипольное взаимодействие (НС1(диполь)+К+) Поляризуемость. Эллипсоид поляризуемости и его связь с симметрией молекул. Поляризуемость (а) – характеризует свойства молекулы и связана с размерами ее электронного облака. [a]=[l^3] Поляризуемость определяет смещаемость электронной оболочки мо-лекулы под действием электрического поля. Характеризует объем, который может занять электронная оболочка мо-лекулы. Элипсоид поляризуемости – легко смещающаяся электронная плот-ность в молекуле. Если конфигурация ядер молекулы имеет элементы симметрии, то направления главных осей и форма элипсоида поляризуемости молекулы находятся в определенных отношениях с этими элементами симметрии. Операция симметрии, допускаемая ядерной конфигурацией, переводя молекулу саму в себя, не должна изменять элипсоида поляризуемости. При любых операциях симметричного преобразования, допускаемых конфигурацией ядер молекулы элипсоид поляризуемости переходит сам в се-бя. Тогда: - Если молекула имеет ось симметрии: эта ось – одна из главных осей элипсоида поляризуемости; - Если молекула имеет плоскость симметрии – то одна из главных осей элипсоида поляризуемости перпендикулярна плоскости симметрии, а две дру-гие лежат в плоскости симметрии; - Если молекула имеет три взаимно перпендикулярные оси второго по-рядка, то они являются главными осями элипсоида поляризуемости. - Если молекула имеет одну ось порядка выше второго, то эта ось – одна из главных осей элипсоида поляризуемости (В этом случае элиспоид поляри-зуемости – элипсоид вращения вокруг данной оси, а две другие оси равны ); - Если молекула имеет две или более осей порядка выше второго, то элипсоид поляризуемости вырождается в сферу. Атомные и молекулярные термы. - конфигурация (состояние) электронной подсистемы, определяющая энергетический уровень. Иногда под словом терм понимают собственно энергию данного ур-ня. Переходы между термами определяют спектры испускания и электро-магнитного излучения. Термы обозначают заглавными буквами. М = 2S + 1 – мультиплетность. Если объединить в группы микросостояния, которые имеют одинако-вую энергию с учетом электронного отталкивания, то получаются спектро-скопически различные уровни энергии, называемые термы. Потенциальная функция двухатомных молекул. Потенциал Морзе. Потенциал Леннарда-Джонса.  Кривая типа б) имеет репульсивный характер во всей области изменения r. Для данного состояния двух частиц не существует их устойчивого соединения. Кривая б) реализуется: для взаимодействия двух одинаково заряженных ионов. для устойчивой молекулы при переходе в одно из ее высших электронных состояний.  Молекулярные спектры (вращательные, колебательно-вращательные, электронно-колебательно-вращательные). Молекулярные спектры в отличие от атомных спектров, обусловлены: 1) электронными переходами; 2) колебаниями атомов в молекуле; 3) вращением молекулы как целого. Вращательные спектры возникают при изменении Евр под действием внешнего излучения. Они имеют линейчатый вид, причём линии равноудалены на расстояние 2В, где В – вращательная простоянная  Колебательные спектры. Изменение Екол под действием внешнего излучения сопровождается изменением Евр, поскольку Екол >> Евр. В результате вместо чисто колебательных переходов у молекулы наблюдаются колебательно–вращательные переходы. При этом колебательная спектральная линия превращается в полосу, состоящую из множества линий:  Электронные спектры. При изменении Еэл у молекулы одновременно изменяются Екол и Евр, поскольку Еэл >> Екол >> Евр. В результате вместо чисто электронных переходов наблюдаются электронно–колебательно-вращательные переходы. Их число весьма велико, поэтому электронный спектр имеет вид широких перекрывающихся полос, которые возникают в результате наложения большого числа узких полос 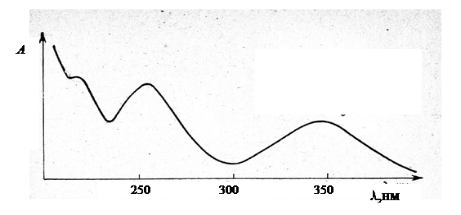 Теория молекулярных орбиталей. Основные положения метода молекулярных орбиталей (МО ЛКАО) В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО. Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда. Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО. Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО. С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина. Теория кристаллического поля и спектры ультрафиолетовой и видимой области. Теория кристаллического поля основана на главном предположении, что каждый лиганд L представляет собой точечный заряд (отрицательный), который не обладает ни формой, ни размерами, ни особенностями химической природы. В ТКП рассматривается взаимодействие данных лигандов — точечных зарядов — с d-орбиталями металлов, пространственное расположение которых учитывается в рамках теории. УФ-спектры. Поглощение органическими веществами электромагнитных колебаний в ультрафиолетовой (УФ) и видимой области спектра обусловлено переходом электронов со связывающих на разрыхляющие молекулярные орбитали. В результате такого перехода молекула оказывается в возбужденном состоянии. При взаимодействии с квантом света, поглощая энергию, электрон может переходить с высшей занятой молекулярной орбитали (ВЗМО) на низшую свободную молекулярную орбиталь (НСМО). Электроны достаточно прочно удерживаются ядром, поэтому для их возбуждения требуется относительно много энергии, поэтому необходимо — электромагнитное излучение, имеющее малые длины волн (120-800 нм). Растворы ионов переходных металлов (или, точнее, их комплексов) часто окрашены (т.е. поглощают видимый свет), потому что электроны в ионах металлов могут быть возбуждены с одного электронного уровня на другой. На цвет растворов ионов металлов сильно влияет присутствие других частиц, таких как определенные анионы или лиганды, а также степень окисления катиона металла. Таким образом, разбавленный раствор медного купороса имеет очень светло-голубой цвет; добавление аммиака усиливает цвет и изменяет длину волны максимума поглощения (λ max ) Люминесценция. Люминесценция – свечение вещества после того, как оно подверглось электронному возбуждению в результате поглощения возбуждения. Конкурентный для люминесценции процесс - безызлучательный переход – процесс в котором энергия передается окружающему пространству в виде тепла. Бывает 2 типов: 1. Флуоресценция-это излучение при переходе из возбужденного состояния той же мультиплетности, что и основное состояние. Переход: -быстрый, -разрешен по спину, -время жизни несколько наносекунд 2. Фосфоресценция -это излучение при переходе из возбужденного состояния, отличающегося по мультиплетности от основного состояния. Переход: -происходит медленно, -запрещен по спину Р  убин: ионы Cr3+ замещают часть ионов Al3+ в оксиде алюминия и окружены кислородом (октаэдр) Фосфоресценция убин: ионы Cr3+ замещают часть ионов Al3+ в оксиде алюминия и окружены кислородом (октаэдр) Фосфоресценция4T1g←4A2g и 4T2g ← 4A2g разрешены по спину Интеркомбинационная конверсия- безизлучательное превращение начального возбужденного состояния в другое возбужденное состояние, отличающееся по мультиплетности. Состояние 2Eg действует как накопитель энергии, т.к. переход 2Eg → 4A2g запрещен по спину. Поскольку интеркомбинационная конверсия возможна (вследствие спин-орбитального взаимодействия), то также нарушается правило отбора по спину, поэтому излучательный переход возможен. Этот излучательный переход длится несколько микросекунд или дольше. Поглощение и люминесценция Cr3+ в рубине Строение кристаллов. Кристаллическая решетка и кристаллическая структура. Кристаллами называются твёрдые вещества, частицы которых образуют трёхмерную периодическую пространственную структуру, называемую кристаллической решёткой. Кристаллическая решетка - расположение атомов в кристалле. Кристаллическая структура - такая совокупность атомов, в которой в каждой точке кристаллической решетке связана определенная группа атомов, называемой мотивной единицей. Или: правильные ряды частиц в пространство, трехмерные решетки из атомов образуют кристаллическую структуру. Строение кристаллов. Решетки Браве. Решетки Бравэ, или трансляционные решетки, создаются с помощью операции параллельного перемещения (трансляции) частиц (атомов, ионов). В кристаллографии для аналитического описания кристалла используют трехмерную систему координат, которую выбирают в соответствии с симметрией кристалла. Оси кристаллографической системы координат, как правило, совпадают с векторами, на которых построена элементарная ячейка. Под элементарной ячейкой понимают минимальный объем кристалла, который еще сохраняет его структуру. Все элементарные ячейки кристалла имеют одинаковую структуру и объем. Во всех вершинах ячеек располагаются атомы или группы атомов. Их называют узлами решетки. В зависимости от соотношения параметров ячейки различают семь типов симметрий, или сингоний Бравэ: триклинная, моноклинная, ромбическая, тетрагональная, тригональная (ромбоэдрическая), гексагональная, кубическая. Различают четыре типа структуры элементарных ячеек. Примитивная ячейка (ПР) содержит частицы только в вершинах. С учетом соседних ячеек, на такую ячейку приходится один атом. |
