Документ Microsoft Word. Титраметрический анализ
 Скачать 115.84 Kb. Скачать 115.84 Kb.
|
 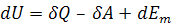  БИЛЕТ 61.Титраметрический анализ. БИЛЕТ 61.Титраметрический анализ.ТА основан на точном измерении колва реактива, израсход на реакцию с определяемым веществом. Этот вид анализа назют объемным, тк наиболее распространенным в практике способом количественных определений является точное измерение обхъема раствора известной концентрации, израсходованного на реакцию с определенным объемом анализируемого раствора .Заместительное титрование заключается в добавлении к анализируемому вещству изб реагента, вступающего с ним в реакц, с последующим определением колва одного из продуктов реакции путем титрования. Сэ(А)=(Сэ(в)V(в))/V(a) 2.Термодинамические условия равновесия.Система назся равновесным, если все свойства ее остаются постоянными в течение как угодно большего промежутка времени и в системе отсутствуют потоки вещества и энергии. Система, состоящая из любых тел с течением времени самопроизвольно приходит в состояние, при котором она перестает изменяеться, те в равновесное состояние, из которого она сама по себе выйти не сможет. (0-ое начало ТД)Энергия Гиббса.G – функция состояния системы, называемая энергией Гиббса. Энергия Гиббса равна:G = Н – ТS.Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (G < 0). При достижении равновесия в системе G = 0.Стандартная энергия Гиббса образования.Стандартная энергия Гиббса образования Gоf,298 (или Gообр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, Gоf,298 = 0.Под стандартной энергией Гиббса биологического окисления ΔG°, понимают изменение энергии Гиббса при реакции биологического окисления 1 моль вещества, находящегося в стандартном состоянии.Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. 3.Коллигативными называют свва растворов, зависящие от концентрации растворенных частиц, но не от их природы. К КС относ осмотич давл, повышение Т кип, пониж Т замерз раств по ср с чистым растворителем. Закон Руля.Парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества.дP=KxИз закона Рауля вытекают два важных следствия:1) Растворы кипят при более высокой температуре чем чистый растворитель;2) Растворы замерзают при более низкой температуре чем чистый растворитель. БИЛЕТ 51.Учение о бсф Вернадский: *бсф- всепланетная система-область жизни, где все живое вво участвует в круговороте вв и превращ энергии. *бсф занимает всю гидросферу, атмосферу до озон слоя, литосферу до глубины 3 км. Круговорот отдельных веществ В.И. Вернадский назвал биогеохимическими циклами. Суть цикла в том, что химические элементы, поглощенные организмом, впоследствии его покидают, уходят в абиотическую среду, затем, через какое-то время, снова попадают в живой организм и т.д. Такие элементы называются биофильными (биогенными). Данные элементы или их соединения необходимы для жизнедеятельности организмов, их роста, размножения. Химические элементы периодической системы, которые участвуют в процессах жизнедеятельности и развития организмов, называются биогенными. Около 60-65 элементов. Существует несколько классификаций биогенных элементов. Мы рассмотрим – по количественному содержанию. Итак, по количественному содержанию условно все биогенные элементы можно разделить на три класса: макроэлементы – содержание в организме более 10–2 % от массы тела. Это 11 элементов: O, C, H, N, P, S, Na, K, Ca, Mg, Cl. Из них 6 элементов – органогены: O, C, H, N, P, S. Это s- и р-элементы малых периодов. микроэлементы – содержание в организме от 10–3 % до 10–5 % от массы тела.Наиболее важные из них: Fe, Mn, Zn, Cu, Co, Mo, J и т.д. – в основном d-элементы. Установлено, чем боль¬ше заряд ядра, тем меньше содержание элемента в организме и тем токсичнее его соединения. ультрамикроэлементы – менее 10–5 % до 10–12 % от массы тела. В.И.Вернадский, а позднее А.П.Виноградов разработали теорию биогеохимических провинций, под которыми понимают территории, характеризующиеся повышенным или пониженным содержанием одного или нескольких химических элементов в почве или воде, а также в организмах животных и растений, обитающих на этой территории. На таких территориях могут наблюдаться определенные болезни, непосредственно связанные с недостатком или избытком этих элементов. Эти болезни получили название эндемических. 2.Третий закон термодинамики (постулат Планка): В 1911 г. Макс Планк предложил следующий постулат: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю . Этот постулат может быть объяснен статистической термодинамикой , согласно которой энтропия есть мера беспорядочности системы на микроуровне. S = klnW часто называют “уравнением Больцмана“, хотя оно выведено М.Планком в 1900 г. В нем W – число различных состояний системы, доступное ей при данных условиях, или термодинамическая вероятность макросостояния системы. kb = R/NA = 1,38.10-16 эрг/град – постоянная Больцмана В 1872 г. Л.Больцман предложил статистическую формулировку второго закона термодинамики: изолированная система эволюционирует преимущественно в направлении большей термодинамической вероятности. Энтропия представляет собой функцию состояния, приращение которой равно теплоте, подведенной к системе в обратимом изотермическом процессе, делимой на абсолютную Т, при котор осущ процесс: дS= Qmin/T (Дж/К) Абсолютная энтропия (S) вещества или процесса — это изменение доступной энергии при теплопередаче при данной температуре (Btu/R, Дж/К) Для изолированных систем (ΔН = 0) направление и предел самопроизвольного протекания процесса однозначно определяется величиной изменения энтропии системы ΔS, а для систем, находящихся при температурах, близких к абсолютному нулю (S = 0 либо S = const) критерием направленности самопроизвольного процесса является изменение энтальпии ΔН. Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл. Для химической реакции изменение энтропии аналогично изменению энтальпии - термин энтропия был введен Клаузиусом (1865 г.) через отношение Q / T (приведенное тепло). 3.Изучая растворимость газов в жидкостях в присутствии электролитов, русский враччфизиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов. БИЛЕТ 81.Эквивалент – реальная или условная чатица, которая способна принять, отдать или как-то иначе соответсв одному иону водорода в обменных реакциях или 1е в овр. Число, показывающее какую долю от реальной частицы составляет эквивалент, называется фактором эквивалентности. Мэ=М*fМэ кислоты= М кисл/ реальн основность кислотыМэ основ= Моснв/ реальн кислотность основанияМэ соли= Мсоли/( СО(Ме) * количествоатомовМе) 2.Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. Таким образом, общим условием равновесия изолированной системы при отрицательной температуре является, как и в случае положительной температуры, максимальность энтропии системы. В закрытой системе - при dG = 0 (G=Gmin , энергия Гиббса имеет минимальное значение) система находится в состоянии термодинамического равновесия;\ 3.Электролиты – вещества, которые подвергаются электролитической диссоциации, и вследствие чего их расплавы или растворы проводят электрический ток. Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах: 1. Электролиты в растворах распадаются на ионы – диссоциируют; 2. Диссоциация является обратимым равновесным процессом; 3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными). Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе. Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.Если вынести в левую часть уравнения постоянные величины, а в правую часть – равновесные концентрации, то получим выражение для константы равновесия: БИЛЕТ 11 1.Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.pH — это водородный показатель— мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:pH = -log[H+].Еще одним показателем кислотности раствора является показатель pOH - отрицательный логарифм гидроксильных ионов [OH-]. Пользуются этим показателем гораздо реже.Между собой показатели связаны следующим образом:14 = pH + pOH 2.Правило Вант-Гоффа. Скорость химической реакции зависит от температуры, причем при повышении температуры скорость реакции увеличивается.Скорость реакций зависит от температуры. В соответствии с эмпирическим правилом Вант-Гоффа скорость большинства реакций увеличивается приблизительно в 2—4 раза при увеличении температуры на 10°С: где у — температурный коэффициент константы скорости реакции.Гомогенный катализ- реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую. Гетерогенный катализ- регаир вва и кат образ различные фазы химич системы.Биокатализатор=ферменты – в жив ор раль катализаторов бх реакций выполняет специальная группа веществ. Характериизуются высокой специфичн, избирательностью, чувствительностью и эффективностью. 3.Давление, котор необходимо приложить к растовру для предотвращения проникновения в него растворителя, - Осмотическое давлениеPosm=iCmRTi-Изотонический коэффициент Вант-Гоффа, котор определяет экспериментально и показывает во сколько раз реальное число раств частиц больше теоретич.Гипертонические растворы- растворы, Осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях.Гипотонические растворы - Осмотическое давление которых ниже, чем в клетках растительных или животных тканейИзотонические)- растворы с одинаковым осмотическим давлением. БИЛЕТ 21. БИЛЕТ 41. Учение о бсф Вернадский:*бсф- всепланетная система-область жизни, где все живое вво участвует в круговороте вв и превращ энергии.*бсф занимает всю гидросферу, атмосферу до озон слоя, литосферу до глубины 3 км.Химические элементы периодической системы, которые участвуют в процессах жизнедеятельности и развития организмов, называются биогенными. Около 60-65 элементов. 2. Никакой двигатель не может преобразовывать теплоту в работу со стопроцентной эффективностью. (2)Принцип Бертло: Самопроизв протекают те процессы, в результате которых выдел энергия1) Обратимым термодинамическим процессом называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.2) Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.Энтропия-мера неупорядоченности сисетмы-представялет собой функцию состояния, приращение которой равно теплоте, подведенной к системе в обратимом изохорном процессе, делимой на абсолютную темературу. 3. законом Генри – Дальтона:Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью. БИЛЕТ 10 1.Относительная молекулярная масса (Mr) — величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов.Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.мМолярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.M = m / nМоль вещества (n) — это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12C.Эквивалент – реальная или условная чатица, которая способна принять, отдать или как-то иначе соответсв одному иону водорода в обменных реакциях или 1е в овр.молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль. 2.Закон Гесса- изменение энтальпии хим реакции, протекающей при постоянном объеме и давлении, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от числа и послед промеж стадий. Согл зак Г. Теплота, которая выделяется при окислении питательных веществ, не зависит от того, как или где они окисляются. Для открытых термодинамических систем математическое выражение первого закона имеет вид где Em – энергия, связанная с изменением массы термодинамической сис темы. 3.Теория растворов сильных электролитов Разработана в 1923 г. П.Дебаем и С.Хюккелем. 1. Сильные электролиты в водных растворах полностью диссоциируют, т.е. степень диссоциации = 1 или 100%. В растворах электролитов ионы взаимодействуют с полярными молекулами растворителя и образуются сольватные оболочки (гидратные оболочки, если растворитель – вода). Гидратные оболочки увеличивают размер ионов и поэтому уменьшается способность иона переносить электрический ток, участвовать в химических реакциях. 2. Ионы взаимодействуют с друг другом и вокруг каждого гидратированного иона возникает “ионная атмосфера” из гидратированных ионов противоположного знака, что тормозит действие каждого иона.Ионная сила раствора, параметр I, используемый для характеристики электрического поля раствора электролитов. Ионная сила раствора I = 1/2 S miZ2i, где Zi — заряд ионов данного вида i, m — их моляльность в раствореКоэффициент активности зависит от концентраций всех ионов, присутствующих в растворе, т.е. от так называемой ионной силы раствора µ, вычисляемой по формуле: БИЛЕТ 1 1.Титраметрический анализ.ТА основан на точном измерении колва реактива, израсход на реакцию с определяемым веществом. Этот вид анализа назют объемным, тк наиболее распространенным в практике способом количественных определений является точное измерение обхъема раствора известной концентрации, израсходованного на реакцию с определенным объемом анализируемого раствора .Точка эквивалентности (Т. Э.) - такая точка титрования, в котором количество прибавленного титранта Т эквивалентно количеству титруемого вещества.Наступающий в процессе титрования момент, в котором количество раствора реагента (р.в.) становится теоретически строго эквивалентным количеству определяемого компонента (о.в.), реагирующего с прибавляемым р.в. согласно определенному уравнению химической реакции, называют моментом (точкой) эквивалентности (т.э.).Момент, при котором заканчивают титрование, называют конечной точкой титрования (к.т.т).А конечную точку титрования мы определяем при помощи индикаторов, которые изменяют свою окраску - это и будет подтверждение точки эквивалентности. 2.ТД системой назыв любой объект природы, состоящий из достаточно большего числа молекул и отделенных от др объектов природы реальной или вообр границей раздела.Состояние наз стационарным, если свойства системы постоянны во времени, но имеются потоки вещества и энергии.Переходным, если свойства системы измен во врРавновесным- все свойста остаются постоянными в теч какого угодно пром вр и отсутств потоки энергии и вещества.Интенсивные параметры характеризуются каждую точку системы.Экстенсивные параметры зависят от количества вещества или массы. 3. Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:При стандартных условиях ионное произведение воды равно 10-14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.pH — это водородный показатель— мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:pH = -log[H+]. БИЛЕТ 7 1.Обратное титрование (титрование по остатку) – титрование непрореагировавшего вещества, которое прибавлено в избытке к анализируемому раствору в виде стандартного раствора.С(х)= (Сэ1V1-Cэ2V2)/Vх 2.Принцип Онзагера: для закрытой системы (то есть, не обменивающейся энергией с внешней средой), при возможности развития процесса по нескольким направлениям, реализуется тот из них, который обеспечивает минимум рассеяния энергии, то есть минимальный прирост энтропии.Формулировка теоремы Пригожина:В стационарном состоянии производство энтропии внутри термодинамической системы при неизменных внешних параметрах является минимальным и постоянным. Если система не находится в стационарном состоянии, то оно будет изменяться до тех пор, пока скорость производства энтропии, или, иначе, диссипативная функция системы не примет наименьшего значения. Экзерогонические реакции – G < 0 и системой совершается работа (окисление глюкозы)Эндерогонические – G > 0 и над системой совершается работа. (фосфорилирования глюкозы)Сопряжённые реакции, такие реакции химические, которые протекают только совместно и при наличии хотя бы одного общего реагента. Примером сопряжённых реакций может служить совместное окисление окиси углерода и водорода: 2H2 + O2 = 2H2O и 2CO + О2 = 2CO2Живые системы являются открытыми и поэтому относятся к неравновесным. Такая термодинамически открытая система характеризуется тем, что в ней постоянно протекают химические реакции. Биохимические реакции на всех стадиях являются каталитическими. Катализаторами в этих реакциях являются белки-ферменты. Изменение энтропии такой системы определяется как сумма энтропии, производимой внутри системы diS, и энтропии, поступающей извне или выделяющейся во внешнюю среду deS.Химическая термодинамика количественно определяет тепловые эффекты вышеперечисленных процессов, выясняет возможность самопроизвольного их протекания в том или ином направлении и условия, при которых химические реакции будут находиться в состоянии равновесия. 3.Осмос- односторонняя диффузия через полупрониц мембр.Осмотич давление растворов: давл, которое необх приложить к раствору для предотвращения проникновения в него растворителя.Правило Вант-Гоффа. Скорость химической реакции зависит от температуры, причем при повышении температуры скорость реакции увеличивается.Скорость реакций зависит от температуры. В соответствии с эмпирическим правилом Вант-Гоффа скорость большинства реакций увеличивается приблизительно в 2—4 раза при увеличении температуры на 10°С: где у — температурный коэффициент константы скорости реакции. БИЛЕТ 31.Первое нач ТД: общий запас внутренней энергии остается постоянным, если отсутствует тепловой обмен с окружающей средой.Энтальпия- мера теплоты, поглощаемая в избарном процессе-тд функц, характеризующая энергетическое состояние системы при изобарно-изотермических процессах.Э. образования соединения- изменение э системы, сопровожд образование 1 моль соединения из простых веществ.Э.ОПРЕДЕЛЯЕМАЯ в стандартн условиях называется стандартной энтальпией образованияЭ. сгорания-изменение э системы, сопровождающее полное окисление кислородом 1 моля орг вва в стандартн усл.Э. растворения- изменение э системы, сопровождающее растворение 1 моля вещества в таком объеме растворителя, когда его дальнейшее прибавление не вызывает выделения или поглощения тепла. 2. Кривая титрования – это график зависимости pH, оптической плотности или каких-либо других характеристик титруемого раствора (ось ординат) от объема добавленного титранта (ось абсцисс). Масштаб оси абсцисс всегда линейный, а оси ординат может быть линейным или логарифмическим. Линейный масштаб удобен для тех методов контроля за титрованием (спектрофотометрия, амперометрия), в которых контролируемый параметр меняется с концентрацией линейно, а логарифмический – в случае логарифмического изменения (например, при потенциометрии с ионоселективным электродом). Логарифмический масштаб часто используют при визуальном определении конечной точки титрования, поскольку именно в этом масштабе наиболее наглядно проявляется резкое изменение свойств раствора вблизи точки эквивалентности.Скачок титрования – участок кривой титрования, на котором происходит резкое изменение на блюдаемого свойства системы.Точка эквивалентности – точка, в которой число эквивалентов титранта равно числу эквивалентов титруемого вещества. 3. Закон Гесса- изменение энтальпии хим реакции, протекающей при постоянном объеме и давлении, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от числа и послед промеж стадий. Согл зак Г. Теплота, которая выделяется при окислении питательных веществ, не зависит от того, как или где они окисляются.Для открытых термодинамических систем математическое выражение первого закона имеет вид где Em – энергия, связанная с изменением массы термодинамической сис темы. Следствия из закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν): {\displaystyle \Delta H^{o}=\sum {(\nu }_{i}\Delta H_{f,i}^{o})_{products}-\sum {(\nu }_{i}\Delta H_{f,i}^{o})_{reactants}.}Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν): {\displaystyle \Delta H^{o}=\sum {(\nu }_{i}\Delta H_{c,i}^{o})_{reactants}-\sum {(\nu }_{i}\Delta H_{c,i}^{o})_{products}.}Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температурыЕсли начальное и конечное состояния химической реакции (реакций) совпадают, то их тепловой эффект равен нулю.Применение 1 ТД к биосистемам: Следовательно, по существу вся энергия, потраченная организмом, в конечном счете, преобразуется в теплоту. Из этого принципа существует лишь единственное исключение: в случае, когда мышцы выполняют работу над внешними телами.Если человек не выполняет внешней работы, то уровень высвобождения организмом энергии можно определить по величине общего количества теплоты, выделенной телом. Для этого применяют метод прямой калориметрии, для реализации которого используют большой, специально оборудованный калориметр. Организм помещают в специальную камеру, которая хорошо изолирована от среды, то есть не происходит обмена энергией с окружающей камеру средой. Количество теплоты, выделенной исследуемым организмом, можно точно измерить. Эксперименты, выполненные этим методом, показали, что количество энергии, поступающей в организм, равно энергии, выделяющейся при проведении калориметрии. БИЛЕТ 9 1.Прямое титрование-постепенное прибавление титранта к анализируемому веществу до озникновени точки эквивалентности.Сэ(А)= Сэ(В)V(B)/V(А) 2.Выделяют среднюю скорость реакции и истинную скорость реакции. Средняя скорость реакции затданный промежуток времени – это конечное изменение концентрации (С2 – С1), относящееся к промежутку времени (t2 – t1).Истинная скорость реакции в данный момент времени ut – это изменение концентрации, относящееся к бесконечно малому промежутку времени.Общее уравнение кинетики: Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.Активные соударения – это соударения, которые происходят, например, между молекулами А и В с большим запасом энергии. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называется энергетическим барьером реакции.Энергия активации - это избыток энергии, которую можно сообщить или передать одному моль вещества. 3. .Данная константа является константой ионизации слабого электролита. Она не зависит от исходной концентрации веществ, а зависит только от природы электролита и растворителя, а также от температуры. Константа ионизации характерна только для слабых электролитов. Чем больше значение константы, тем сильнее электролит подвержен ионизации.Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: {\displaystyle \mathrm {K={\frac {c\lambda ^{2}}{\lambda _{\mathcal {1}}(\lambda _{\mathcal {1}}-\lambda )}}} .} БИЛЕТ 151.111.1 закон Сеченова: растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов. Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ. 2.Понятие энтропии S – функция состояния системы, называемая энтропией. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К). Энергия Гиббса G – функция состояния системы, называемая энергией Гиббса. Энергия Гиббса равна: G = Н – ТS. Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение G в результате протекания процесса. Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса. Энтальпия- мера теплоты, поглощаемая в избарном процессе-тд функц, характеризующая энергетическое состояние системы при изобарно-изотермических процессах. 3. Коллигативными называют свва растворов, зависящие от концентрации растворенных частиц, но не от их природы. К КС относ осмотич давл, повышение Т кип, пониж Т замерз раств по ср с чистым растворителем. Закон Руля.Парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества. дP=KxИз закона Рауля вытекают два важных следствия:1) Растворы кипят при более высокой температуре чем чистый растворитель;2) Растворы замерзают при более низкой температуре чем чистый растворитель. |
