Урок. Урок 8 Виды химической связи
 Скачать 181.23 Kb. Скачать 181.23 Kb.
|
|
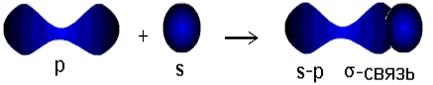
Урок № 8 «Виды химической связи». Цель урока: закрепить знания учащихся по видам химической связи; повторить основные виды химической связи, свойства и механизм их образования; развивать у учащихся умения и навыки в составлении схем образования различных видов химической связи; Оборудование: таблица «Виды химической связи интерактивная доска, мультимедиа проектор. Ход урока: Организационный момент. Проверка отсутствующих. Проверка готовности к уроку. Изучение нового материала Данный урок можно использовать для учащихся 8 классов при изучении темы «Химическая связь», для учащихся 9 классов в качестве повторения перед изучением темы «Электролитическая диссоциация», в 10 и 11 классах для углубления знаний по теме «Химическая связь». Для работы учащимся выдаются конспекты к уроку (приложение 1), которые необходимо заполнять в процессе урока, в конспекте указано домашнее задание. Заполненные конспекты с выполненным домашним заданием сдаются на следующем уроке и оцениваются. На этапе актуализации знаний ученики вспоминают строение атома и строение электронной оболочки атома, изменение свойств атома по периодической системе элементов, понятие электроотрицательности. По современным представлениям химическая связь между атомами имеет электростатическую природу. Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами. Поэтому особо важным представляется повторение понятия электроотрицательность. На втором слайде представлены вопросы, на которые следует ответить Что такое электроотрицательность? За единицу принята электроотрицательность какого элемента? Какой элемент имеет наибольшую электроотрицательность? Как по электроотрицательности отнести элементы к металлам и неметаллам? Как изменяется значение электроотрицательности по таблице элементов Д.И. Менделеева? (приложение 2, ответы). На поставленные вопросы заслушиваем ответы учащихся. Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах. Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Различают три основных типа химической связи: ковалентную, ионную, металлическую. Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Связь, возникающая между атомами элементов, электроотрицательности которых одинаковы или отличаются, но не очень сильно. Ионная связь – химическая связь между атомами элементов, электроотрицательности, которых резко отличаются и устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента. Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов. Ковалентная связь. В слове "ковалентная" приставка "ко-" означает "совместное участие". А "валента" в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами. Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки. Ковалентная химическая связь может быть образована атомами одного и того же элемента(электроотрицательность атомов одинакова) и тогда она неполярная (слайд 5). Такая ковалентная связь наблюдается при образовании простых веществ – неметаллов: H2, Cl2, N2, O2 и др. Ковалентная химическая связь, образованная атомами разных элементов, электроотрицательности которых, отличается незначительно, называется полярной (слайд 6). Этот случай встречается наиболее часто при образовании молекул: H2O, HCl, CH4, NH3 и др. Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода (слайд 7 , рис.1).  Рис. 1. Возникновение ковалентной связи при образовании молекулы водорода из двух атомов водорода. Электронные оболочки атомов водорода (с одним s-электроном у каждого атома) сливаются в общее электронное облако (молекулярную орбиталь), где оба электрона "обслуживают" ядра независимо от того, "свое" это ядро или "чужое". Когда электронные оболочки двух атомов водорода сближаются и образуют новую, теперь уже молекулярную электронную оболочку (рис.1), эта новая оболочка подобна завершенной электронной оболочке атома благородного газа гелия (1s2). В образовавшейся системе из двух водородных атомов каждое ядро обслуживается двумя электронами. В новой (молекулярной) оболочке уже невозможно различить, какой из электронов ранее принадлежал тому или другому атому. Принято говорить, что электроны обобществлены. Поскольку оба ядра претендуют на пару электронов в равной степени, электронная плотность сосредоточена как вокруг ядер, так и в пространстве между атомами (это показано на рис.2). Именно эту область повышенной электронной плотности между ядрами и называют ковалентной связью. 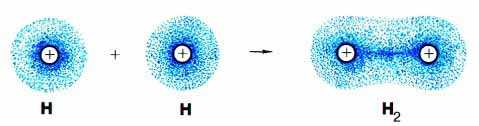 Рис. 2. Другой способ изображения атомных и молекулярной орбиталей: густота точек отражает "электронную плотность", то есть вероятность нахождения электрона в какой-либо точке пространства около ядер атомов водорода. Видно, что значительная электронная плотность сосредоточена в пространстве между двумя ядрами в молекуле водорода. На рисунках 1 и 2 вы видите очень детальное изображение ковалентной связи. На практике используют более простые способы. Например, американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с символами элементов. Одна точка обозначает один электрон. В этом случае образование молекулы водорода из атомов записывается так:  структурная формула Оказалось, что формулы Льюиса имеют глубокий химический смысл. Мы видим, что связь между атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электронов позволяет образовать ковалентную связь. Впоследствии это предположение подтвердилось квантовой теорией. Формулы с черточками между атомами называются структурными формулами. Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар. Рассмотрим связывание двух атомов хлора 17Cl (слайд 8) (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем электронную формулу для атома хлора и конфигурацию его внешней электронной оболочки: ответ учащегося  Учитель: Число электронов на внешнем уровне? Ученик: На внешнем электронном уровне хлора содержится 2s + 5p = 7 электронов. Учитель: Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками мы обозначили только электроны внешнего, третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона. После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:  При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора. Последнее изображение – структурная формула, в которой поделенная пара электронов обозначена черточкой. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой (связывающей). Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании. Льюис не только предложил теорию ковалентной связи, но и первым сформулировал правило октета-дублета. Это правило применительно к химическим связям можно сформулировать так: атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных газов. Два атома водорода, объединившись в молекулу, приобрели "завершенную” молекулярную оболочку, подобную завершенной электронной оболочке атома благородного газа гелия (1s2). Атомы хлора в молекуле приобрели молекулярную оболочку, похожую на завершенную оболочку атома аргона (...3s23p6). Связь между атомами может осуществляться не обязательно одной, но и двумя и даже тремя поделенными парами, если этого требует правило октета. Такие связи называются двойными и тройными. Рассмотрим образование связи для молекулы кислорода и азота. Приведите электронную конфигурацию для атома кислорода, распределение электронов по квантовым ячейкам, укажите сколько электронов на последнем электронном уровне, сколько неподеленных пар ответ учащегося 1s22s22p4 +8O На внешнем электронном уровне 6 электронов, три неподеленные пары. Учитель: таким образом, только что рассмотренный нами кислород может образовывать двухатомную молекулу с октетом электронов у каждого атома только тогда, когда между атомами помещаются две поделенные пары(слайд 9):  И для атома азота приведите электронную конфигурацию, а главное распределение электронов по квантовым ячейкам ответ учащегося 1s22s22p3 +7N  Учитель: Атомы азота (...2s2 2p3 на последней оболочке) также связываются в двухатомную молекулу, но для организации октета электронов им требуется расположить между собой уже три поделенные пары (слайд 10):  Принято изображать электронные пары (то есть химические связи) между атомами черточками. Каждая черточка – это поделенная пара электронов. В этом случае уже знакомые нам молекулы выглядят так:  Формулы с черточками между атомами называются структурными формулами. Структурные формулы очень хороши для изображения молекул: они четко показывают – как атомы связаны между собой, в каком порядке, какими связями. Связывающая пара электронов в формулах Льюиса – то же самое, что одна черточка в структурных формулах. Двойные и тройные связи имеют общее название – кратные связи. О молекуле азота говорят, что она имеет порядок связи, равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора – один. У водорода и хлора уже не кратная, а простая связь. Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь. Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков(слайд 11).
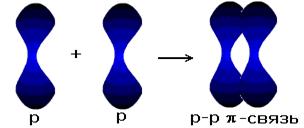
у-связь значительно прочнее р-связи, причём р-связь может быть только у-связью. За счёт этой связи образуются двойные и тройные кратные связи. Если электронные орбитали перекрываются по линии, соединяющей ядра атомов, то такая связь называется у-связью (сигма-связью). В случае образования р – р-связей (двойная или тройная) из-за взаимно перпендикулярного расположения в атомах р-электронных орбиталей только одна из связей может быть у-связью. Остальные р-электронные орбитали перекрываются по обе стороны от линии, соединяющей ядра атомов. Такая связь называется р-связью ( пи-связью). Молекулы многих соединений состоят из атомов разного вида и поэтому содержат полярные ковалентные связи. Например, полярные ковалентные связи присутствуют в соединениях:  Полярные ковалентные связи образуются между атомами с разной электроотрицательностью. Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью. Рассмотрим образование молекулы хлороводорода (слайд 12) 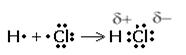 За счёт смещения электронов от водорода к хлору атом хлора заряжается частично отрицательно, водорода – частично положительно. В образовании молекулы H2S участвуют два атома Н (1s1) и S (…3s23p4). Электронная формула молекулы Н :S:H, cтруктурная формула Н – S – H (слайд 13). Образование молекулы воды. Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s1) и кислорода (...2s2 2p4). Затем записываем электронные формулы, которые наглядно показывают, как образуются “завершенные” электронные оболочки рядом с атомами водорода и кислорода в молекуле воды (слайд 14):  Оказывается, для этого необходимо взять именно два атома водорода на один атом кислорода. Однако природа такова, что акцепторные свойства атома кислорода выше, чем у атома водорода (о причинах этого чуть позже). Поэтому связывающие электронные пары для воды слегка смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды.  Для примера рассмотрим диоксид серы SO2. Кислород и сера имеют похожие валентные оболочки (...2s2 2p4) и (...3s2 3p4), но внешние электроны серы находятся дальше от ядра и притягиваются к ядру слабее, чем у кислорода. Из-за этого поделенные электронные пары в молекуле SO2 смещены вдоль химических связей в сторону атомов кислорода, которые приобретают частичный отрицательный заряд. Такой частичный заряд обозначают греческой буквой "дельта". Атом серы приобретает частичный положительный заряд, а атомы кислорода – частичный отрицательный заряд.  В образовании молекулы NH3 принимают участие три атома водорода (1s1) и атом азота (...2s2 2p3). Структурная формула 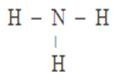 , у атома азота остается одна неподеленная электронная пара (слайд 15). , у атома азота остается одна неподеленная электронная пара (слайд 15).Соединения с ковалентными неполярными и полярными связями в обычных условиях часто являются газами или жидкостями. Если это твердые вещества, то плавятся они достаточно легко, хотя есть и исключения. Растворы таких веществ далеко не всегда проводят электрический ток, потому что при растворении они могут и не распадаться на ионы. Типичные соединения с полярными ковалентными связями: хлороводород HCl, углекислый газ СО2, вода Н2О, песок SiO2, многочисленные органические соединения. Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (слайд 16). 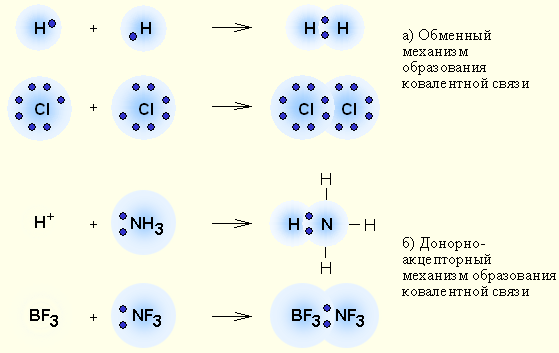 Донорно-акцепторная связь координационная связь, термин, обозначающий один из способов образования химической ковалентной связи. Обычная ковалентная связь между двумя атомами обусловлена взаимодействием двух электронов — по одному от каждого атома. Донорно-акцепторная связь осуществляется за счёт пары электронов одного атома (донора) и свободной (незаполненной) орбитали другого (акцептора) (слайд 17, 18). Схематически это различие можно выразить так: В обоих случаях электроны становятся общими для двух атомов. Типичным примером является образование иона аммония при реакции аммиака с ионом водорода (протоном)(слайд19): 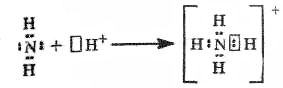 В молекуле аммиака азот имеет неподелённую пару электронов, у иона водорода 1s-орбиталь свободна. При достаточном сближении молекулы NH3 и иона Н+ двухэлектронное облако азота попадает в сферу притяжения иона водорода и становится общим и для атома азота, и для атома водорода, т. е. возникает четвёртая ковалентная связь N — Н. Все связи N — Н в этом ионе становятся равноценными и неразличимыми. Ещё один важный пример — образование иона оксония (слайд 20):  В данном случае молекула воды — донор, протон — акцептор. Этот способ образования ковалентной связи играет большую роль в химии комплексных соединений IV. Закрепление изученного материала. VI. Д /з. § 7 |