урок химии 8 класс. вещества и их свйства. Вещества и их свойства
 Скачать 71.3 Kb. Скачать 71.3 Kb.
|
|
Обобщение и систематизация знаний по теме «Вещества и их свойства» Цель урока: образовательные: Повторение и закрепление материала, пройденного по теме «Вещества и их свойства»: классификация, номенклатура, физические и химические свойства кислот, оснований, амфотерных соединений и генетической связи органических и неорганических соединений, объяснить результат практического осуществления ОВР. развивающие: Развитие у учащихся логических мыслительных операций: умение анализировать, сравнивать и делать выводы, практических навыков, развитие критического мышления. воспитательные: Формировать положительную мотивацию к учению, добросовестное отношение к учебному труду. Оборудование: мультимедийное, набор реактивов Ход урока Мотивация: «Ребята, вы заканчиваете учебу в школе, и на самые последние уроки к нам приехали гости – учителя химии и биологии района, поэтому нам надо постараться лучше показать знания, которые вы приобрели по моему предмету, работайте активно, не бойтесь ошибиться, ошибки можно исправить, ведь учитель пока еще рядом с вами!» План урока: 1) Классификация веществ; 2) Неорганические и органические кислоты, основания, амфотерные соединения: определения классификация хим. свойства 3) Генетическая связь органических и неорганических соединений; 4) Практическое осуществление ОВР 5) Итоги урока. Классификация веществ Какие бывают вещества? (неорганические и органические) Классификация неорганических веществ (простые и сложные) Определение простых и сложных в-в Классификация простых веществ. (металлы, неметаллы, благородные газы: строение атомов, виды хим. связи, типы кристаллических решеток, особенность свойств веществ. (составление таблицы)
Классификация сложных веществ: - оксиды (несолеобразующие и солеобразующие: основные, кислотные и амфотерные); - гидроксиды (кислоты, основания, амфотерные гидроксиды); - соли (средние, кислые, основные, двойные, комплексные). 6) Дайте названия, распределите вещества согласно классификации: S8, AI(OH)3, H2SO3, NO, BaO, P2O5, HI, Mg(OH)2, NaHSO3, (ZnOH)CI, KNO3, KAI(SO4)2, Na3[AIF6], NH4Fe(SO4)2 Неорганические вещества  Простые Сложные Простые Сложныем     еталлы еталлын  еметаллы оксиды гидроксиды соли еметаллы оксиды гидроксиды соли     солеобразующие основания двойные средние солеобразующие основания двойные средниеблагородные газы - основные - растворимые   - амфотерные - амфотерные основные кислые - амфотерные - амфотерные основные кислые- кислотные - нерастворимые   несолеобразующие кислоты комплексные несолеобразующие кислоты комплексные- кислородсодержащие - бескислородные - одноосновные - двухосновные - трехосновные Написать уравнения электролитической диссоциации (NaHSO3, (ZnOH)CI, KNO3, KAI(SO4)2, Na3[AIF6], NH4Fe(SO4)2) Классификация органических веществ: А) вид углеродной цепи (ациклические, циклические: карбоциклические, гетероциклические) Б) наличие кратных связей Органические вещества Ациклические Циклические        предельные непредельные карбоциклические гетероциклические - алканы - алкены предельные непредельные карбоциклические гетероциклические - алканы - алкены- алкадиены предельные непредельные ароматические - алкины - циклоалканы - циклоалкены - арены - циклоалкины 2. Неорганические и органические КИСЛОТЫ ОСНОВАНИЯ АМФОТЕРНЫЕ СОЕДИНЕНИЯ Определения: по структурной, электролитической, протолитической теориям Классификация Хим. свойства Дайте характеристику по классификации и хим. св-вам след. веществ Сравните кислотные и основные свойства Н3РО4, H2SO4, HCIO4; НСООН, CH3COOH, С2Н5СООН; HF, HCI, HBr; LiOH, NaOH, KOH; NH3, CH3NH2, (CH3)2 NH, С6H5NH2, (С6H5)2 NH H2SO4 – серная кислота, кислородсодержащая, двухосновная, растворимая, нелетучая, сильная, стабильная, проявляет кислотные свойства; CH3COOH – уксусная кислота, кислородсодержащая органическая кислота, одноосновная, растворимая, летучая, слабая, стабильная, проявляет кислотные свойства; KOH – гидроксид калия, кислородсодержащая, двукислотная, растворимая, нелетучая, стабильная, проявляет основные свойства; NH3 – аммиак, бескислородное основание, растворимое, летучая щелочь, проявляет основные свойства; CH3NH2 – метиламин, бескислородное органическое основание, растворимое, летучая, стабильное, проявляет основные свойства; Вывод: Неорганические и органические кислоты обладают общими свойствами за счет атомов водорода, способных замещаться на атомы металлов. Общими свойствами для неорганических и органических оснований является их взаимодействие с кислотами, при котором кислота отщепляет протон водорода, а основание притягивает, образуются соль и вода. Назовите неорганические и органические вещества, проявляющие амфотерные свойства Zn(OH)2 – гидроксид цинка, нерастворимый гидроксид, нестабильный, разлагается при нагревании, нелетучий, проявляет амфотерные свойства; CH3CH(NH2)COOH – аминопропионовая кислота (аланин), органическое амфотерное соединение, растворимое, проявляет амфотерные свойства. Н2О – вода. Допишите уравнения реакций 1 группа: H2SO4 + КОН → CH3COOH + Mg(OH)2→ 2 группа: NH3 + HCI → CH3NH2 + H2SO4 → 3 группа: Zn(OH)2 + КОН → CH3CH(NH2)COOH + HCI → Н2О + НСI → Н2О + NН3 → - Если в-ва находятся в твердом виде, то необходима большая температура, происходит спекание. В результате образуются твердые соединения – мета- и ортоформы - Если в-ва находятся в растворе, образуются комплексные соединения Вывод: Амфотерные свойства проявляют оксиды и гидроксиды переходных металлов, а не типичных металлов и типичных неметаллов. В зависимости от того с каким соединением взаимодействует (сильным основанием или сильной кислотой) проявляет основные или кислотные свойства. Органические соединения проявляют амфотерные свойства из-за наличия двух функциональных групп: карбоновых кислот – органических кислот и аминов – органических оснований. Понятия «кислота» и «основание» являются относительными. Т.к. гидроксид является «кислотой» или «основанием», т.е. проявляет кислотные и основные свойства, в зависимости от того с чем взаимодействует. Генетическая связь неорганических соединений Составьте генетический ряд для след. элементов Ва, Сu, S, Si Практическое осуществление ОВР ОВР между KMnO4 и Na2SO3 в различных средах (кислой, нейтральной и щелочной). Объясните свои наблюдения. Чем определяется состав продуктов восстановления? В три пробирки наливаем розовый раствор KMnO4 В 1 пробирку добавляем H2SO4 Во 2 – Н2О дист. В 3 – КОН р-р Затем в каждую пробирку вносим несколько кристаллов Na2SO3 В 1 пробирке розовый раствор становится бесцветным Во 2 – выпадает бурый осадок В 3 – розовый раствор становится зеленым H+ M 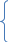 nO4- → Mn2+ (MnSO4) бесцветный nO4- → Mn2+ (MnSO4) бесцветныйKMnO4 H2O MnO4- → MnO2↓ бурый порошок OH- MnO4- → MnO42- (K2MnO4) зеленый цвет Написать уравнение ОВР, расставить коэффициенты Итоги урока Дом. задание: подг. к контр. работе |
