Методичка ОВР. Высшего профессионального образования
 Скачать 238.62 Kb. Скачать 238.62 Kb.
|
                   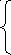             МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Р.Е. АЛЕКСЕЕВА» Кафедра «Общая и неорганическая химия» ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных форм обучения Нижний Новгород 2012 Составители: А.Д. Самсонова, А.Л.Галкин, Т.В.Сазонтьева УДК 54 (07) Окислительно-восстановительные реакции: методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных форм обучения/ НГТУ им. Р.Е. Алексеева сост.: А.Д. Самсонова, А.Л.Галкин,Т.В.Сазонтьева. Н.Новгород, 2012. 36 с. Предложены теоретическая часть, вопросы и задачи для домашних и практических занятий, а также описание лабораторных работ по теме «Окислительно-восстановительные реакции» Научный редактор Паничева Г.А. Редактор Э. Б. Абросимова Подп. к печ. 10.09.2012 Формат 60х84 1/16. Бумага газетная. Печать офсетная. Печ. л. 2,25. Уч.-изд. л. . Тираж 1500 экз. Заказ Нижегородский государственный технический университет Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24. © Нижегородский государственный технический университет, им. Р.Е. Алексеева, 2012 Теоретическая часть ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Химические реакции можно разделить на два типа. К первому относятся реакции, которые идут без изменения степени окисления атомов реагирующих веществ. В таких реакциях взаимодействие электронных оболочек у реагирующих частиц сводится к образованию общих молекулярных орбиталей. Все электроны остаются общей принадлежностью этих частиц, между которыми возникает ковалентная связь. Ко второму типу относятся реакции, которые протекают с изменением степени окисления атомов реагирующих веществ. В таких реакциях столкновение частиц сопровождается переходом электронов от одного из реагентов к другому. Эти реакции получили название «ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ». В отечественной литературе часто используется сокращение ОВР, а в иностранной REDOX от латинских восстановление-окисление. Окислительно-восстановительная реакция – это единый процесс, состоящий из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно. Окисление – это процесс потери электронов атомом, молекулой или ионом. Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Частица, отдающая свои электроны, в ходе реакции окислятся. Ее принято называть ВОССТАНОВИТЕЛЕМ (обозначим ее как ВОС): ВОС - n  → продукт окисления (окисленная форма). → продукт окисления (окисленная форма).Частица, которая эти электроны присоединяет, в ходе реакции восстанавливается. Ее принято называть ОКИСЛИТЕЛЕМ (обозначим ее как ОК): ОК + n  → продукт восстановления (восстановленная форма). → продукт восстановления (восстановленная форма).3 Например, в реакции  + + 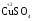 → →  + +  - 2 - 2 → → 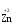 (полуреакция окисления) (полуреакция окисления)Восстановитель окисленная форма  +2 +2 = → = → (полуреакция восстановления) (полуреакция восстановления)Окислитель восстановленная форма Окислительно-восстановительные реакции очень широко распространены в природе. К ним относятся реакции фотосинтеза у растений, дыхание живых организмов, процессы горения и коррозии металлов и многие другие. СТЕПЕНЬ ОКИСЛЕНИЯ Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами. В отличие от реально существующих зарядов у ионов, степень окисления показывает лишь условный заряд атома в молекуле. Она может быть отрицательной, положительной и нулевой. Например, степень окисления атомов в простых веществах равна «0» (  , , 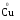 , , 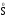 , , 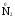 ). В химических соединениях атомы могут иметь постоянную степень окисления или переменную. У металлов главных подгрупп I, II и III групп Периодической системы в химических соединениях степень окисления, как правило, постоянна и равна соответственно Ме+1, Ме+2 и Ме+3 (Li+, Ca+2, Al+3). У атома фтора всегда -1. У хлора в соединениях с металлами всегда -1. В подавляющем числе соединений кислород имеет степень окисления -2 (кроме пероксидов, где его степень окисления -1), а водород +1(кроме гидридов металлов, где его степень окисления -1). ). В химических соединениях атомы могут иметь постоянную степень окисления или переменную. У металлов главных подгрупп I, II и III групп Периодической системы в химических соединениях степень окисления, как правило, постоянна и равна соответственно Ме+1, Ме+2 и Ме+3 (Li+, Ca+2, Al+3). У атома фтора всегда -1. У хлора в соединениях с металлами всегда -1. В подавляющем числе соединений кислород имеет степень окисления -2 (кроме пероксидов, где его степень окисления -1), а водород +1(кроме гидридов металлов, где его степень окисления -1).4 Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях. В молекуле серной кислоты H2SO4 атом водорода имеет степень окисления +1, а атом кислорода -2. Так как атомов водорода два, а атомов кислорода четыре, то мы имеем два «+» и восемь «-». До нейтральности не хватает шесть «+». Именно это число и является степенью окисления серы -  . Молекула дихромата калия K2Cr2O7 состоит из двух атомов калия, двух атомов хрома и семи атомов кислорода. У калия степень окисления всегда +1, у кислорода -2. Значит, мы имеем два «+» и четырнадцать «-». Оставшиеся двенадцать «+» приходятся на два атома хрома, у каждого из которых степень окисления равна +6 ( . Молекула дихромата калия K2Cr2O7 состоит из двух атомов калия, двух атомов хрома и семи атомов кислорода. У калия степень окисления всегда +1, у кислорода -2. Значит, мы имеем два «+» и четырнадцать «-». Оставшиеся двенадцать «+» приходятся на два атома хрома, у каждого из которых степень окисления равна +6 (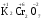 ). ). ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества , содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления. К наиболее сильным окислителям относятся: 1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F2, O2, Cl2, S); 2) вещества, содержащие элементы в высших и промежуточных 5 положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO4-); 3) перекисные соединения. Конкретными веществами, применяемыми на практике в качестве окислителей, являются кислород и озон, хлор, бром, перманганаты, дихроматы, кислородные кислоты хлора и их соли (например, 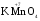 , , 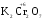 , , 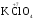 ), азотная кислота ( ), азотная кислота (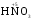 ), концентрированная серная кислота ( ), концентрированная серная кислота (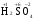 ), диоксид марганца ( ), диоксид марганца ( ), пероксид водорода и пероксиды металлов ( ), пероксид водорода и пероксиды металлов (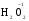 , , ). ).К наиболее сильным восстановителям относятся: 1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»); 2) катионы металлов в низжих степенях окисления (Fe2+); 3) простые элементарные анионы, например, сульфид-ион S2-; 4) кислородосодержащие анионы (оксоанионы), соответствующие низшим положительным степеням окисления элемента (нитрит 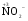 , сульфит , сульфит  ). ).Конкретными веществами, применяемыми на практике в качестве восстановителей, являются, например, щелочные и щелочноземельные металлы, сульфиды, сульфиты, галогенводороды (кроме HF), органические вещества – спирты, альдегиды, формальдегид, глюкоза, щавелевая кислота, а также водород, углерод, моноксид углерода (  ) и алюминий при высоких температурах. ) и алюминий при высоких температурах.В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от 6 «партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO2- в кислой среде выступает в роли окислителя по отношению к иону I-: 2 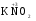 + 2 + 2 + 4 HCl→ + 4 HCl→  + 2 + 2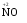 + 4KCl + 2H2O + 4KCl + 2H2Oи в роли восстановителя по отношению к перманганат-иону MnO4- 5 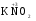 + 2 + 2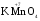 + 3H2SO4 → 2 + 3H2SO4 → 2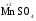 + 5 + 5 + K2SO4 + 3H2O + K2SO4 + 3H2OКЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Основой для классификации ОВР служит местоположение окислителя и восстановителя. 1. Межатомные (а) или межмолекулярные (б) ОВР. Окислитель и восстановитель входят в состав разных веществ. а) 2  + + 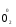 = 2 = 2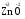 б) 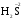 + 2 + 2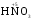 = = 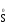 + 2 + 2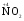 + 2H2O + 2H2O2. Внутримолекулярные ОВР. Окислитель и восстановитель входят в состав одного вещества. 2 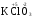 = 2 = 2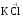 + 3 + 3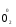 3. Реакции диспропорционирования (дисмутации, самоокисления-самовосстановления). Окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в промежуточной степени окисления и входящие в состав одного вещества. Часть атомов повышает свою степень окисления, а другая часть ее понижает. 3 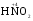 = = 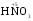 + 2 + 2 + H2O + H2O4. Реакции конпропорционирования – это реакции, в которых атомы одного и того же элемента имеют разные степени окисления, переходят к промежуточной степени окисления. 7 Реакции конпропорционирования могут быть: а) внутримолекулярными (в соединении имеется элемент с разными степенями окисления):  = =  + 2 H2O + 2 H2Oб) межмолекулярными (в разных соединениях имеется один и тот же элемент с разными степенями окисления) 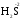 + + 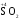 3 S0 + 2 H2O 3 S0 + 2 H2OСОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ При составлении уравнений ОВР нужно учесть, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. В химии условный заряд электрона принят за «-1» и обозначается  Для подбора стехиометрических коэффициентов можно использовать несколько методов, из которых наиболее распространены два: метод электронного баланса и метод электронно-ионных уравнений (метод полуреакций). Для подбора стехиометрических коэффициентов можно использовать несколько методов, из которых наиболее распространены два: метод электронного баланса и метод электронно-ионных уравнений (метод полуреакций).1.Метод электронного баланса является наиболее универсальным методом, и применим для любых окислительно-восстановительных процессов, протекающих в любых системах (растворы, расплавы, газы). В основе метода лежит принцип сравнения степеней окисления атомов в исходных веществах и в продуктах реакции с последующим составлением схемы электронного баланса. В качестве примера рассмотрим реакцию взаимодействия дихромата калия с сероводородом в кислой среде: 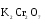 + +  + + 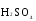 → → + +  + + 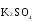 + + 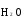 Для расстановки коэффициентов выполняем следующие действия. 1.1. Определяем элементы, атомы которых изменяют степень окисления: 8 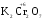 + + 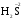 + + 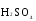 → → + + 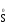 + + 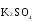 + + 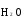 1.2. Находим окислитель и восстановитель в данной ОВР, составляем схему перехода электронов от восстановителя к окислителю и пишем отдельно электронные уравнения процессов окисления и восстановления, с учетом того, что количество атомов, входящих в соединение, должно сохраняться. Например, в  имеется два атома Cr, следовательно, в схеме они должны присутствовать: имеется два атома Cr, следовательно, в схеме они должны присутствовать: +5ē -2ē 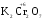 + + 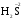 + + 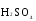 → → + + 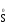 + + 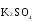 + + 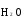 окислитель восстановитель 2Cr+6 + 6  = 2Cr+3 (а) - восстановление = 2Cr+3 (а) - восстановлениеS-2 - 2  = S0 (б) - окисление = S0 (б) - окисление1.3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс). В приведенной схеме необходимо уравнение (б) умножить на 3, тогда будет принято и отдано по 6 электронов. После умножения уравнения складываются как обычные алгебраические, а электроны сокращаются. 2Cr+6 + 6  = 2Cr+3 1 = 2Cr+3 1+ S-2 - 2  = S0 3 = S0 32Cr+6 +3S-2 = 2Cr+3 + 3 S0 1.4. Полученные коэффициенты называют основными. Они переносятся в молекулярную схему реакции и ставятся перед соответствующими веществами. Так как в молекулах дихромата калия и сульфата хрома содержится по два атома хрома, двойки перед этими веществами опускаются. K2Cr2O7 + 3H2S + H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + H2O 1.5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения. Продукты реакции (Cr2(SO4)3, K2SO4), 9 имеющие коэффициенты по единице, содержат 4 моль сульфат-ионов (SO42-), которые содержатся в серной кислоте, следовательно, перед ней ставится коэффициент 4. Чтобы количество атомов водорода было одинаково в левой и правой части уравнения, перед водой ставится коэффициент 7: K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O Проверка количества остальных атомов показывает, что все коэффициенты подобраны. 2. Метод электронно-ионных уравнений (метод полуреакций) применяется для подбора коэффициентов в уравнениях реакций, протекающих в растворах. Метод оперирует с реально существующими в растворах частицами и позволяет учитывать влияние среды раствора (т.е. рН) на процессы окисления и восстановления частиц. В качестве частиц среды в водных растворах могут принимать участие следующие частицы. Таблица 1
В качестве примера рассмотрим ту же реакцию. 2.1. Молекулярная схема реакции: K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O 2.2. Записываем это уравнение в ионно-молекулярной форме. Для этого необходимо все сильные электролиты представить в виде ионов, а слабые электролиты, газы и малорастворимые вещества оставляем в виде молекул. К сильным электролитам относятся все хорошо растворимые соли, часть кислот (HCl, HNO3, H2SO4 и др.), щелочи (LiOH, NaOH, KOH и др.). Степень окисления атомов не используют, а учитывают заряды реальных ионов и характер среды, в которой идет окислительно-восстановительный процесс. 10 2K+ + Cr2O7-2 + H2S + 2H+ + SO4-2 = 2Cr+3+3SO4-2 + S0 + 2K+ +SO4-2 + H2O кислая среда 2.3. Определяем частицы, изменившие свой заряд или состав: Cr2O7-2 → 2Cr+3 и H2S → S0 2.4. На основании этих превращений составляем полуреакции окисления и восстановления с участием частиц среды (см. табл.1). Анион дихромата потерял 7 моль атомов кислорода, которые в кислой среде связываются 14 моль ионами водорода и превращаются в воду. Молекула сероводорода потеряла 2 моль ионов водорода. Cr2O7-2 + 14Н+ → 2Cr+3 + 7Н2О H2S → S0 + 2Н+ 2.5. Полученные полуреакции необходимо уравнять по зарядам. В первом уравнении слева суммарный заряд равен (+12), а справа – (+6), значит, дихромат-ион присоединил 6 электронов и восстанавливается. Во втором уравнении слева (0), а справа – (+2). Молекула сероводорода потеряла 2 электрона и окислилась. Cr2O7-2 + 14Н+ +6  → 2Cr+3 + 7Н2О → 2Cr+3 + 7Н2ОH2S - 2  → S0 + 2Н+ → S0 + 2Н+2.6. Для соблюдения электронного баланса второе уравнение необходимо умножить на 3, после чего просуммировать уравнения. Cr2O7-2 + 14Н+ +6  → 2Cr+3 + 7Н2О 1 → 2Cr+3 + 7Н2О 1+ H2S - 2  → S0 + 2Н+ 3 → S0 + 2Н+ 3 Cr2O7-2 + 14Н+ + 3H2S = 2Cr+3 + 7Н2О + 3S0 + 6Н+ После сокращения подобных частиц в левой и правой частях уравнения получим суммарное ионно-молекулярное уравнение, которое отражает смысл произошедшей реакции. Cr2O7-2 + 8Н+ + 3H2S = 2Cr+3 + 7Н2О + 3S0 Перенос полученных коэффициентов в молекулярную схему реакции позволяет получить ее полное уравнение: 11 K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O Иногда в реакции окислитель является одновременно и средой. Например, в реакции: I2 + HNO3® HIO3 +NO2 +H2O азотная кислота HNO3 одновременно содержит окислитель ион NO3- и создает кислую среду (наличие ионов Н+). Представим молекулярное уравнение в ионно-молекулярном виде: I2 + H+ + NO3-® IO3- +NO2 +H2O Далее составим полуреакции окисления и восстановления с участием частиц среды (см.табл.1) и для соблюдения электронного баланса умножим первое уравнение на 10, а затем полуреакции просуммируем : NO3- + 2H+ +ē®NO2 +H2O 10 I2 + 6H2O - 10ē ® 2IO3- + 12H+ 10NO3- + 20 H+ + I2 + 6H2O®10NO2 +10 H2O + 2 IO3- + 12H+ После сокращения подобных частиц в левой и правой частях уравнения получим суммарное ионно-молекулярное уравнение: 10NO3- + 8 H+ + I2 ®10NO2 +4 H2O + 2 IO3- Затем полученные коэффициенты перенесем в молекулярную схему реакции. Учитывая, что ионы NO3- и H+ входят в состав одного и того же соединения, а количество их разное, перед HNO3 ставится максимальный коэффициент, так как. часть азотной кислоты расходуется на создание кислой среды. Таким образом, полное уравнение: I2 + 10HNO3®2HIO3 +10NO2 +4H2O Метод полуреакций позволяет определить коэффициенты перед всеми веществами, участвующими в реакции, что значительно упрощает подбор дополнительных коэффициентов. 12 |
