Реферат. Водород. Водород и его соединения
 Скачать 28.64 Kb. Скачать 28.64 Kb.
|
|
Нижегородская Государственная Медицинская Академия Кафедра общей химии Реферат на тему «Водород и его соединения» Выполнила: студентка 1 курса пед. факультета 117 группы Нижний Новгород, 2016 г. Электронно-графическая формула. Место нахождения элемента в природе. История открытия. Водород элемент первого периода, поэтому единственный электрон занимает находящуюся на первом энергетическом уровне s-орбиталь, имеющую наименьшую энергию. Электронная формула атома водорода будет иметь вид: 1S1. Электронно-графическая формула водорода будет иметь вид: 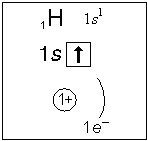 Обычная форма существования элемента в свободном состоянии - двухатомная молекула. Водород широко распространен в природе – содержится в воде, во всех органических соединениях, в свободном виде – в некоторых природных газах. Содержание его в земной коре достигает 0,15% её массы (с учетом гидросферы – 1%). Водород составляет половину массы Солнца. Он является наиболее распространенным элементом в космосе (в состав космической материи входит 63%). В природе водород встречается в виде двух изотопов – протия (99,98%) и дейтерия (0,02%). Поэтому в обычной воде содержатся небольшие количества тяжелой воды. Важнейшие природные соединения – вода, метан, нефть. Вода – оксид водорода – одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, - она всегда содержит примеси. История открытия водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется газ. Первоначально его назвали «горючим воздухом». Спустя примерно 100 лет этот газ научились собирать. Во второй половине XVIII века английский ученый Г. Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ при сгорании на воздухе образует воду. Г. Кавендиша считают первооткрывателем водорода (1766 г.). Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 г. Французским химиком А. Лавуазье. Он и дал этому веществу латинское название, которое происходило от греческих слов «хюдор» — вода и «геннао» — рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium. Физические свойства. Водород – это самый легкий газ (он в 14,4 раза легче воздуха), не имеет цвета, вкуса и запах. Мало растворим в воде (в 1л воды при 200С растворяется 18 мл водорода). При температуре -252,8оС и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен, очень легок и текуч. Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0оС (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0оС и кипит при 100оС при давлении 101 325 Па. Она очень плохо проводит теплоту и электричество. Вода – хороший растворитель. Пероксид водорода представляет собой бесцветную жидкость с Тпл = -0,41оС и Ткип = 150,2оС. В чистом виде пероксид водорода очень взрывоопасен. Химические свойства. В соединениях водород всегда одновалентен. Для него характерна степень окисления +1, но в гидридах металлов она равна -1. Реакции с простыми веществами Водород взаимодействует как восстановитель: а) с кислородом при поджигании или внесении в водородную смесь Pt-катализатора: 2Н2о + О2 = 2Н2О + 572 кДж (смесь двух объемов Н2 и 1 объема О2 при поджигании взырвается (так называемый «гремучий газ») б) с серой при нагревании 150-300оС (реакция обратима): Н2о + S ↔ Н2S в) с хлором при поджигании или при облучении смеси газов УФ-светом: Н2о + Cl2 = 2НCl г) с фтором при обычных условиях: Н2о + F2 = 2НF д) с азотом при повышенном давлении и нагревании в присутствии катализатора (реакция обратима): 3Н2о + N2 ↔ 2NH3 Как окислитель водород взаимодействует только с активными (щелочными и щелочно-земельными) металлами. В результате образуются гидриды металлов: Н2о + 2Na = 2NaН Н2о + Ca = CaН2 Реакции со сложными веществами а) при высокой температуре водород может восстанавливать большинство оксидов металлов: Н2о + CuO = Cu + Н2O б) при взаимодействии водорода с оксидом углерода (II) можно получить метиловый спирт: 2Н2о + CO = CН3OH д) Водород способен присоединяться ко многим органическим молекулам. Такие реакции называются реакциями гидрирования: CH2=CH2 + H2 → CH3-CH3 3. Свойства пероксида водорода а) как кислота взаимодействует с основаниями: Н2О2 + Ва(ОН)2 = ВаО2 + 2Н2О б) при хранении на свету, нагревании, в присутствии катализатора разлагается (реакция диспропорционирования): 2Н2О2 = 2Н2О + О2 в) с типичными восстановителями проявляет свойства окислителя: Н2О2 + КNО2 = КNО3 + Н2О Н2О2 + 2KJ = J2 + 2KОH г) с сильными окислителями проявляет восстановительные свойства: Н2О2 + 2КMnО4 + 3H2SO4 = 8Н2О + 2MnSО4 + K2SO4 + 5O2 Свойства воды а) при обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами: Н2О + Na2O = 2NaOH Н2О + SО2 = Н2SО3 2Н2О + Li = 2LiOH + Н2↑ 2Н2О + Ca = Ca(OH)2 + Н2↑ б) образует гидраты: Н2О + H2SO4 = H2SO4 * Н2О Н2О + NaOH = NaOH * Н2О 10Н2О + Na2CO3 = Na2CO3 * 10Н2О 5Н2О + CuSO4 = CuSO4 * 5Н2О Медико-биологическое значение. Содержание в организме человека Содержание водорода в организме взрослого человека составляет около 10% (7 кг на 70 кг массы тела). Водород как отдельный элемент не обладает биологической ценностью. Для организма важны соединения, в состав которых он входит, а именно вода, белки, жиры, углеводы, витамины, биологически активные вещества (за исключением минералов) и т.д. Наибольшую ценность, конечно, представляет соединение водорода с кислородом – вода, которая фактически является средой существования всех клеток организма. Другой группой важных соединений водорода являются кислоты – их способность высвобождать ион водорода делает возможным формирование рН среды. Немаловажной функцией водорода также является его способность образовывать водородные связи, которые, например, формируют в пространстве активные формы белков и двухцепочечную структуру ДНК. К чему приводит избыток и дефицит Дефицита водорода как такового не бывают, наблюдают дефицит его соединений, например, воды при ее недостаточном поступлении в организм или некомпенсированном ускоренном выведении. В этом случае наблюдают: обезвоживание, чувство жажды, снижение тургора тканей, сухость кожи и слизистых оболочек, повышение концентрации крови, артериальная гипотензия. Избытка водорода как такового тоже не бывает, возможен избыток поступления его соединений. В этом случае наблюдают картину, характерную для конкретного соединения. Например, в случае избытка воды (гипергидратация) чаще всего наблюдают отеки. В каких продуктах содержится Водород содержится практически во всех пищевых веществах, однако основное его количество попадает в организм в виде воды. Фармацевтические препараты Пероксид водорода (Н2О2) применяют как дезинфицирующее средство в медицине для полосканий, промываний и как кровеостанавливающее средство в виде 3%-го раствора. Для фармацевтической и медицинской промышленности требуется глубоко обессоленная вода, соответствующая качеству дистиллированной воды с солесодержанием 0,5-2 мг/л. Дистиллированная вода – фармакопейный препарат для приготовления лекарственных форм (рН = 5.2 – 6.8). Апирогенная вода не содержит веществ (метаболитов или продуктов жизнедеятельности бактерий), вызывающих при введении в организм повышение температуры тела и другие нежелательные реакции. Вода для инъекций применяется при приготовлении лекарственных форм в качестве растворителя инъекционных и инфузионных препаратов. Натрия гидрокарбонат (NaHCO3) применяют при повышенной кислотности желудочного сока в виде порошка, в виде таблеток и раствора применяют для промывания слизистых оболочек глаз, в виде капель для ушей. Борная кислота (Н3ВО3) является антисептическим и дезинфицирующим средством, используется в качестве антибактериального, противогрибкового, противопаразитарного (противопедикулезного) средства. Алюмния гидроокись (Al(OH)3 * H2O) обладает адсорбирующим и обволакивающими свойствами. N-(4-Гидроксивенил)ацетамид (С8Н9NO2) является жаропонижающим и болеутоляющим средством. Список литературы Г. П. Хомченко. Пособие по химии для поступающих в ВУЗы / Под ред. Н. Б. Богданова. – М.: РИА «Новая волна»: Издатель Умеренков, 2013. – 201-205 с. А. С. Егоров, К. П. Шацкая и др. Репетитор по химии / Под ред. А. С. Егорова. – Ростов н/Д: Феникс, 2014. – 368-375 с. Н. Н. Глущенко, Т. В. Плетнева, В. А. Попков. Фармацевтическая химия / Под ред. Т.В. Плетневой. – М.: Издательский центр «Академия», 2004. http://abouthist.net/xvii-vek/istoriya-otkrytiya-vodoroda.html http://eat-info.ru/references/microelements/vodorod/ http://rsmu.ru/fileadmin/rsmu/img/lf/coboh/educate/pharmaceutics/General/gen_l_07.pdf |
