Химия. Закон эквивалентов. Окислительно восстановительные реакции Здание Даны массы металла m Ме 6,5 г, его оксида m o 2 6,98 г и сульфида m с
 Скачать 0.7 Mb. Скачать 0.7 Mb.
|
|
Тема 1. Эквивалент. Закон эквивалентов. Окислительно - восстановительные реакции Здание 1. Даны массы металла mМе = 6,5 г, его оксида mO2 = 6,98 г и сульфида mс = 7,46 г. Рассчитайте молярные массы эквивалентов металла, серы, оксида и сульфида металла. По закону эквивалентов составляем пропорцию  Находим массу кислорода в оксиде    Задание 2. Дана эквивалентная масса металла mэ = 4,5 г. Какой объем водорода при 270 С и давлении 2 атм получится при взаимодействии заданной массы металла mМе = 55 г с серной кислотой. Me + H2SO4 = MeSO4 + H2 количество вещества эквивалентов металла 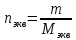 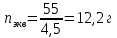 По закону эквивалентов образуется такое же количество водорода. Объем водорода (н.у.)   Исходя из объединенного газового закона считаем объем водорода из приведенных условий 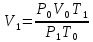 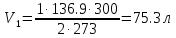 Задание 3. Дана схема реакции KCIO3Hbr-Kcl+Br2+H2O 1. Подчеркните элементы, меняющие степень окисления. KCIO3Hbr-Kcl+Br2+H2O 2. Запишите реакции окисления и восстановления. KClO3+6HBr=>KCl+3Br2+3H2O 3. Подберите множители (основные коэффициенты) для реакции окисления и восстановления так, чтобы число отдаваемых и принимаемых электронов было одинаковым (метод электронного баланса). Cl5+6eCl1 6Br-1-6e Br0 4. Расставьте коэффициенты в схеме реакции. Выпишите вещества: окислитель и восстановитель. Рассчитайте молярные массы эквивалентов окислителя и восстановителя. KClO3 – окислитель HBr – восстановитель молярная масса KClO3 = 122,5 г/моль молярная масса HBr = 80,9 г/моль Тема 2. Строение вещества Задание 1. Для элементов, атомы которых образуют молекулу PbCI4 1. Напишите электронные формулы, подчеркните валентные (формирующие) электроны и определите электронное семейство. Pb (свинец) - элемент с прядковым номером 82 в периодической системе. Находится в VI периоде. Электронная формула атома свинца в порядке возрастания энергий орбиталей: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p2 Электронная формула атома свинца в порядке следования уровней: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p2 Количество валентных электронов в атоме свинца - 4. Формирующим электроном является p -электрон. Хлор в таблице Менделеева занимает 17 место, в III периоде. Cl: 1s2 2s2 2p6 3s2 3p5 Электронное семейство - р-элементы. 2. Укажите квантовые числа для валентных электронов. Pb - 6p2 Cl - 3p5 3. Расположите валентные электроны по энергетическим ячейкам и определите валентность в невозбужденном и возбужденном состояниях. На внешнем электроне находится 6 валентных электронов.        Валентность Pb в невозбужденном состоянии II и возбужденном состоянии III. Невозбужденный атом хлора может показывать валентность I, а в возбужденном состоянии — валентность III. 4. Объясните связь электронного строения элементов с их положением в периодической системе элементов (период, группа, подгруппа). Данные элементы относятся к p – элементам, т.к. находятся в одной группе. Находятся в IV группе, главной подгруппы, поэтому все валентные электроны у него находятся на внешнем энергетическом уровне 5. Определите степени окисления элементов в молекуле. Pb+4CI-14 Задание 2. Дана молекула PbCI4 1. Покажите образование связи в молекуле. Является ли она парамагнитной? 82Pb:[Xe] 4f14 5d10 6s2 6p2 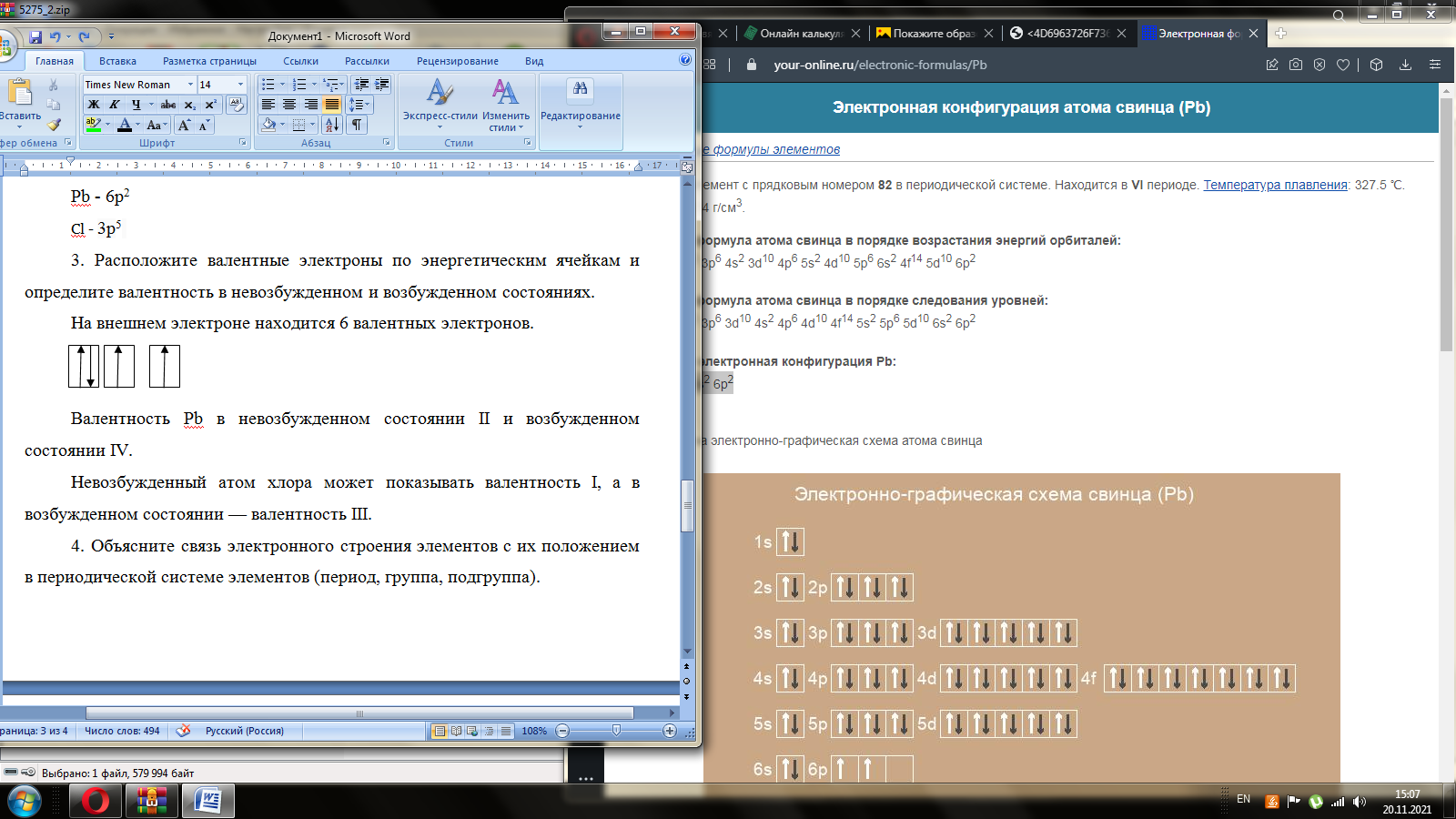 В образовании химических связей участвуют неспаренные электроны четвертого внешнего энергетического уровня энергетического уровня: два электрона в s-и в р состоянии. Со стороны хлора 17Cl: [Ne] 3s2 3p5 в образовании связи принимает участие имеющийся у него в невозбужденном состоянии один неспаренный 3 р-электрон  При образовании молекулы возникают три гибридных электронных облака у атома свинца sр3-гибридизация, которые перекрываются с четырьмя 3р - орбиталями четырех атомов хлора, образуя четыре ковалентные связи. Электроотрицательность хлора больше электроотрицательности свинца (разница электроотрицательность 0,83 eV), поэтому электронная плотность mp больше смещена в сторону хлора, образуя полярную ковалентную связь связь. Является ли она парамагнитной? – нет. 2. Используя аналоги электронной структуры элемента с большей вероятностью в молекуле запишите ряд однотипных молекул и дайте сравнительный анализ их структуры и свойств (валентный угол, энергия и длина связей, полярность молекул). Задание 3. Дан комплексный ион [HgBr4]-2 1. Какой вид химической связи осуществляется в ионе? Дайте определение этому виду связи. [HgBr4]-2 – ионная связь. Ионная связь образуется между атомами металла и неметалла 2. Укажите: а) комплексообразователь - HgBr4 , координационное число - 3 по характеру заряда - анионные (отрицательный заряд внутренней сферы), б) лиганды - Br. 3. Напишите электронную формулу иона комплексообразователя. Укажите, сколько и каких атомных орбиталей участвует в образовании химической связи. Электронная формула атома ртути в порядке следования уровней: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 Электронная формула атома брома в порядке следования уровней: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 4. Напишите электронные формулы атомов лигандов и укажите неподеленные пары электронов донора. 5. Составьте формулу комплексного соединения. 6. Напишите уравнения диссоциации этого соединения в водном растворе и выражение для константы нестойкости комплексного иона. Тема 3. Основные закономерности химических процессов 1. Найдите стандартные энтальпии образования ∆2 H° (298° K) и стандартные энтропии S° (298° K) для всех веществ, участвующих в реакции. CH4 + 4Cl2 =CCl4(Г) +4HCl(Г)
2. Вычислите изменения энтальпии и энтропии при протекании прямой реакции в стандартных условиях. Сделайте вывод, экзо- или эндотермическая данная реакция и объясните знак ∆ S. CH4 + 4Cl2 =CCl4(Г) +4HCl(Г) Δ Ho298(p) = Δ Ho298(CCl4) + 4*Δ Ho298(HCl) - Δ Ho298(CH4)= -397,33 кДж/моль энтропия -21,05Дж/Моль к. 3. Вычислите энергию Гиббса прямой реакции в стандартных условиях ∆G° (298° К) и установите направление самопроизвольного протекания реакции. G = H - (T*S) = (-397.33)-(298*(-21.05)) = 5875,57 Дж ∆G ˂ 0 – процесс протекает самопроизвольно 4. Определите температуру, при которой реакция находится в равновесии. 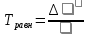 5. Рассчитайте ∆G° при Т=Тр – 100 и Т= Тр + 100 и постройте график зависимости ∆G° и Т. Определите область температур самопроизвольного протекания реакции- и вещество- восстановитель. 6. Вычислите значение константы равновесия (К) для температур: Т=Тр, F Tp -100, T=Tp – 100. Сделайте вывод о влиянии температуры на величину К и на смещение равновесия. 7. Как изменится энтропия, если к продуктам, полученным в результате реакции добавить 1 моль N2 ? |
