Занятие Тема Основные понятия химической
 Скачать 93.86 Kb. Скачать 93.86 Kb.
|
Практическое занятие 1.Тема: Основные понятия химической кинетикиЦель: Ознакомиться с основными понятиями химической кинетикиТЕОРИТИЧЕСКИЕ ОСНОВЫ РАБОТЫОСНОВНЫЕ ПОНЯТИЯХимическая кинетика — это наука о закономерностях протекания химических реакций во времени и механизме этих реакций. Скоростьюобразованияi-гокомпонента(скоростьхимическойреакции по i-му веществу) (ri) называется изменение количества этоговещества (числа молекул или количества молей) в единицу времени вединицереакционного пространства:  ri= 1 d ni, (1.1) ri= 1 d ni, (1.1)Rd t где R— величина реакционного пространства, d ni чества молей i-го компонента. изменение коли- Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем (R ≡ V). Если реакция гетерогенная и протекает на границе фаз, то реакционным пространством является по- верхность (R≡ S). Замкнутая (закрытая) система не обменивается веществом с ок- ружающей средой, но может обмениваться энергией (теплотой и/или работой). Замкнутой системе в химической технологии соответствует прерывный процесс, например, в чанах или автоклавах, когда объем системы (V) во время реакции не меняется, при этом сi= сто (1.1) получим: ni. Тогда вме-  V V ri= d ci. (1.2) ri= d ci. (1.2)d t Выражение (1.2) справедливо только в частном случае гомогенных реакций при постоянном объеме. Скорость реакции по компоненту может принимать какположительные, так и отрицательные значения, в зависимости от того является ли данный компонент исходным веществом или продуктом ре- акции. Скоростьреакции—этоизменениеколичествавещества(исходного или продукта) в единицу времени в единице реакционногопространства (R), рассчитанное на единицу его стехиометрического коэфициента (i): где i — стехиометрический коэффициент i-го компонента в уравнении реакции, d — изменение химической переменной (величина пробега реакции). Для исходных веществ стехиометрические коэффициенты принимаются отрицательными, потому что концентрации этих веществ со временем в ходе реакции убывают. Таким образом, скорость химической реакции всегда положительна. Изменения количеств всех веществ, участвующих в некоторой хи- мической реакции, связаны через стехиометрические коэффициенты. Например, для реакции a1A1 + a2A2 = b1B1 + b2B2 изменение количеств реагентов будут 1 2 1 d nA = d nA = d nB    . .-a1 -a2 b1 Тогда между скоростями образования и расходования реагентов будет существовать соотношение, определяемое видом химической реакции. Например, для рассматриваемой реакции это соотношение имеет вид: 1 2 1 2 1 dnA= 1 dnA= 1 dnB= 1 dnB . (1.4) -a1 Vd t -a2 Vd t b1 Vd t b2 Vd t Скорость реакции не зависит от выбора реагента, она всегда поло- жительна, поэтому для исходных веществ коэффициент нужно брать со знаком минус, а для продуктов реакции   Выражение для скорости гомогенной реакции в закрытой системе Выражение для скорости гомогенной реакции в закрытой системе(R= V= const) запишется1 как v= 1 d ci, (1.5)  id t а для скорости гетерогенной реакции = 1 d ni . (1.6) Например, для реакции  iSd t N2 + 3H2 = 2NH3 скорости реакции по веществам будут равны:  N r = d nN2 ; 2 Vd t r = d nH2 ;  H 2 Vd t rNH = d nNH3 .  3 Vd t (1.7) Следовательно,скорость,измереннаяпоубыливодорода,неравнаскорости,измереннойпо убылиазота. Скорость всей реакции связана со скоростями по веществам урав- нением: N H d n d n =2 2  d nNH   . .(1.8) Vd t 3Vd t 2Vd t В случае протекания сложных химических реакций скорость повеществу — это алгебраическая сумма скоростей получения и расходо- вания данного вещества на отдельных стадиях этого процесса (принципнезависимостипротеканияреакций):  r= d ciid t r= d ciid t(1.9) где ri— скорость реакции по i-му веществу, vj— скорость j-й стадии, ij— стехиометрический коэффициент i-го вещества в j-й стадии. Например, для реакции     скорость по веществу В будет равна: (1.10) r= d cB = v- v+ v. (1.11)  B d t 1 2 3 Для реакций, протекающих в газовой фазе, скорость можно опре- делять через парциальные давления веществ. В химической кинетике концентрацию чаще всего выражают в моль/дм3 или 1/см3 (число молекул в кубическом сантиметре). Время же может измеряться в любых единицах (с, мин, ч, столетия и др.). Для га- зовой фазы иногда используют единицы давления (Па, торр и атм). По- этому, размерность скорости может быть записана как: моль/(дм3 · [время]), 1/(см3 · [время]) или Па/[время]. Системы, в которых имеет место материальный обмен с окружающей средой, называются открытыми системами. Большинство промышленных химических процессов осуществляется в открытых системах. В этом случае реакция проводится в реакторе непрерывного действия, в котором исходные вещества непрерывно подаются в реактор, а продукты реакции непрерывно выводятся из него. Наиболее простыми типами открытых систем являются реактор идеального смешения и реактор идеального вытеснения. В реактореидеальногосмешениянепрерывно с определенной объемной скоростью ( м3/c) подается реакционная смесь. Одновременно реакционная смесь, содержащая продукты реакции, выводится из реактора. Как правило, скорость подачи реакционной смеси равна скорости вывода продуктов реакции из реактора. Принимается, что реакционная смесь в реакторе идеального смешения перемешивается настолько хорошо, что во всех точках реакционного пространства состав смеси практически одинаков. В реакторе идеального вытеснения реакционная смесь движется так, что перемешивание вдоль реактора отсутствует (ламинарный по- ток), то есть некоторый элементарный объем движется как поршень в цилиндре. По мере продвижения этого элементарного объема через ре- актор идеального вытеснения в нем протекает соответствующая хими- ческая реакция и концентрация реагентов изменяется. Механизм химическойреакции— это детальное описание отдельных элементарных стадий реакции, а также совокупность всех элементарных стадий, из которых складывается процесс превращения исходных веществ в конечные продукты. Кинетическаясхемареакции— совокупность предполагаемыхэлементарных стадий, из которых складывается суммарный химический процесс. Элементарнаястадияреакции— это стадия химического превращения одной или нескольких частиц, при протекании которого преодолевается один (и только один) энергетический барьер. Избыток энергии над средним уровнем, необходимый реагентам для преодоления потенциального барьера, называется энергиейактивациихимическойреакцииЕа. Простая(элементарная)реакция— это реакция, состоящая из одной элементарной стадии, т. е. совокупности большого числа однотипных элементарных актов химического превращения. Сложнаяреакция— это реакция, которая складывается из нескольких элементарных стадий. В ходе сложной реакции часто образуются промежуточные вещества, которые подвергаются дальнейшему превращению. Часто это активные частицы с неспаренными электронами — так называемые радикалы. Формальнопростаяреакция. Установить все элементарные стадии химической реакции не все- гда удается. Поэтому для описания кинетических закономерностей ре- акций ввели понятие «формально простые реакции». К ним относят лю- бые сложные реакции, для которых условно (формально) принято, что они протекают через один потенциальный барьер. Молекулярность— число частиц, участвующих в одном элементарном акте химической реакции. В случае мономолекулярной реакции в элементарном акте участвует одна частица, в случае бимолекулярной реакции — две, тримолекулярной — три. Тримолекулярные реакции встречаются очень редко. Четырехмолекулярные реакции не встречаются, так как одновременная встреча четырех частиц — событие исключительно маловероятное. Например, реакция I2 = 2I мономолекулярная, так как в ее ос- нове лежит процесс распада исходного вещества. Реакция рекомбина- ции атомов водорода в молекулу с участием третей частицы ( H + H + M = H2 + M ) является примером тримолекулярной реакции. Термин«молекулярность»применимтолькодляописанияэлемен-тарныхстадий.   Формальнаякинетика— это раздел химической кинетики, в котором рассматривается зависимость скорости химической реакции от различных факторов: концентрации реагентов и температуры. Этот метод в настоящее время является основным методом решения кинетических задач. Основным постулатом химической кинетики является закондействующих масс: Формальнаякинетика— это раздел химической кинетики, в котором рассматривается зависимость скорости химической реакции от различных факторов: концентрации реагентов и температуры. Этот метод в настоящее время является основным методом решения кинетических задач. Основным постулатом химической кинетики является закондействующих масс:скоростьреакциипропорциональнапроизведениюконцентрацийреагентоввстепениихстехиометрическихкоэффициентоввуравненииреакции. На основании этого закона для любой реакции а1А1+ а2А2 + а3А3 = продукты скорость реакции может быть записана как: v=kca1 ca2 ca3 . (1.12) А1 А2 А3 Экспериментально установлено, что этот закон строго соблюдается только для элементарных стадий реакций. Показатели степени а1,а2,а3 называются порядками реакции по веществу А1, А2 и А3 соответственно. Для формально простой реакции закон действующих масс записы- вается аналогично: v= kcn1 cn2 cn3 . (1.13) А1 А2 А3 Если реакция протекает в газовой фазе, то уравнение формальной кинетики можно записать: v= kрn1 рn2 рn3 , (1.14) А1 А2 А 3 где n1, n2, n3 — порядки реакции по веществам А1, А2 и А3 (частные по- рядки реакций); n= n1 + n2 + n3 — общий порядок реакции. Порядокхимическойреакции— это сумма показателей степеней концентраций в уравнении скорости химической реакции. Значения n1, n2, n3 могут быть не равны стехиометрическим коэф- фициентам в уравнении реакции. Они могут принимать значения 0, 1, 2 и т. д., быть дробными или отрицательными. Дробный порядок реакции, определенный по экспериментальным данным, указывает на сложный механизм протекания реакции. Например, для реакции A + B = C скорость реакции по веществу C, определенная экспериментально, имеет вид: d cC  d t d t= kcc-1 . Это гово- A В рит о том, что с ростом концентрации вещества B скорость образования вещества C уменьшается. Если реакция протекает в избытке какого-то реагента, то порядок реакции по этому реагенту будет практически равен нулю, так как из- менение его концентрации будет оказывать незначительное влияние на скорость реакции. Например, реакция взаимодействия монохлоруксусной кислоты с водой CH2ClCOOH + H2O = CH2 (OH)COOH + HCl является бимолекулярной реакцией. Если этот процесс проводить в из- бытке воды, то скорость этой реакции будет зависеть только от концен- трации монохлоруксусной кислоты, то есть с кинетической точки зре- ния это реакция первого порядка. Порядок реакции — это величина формальная, позволяющая наи- лучшим способом описать экспериментальную зависимость скорости реакции от концентрации. Далеко не всегда существует связь между стехиометрией химической реакции и ее порядком2. Например, реакция 2N2O5 = 4NO2 + O2 протекает как реакция первого порядка, а реакция 2NO2 = 2NO2 + O2 протекает как реакция второго порядка. Поэтому факторы, влияющие на механизм процесса (температура, концентрация веществ, наличие ката- лизатора и др.), могут влиять и на величину порядка реакции. Постоянство частных порядков реакции при всех концентрациях реагентов, т. е. от начального момента реакции до ее завершения, харак- терно лишь для одностадийных односторонних реакций. Для сложных реакций при значительном изменении концентрации реагентов постоян- ство частных порядков нередко нарушается. Например, протекание  практически односторонней и в стехиометрическом представлении ка- жущейся простой реакции уравнение H2 + Br2 = 2HBr описывает кинетическое kc c1,5 v= H2Br2 , (1.15) 2 cBr kcHBr которое указывает на многостадийный характер реакции. Скорость дан- ной реакции в начальный момент времени будет равна: v= kc c0,5 , (1.16) 0 0,H2 0,Br 2 то есть в начальный момент времени для этой многостадийной реакции порядок реакции по cBr равен 0,5. По мере течения реакции, то есть 2 уменьшения cBr и при увеличении kcHBr порядок реакции будет воз- 2 растать от 0,5 до 1,5. Поэтому для многостадийных процессов принято указывать, какой порядок реакции приводится в кинетическом уравне- нии: определенный по начальным скоростям или полученный из кине- тических кривых. В последнем случае необходимо указывать до каких степеней превращения соблюдается постоянство порядка реакции. Итак, различие понятий «порядок» и «молекулярность» реакции можно свести к следующему: молекулярность имеет вполне определенный физический смысл, а порядок реакции — это величина формальная; порядок реакции может принимать любые значения: целые, дробные и даже отрицательные; численные значения молекулярности ограни- чены числами 1, 2 и 3; понятие «порядок» реакции можно использовать для любых реак- ций, как сложных, так и элементарных; понятие «молекулярность реакции» применимо только к элементарным стадиям химических реакций. Принцип независимости протекания реакций. В случае протекания сложных химических реакций скорость по веществу — это алгебраическая сумма скоростей получения и расходования данного вещества на отдельных стадиях этого процесса. 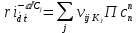 где ri— скорость реакции по i-му веществу, vj— скорость j-й стадии, ij— стехиометрический коэффициент i-го вещества в j-й стадии, kj— константа скорость j-й стадии, csj— концентрация s-го исходного веще- ства в j-й стадии, nsj— порядок реакции по s-му веществу в j-й стадии. Все задачи химической кинетики разделяются на прямые и обратные. Прямая задача химической кинетики — это расчет скорости протекания реакции на основе информации о ее механизме, константах скоростей отдельных стадий реакции и о ее начальных условиях. Обратная задача химической кинетики — это процедура опреде- ления механизма сложного процесса, констант скоростей отдельных стадий реакции на основе опытных данных. |
