әдістемелік жхт. Әдістемелік ЖХТ. . И. Стбаев атындаы аза лтты техникалы зерттеу университеті
 Скачать 225.11 Kb. Скачать 225.11 Kb.
|
|
қазақстан Республикасы білім жӘне ғылым Министрлігі Қ.И. Сәтбаев атындағы Қазақ ұлттық техникалық зерттеу университеті Геология және мұнай газ ісі институты « Химиялық процестер және өнеркәсіптік экология» кафедрасы «Жалпы химиялық технология» пәнінен зертханалық жұмыстардың әдістемелік нұсқауы («5B070100- Биотехнология, 5B072100 - Органикалық заттардың химиялық технологиясы, 6B05101 - Химиялық және биохимиялық инженерия, 6B07117-Мұнайхимиялық өнімдердің химиялық технологиясы»,5B072000 - Бейорганикалық заттардың химиялық технологиясы мамандығының бакалаврлары үшін) Алматы 2022 КІРІСПЕ «Жалпы химиялық технология» пәні «5B070100- Биотехнология, 5B072100 - Органикалық заттардың химиялық технологиясы, 6B05101 - Химиялық және биохимиялық инженерия, 6B07117-Мұнайхимиялық өнімдердің химиялық технологиясы», 5B072000 - Бейорганикалық заттардың химиялық технологиясы мамандығының бакалаврлары үшін міндетті пәндердің бірі . Бұл пәннің оқу бағдарламасына сәйкес заттардың қайта өңделу үрдісінің технологиясының теориялық негіздері мен бірге,тәжірибе жүзінде әртүрлі үрдістердің модульді және зертханалық қондырғыларда жасалуы үйретіледі, онда өндірістің жеке сатылары, сонымен бірге технологиялық үрдістің өзі де толығымен қарастырылады. Осыған байланысты жоғары оқу орындарында оқу үдерісінің маңызды бөлігі зертханалық практикум болып табылады. Зертханалық практикумның оқытылу мақсаты –бакалаврлардың тәжірибелік кәсіпті білімдарлықтарын, типті химиялық-технологиялық үрдістер (ХТҮ) жүргізуде дағдылануын және ХТҮ-дің негізгі технологиялық көрсеткіштерін анықтауда шеберліктерін, сондай ақ бейорганикалық заттар өндірісіндегі негізгі технологиялық сатылардың материалдық және жылулық баланстарын есептеуде инженерлік көзқарастарын қалыптастыру болып табылады. Бұл зертханалық практикумда химиялық өндірістерде суды және шикізатты даярлау әдістерін, судың және шикізаттың сапасының негізгі көрсеткіштерін анықтауға, сондай ақ типті химиялық технологиялық үрдістерді және оларды жүзеге асыруға арналған сәйкесінше, химиялық реакторларды зерттеуге бағытталған зертханалық жұмыстар ұсынылған. Зертханалық жұмыстарды орындау дәрістік курста оқытылған теориялық материалды жәнетәжірибе орындаудаалған дағдыларын игеруге мүмкіндік береді. Жалпы химиялық технология зертханасында бакалаврлар алғаш рет химиялық-технологиялық үрдістерді инженерлік басқаруды, химиялық өндірістерді типті әдіспен бақылауды үйренеді, сонымен қатар химиялық өндірістер жағдайларындағы конструкциялық материалдармен және олардың төзімділігімен танысады, зертханалық жағдайдағы үлгілі қондырғылардағы үрдістердің технологиялық есептерін жүргізуді үйренеді. Ұсынылған «Жалпы химиялық технология» бойынша зертханалық практикумында әрбір зертханалық жұмыстың бірыңғай құрылымы: - зертханалық жұмыстың атауы; - жұмыстың мақсаты; - студенттің берілген тапсырмаға дайындалуы үшін қажетті көлемдегі теориялық бөлімі; - жұмысты орындау бойынша берілген ұсыныстары мен тәжірибелік бөлімі; - тапсырмалар; - кестелер; есептер; графиктер; - бақылау сұрақтары; - әдебиеттер тізімі болады. Зертханалық жұмыстарға есеп берудің мазмұнына титулдік бет және келесі бөлімдер кіреді: - жұмыстың мақсаты; - тәжірибеніорындаудың қысқаша әдістемесі; - зертханалық қондырғының сызбалары (суреттер, графиктер); - бақылау сұрақтарына жауаптар; - тапсырмалар бойынша қорытындысы. Курстың көлеміне және сабақты өткізу әдістемесіне байланысты жұмыстардың керект ісаны өзгеруі мүмкін, ал жұмыстары – көбеюі немесе қысқаруы мүмкін. ЗЕРТХАНАЛЫҚ ЖҰМЫС № 1 Тақырыбы: СУДЫҢ КЕРМЕКТІЛІГІН АНЫҚТАУ Жұмыстың мақсаты:өндірісте суды дайындау негіздерімен танысу, судың сапасын анықтайтын негізгі фактор – судың кермектігін анықтаудың стандартты әдісін үйрену. Теориялық бөлім. Шаруашылық және техникалық мақсаттарда қолданылатын судың сапасы оның сәйкесінше физикалық және химиялық көрсеткіштерімен анықталады. Негізгі химиялық сипаттамалары кермектілік, тотығушылық, хлорид-ионының, көміртек (IV) оксиді мен ерітілген оттегінің мөлшерлері болып табылады. Ал негізгі физикалық сипаттамасына судағыжүзінді бөлшектердің мөлшері жатады. Судың кермектілігінің екітүрін ажыратады, олар уақытша (карбонатты) кермектілік, ол кальций мен магнийдің гидрокарбонаттарының бар болуымен, және тұрақты кермектілік, ол кальций мен магний нитраттары және сульфаттар, хлоридтер бар болуымен сипатталынады. Судыңуақытша кермектілігінің Са(НСО3)2және Mg(HCO3)2 тұздары қайнату кезінде жойылады, яғни қайнатқан кезде орташа немесе негіздік тұздарға айналып, тұнбаға түседі: Са(НСО3)2 = СаСО3↓ + Н2О + СО2, 2Mg(HCO3)2 = Mg(CO3) .Mg(ОH)2 + 3СО2 + Н2О (1) Тұрақты кермектік жай қайнатуда жойылмайды. Уақытша және тұрақты кермектіліктер қосындысы жалпы кермектілікті береді, мұндай судың барлығында кальций мен магний тұздары болады. Судың кермектілігі стандартқа сәйкес ммоль/л, мг-экв/л өлшем бірлігімен өлшенеді. Судың кермектілігіне қарай сулар былай жіктелінеді:
Тапсырмалар: 1. Оқытушыдан зерттелетін су сынамасын алу. 2. Зерттелетін судың жалпы, уақытша және тұрақты кермектігін анықтау. 3. Тәжірибедегі алынған нәтижелерді регламенттелетін көрсеткіштермен салыстыру. 1) Судың уақытша (карбонатты) кермектігін анықтау. Реактивтер : 1) концентрациясы 0,1 моль/л тұз қышқылының ерітіндісі; 2) метил-қызғылт сары индикатор. Құрал – жабдықтар: 1) 250 мл конусты колбалар; 2) 100 мл бюреткалар; 3) 25 мл цилиндр. Жұмыстың орындалу тәртібі. Уақытша кермектілік (Ку) зерттелетін суды тұз қышқылы ерітіндісімен титрлеу арқылы анықталады: (Са, Mg)(HCO3)2 + 2HCl (Сa, Mg)Cl2 + 2H2O + 2CO2(2) Конусты колбаға талданатын судан 100 мл алып, оны 0,1 моль/л концентрациялы тұз қышқылымен индикатор – метилқызғылт сарыдан қызғылт түске боялғанға дейін титрлейді. Судың уақытша кермектігін (моль/л) формуламен есептейді: 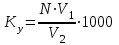 , (3) , (3)мұндаV1 – титрлеуге кеткен тұз қышқылының көлемі, мл; V2 – талдауға алынған судың көлемі, мл; N – тұз қышқылы ерітіндісінің нормальдығы. 2) Судың жалпы кермектігін анықтау. Судың жалпы кермектігін комплексонометриялық титрлеу әдісімен анықтайды, ол трилон Б мен кальций, магний иондарыменберік қосылыстүзілуіне негізделген. Суды титрлеу сілтілі ортада хромогеннің қатысуымен ,NH4OH және NH4Cl (аммиакты қоспа) құрамды буферлі ерітінді қатысында жүреді . Бұл кезде Са2+және Mg2+иондары трилон Б-мен төменде көрсетілген комплексті қосылыс түзеді: 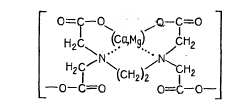 . .Индикатордың қызыл-күлгін түстен көк-күлгін түске ауысуы судағы трилон Б ерітіндісіменкальций мен магний иондарының байланыстырғанын куәландырады. Реактивтер: 1) концентрациясы 0,05 моль/л трилон Б ерітіндісі; 2) аммиакты буферлі ерітінді; 3) индикатор – көк және қара хромоген; 4) натрий сульфиді; 5) 1 %-ды тұз қышқылды гидроксиламин ерітнідісі; 6) 0,05 моль/л концентрациялы мырыш хлоридінің ерітіндісі мен 0,25 моль/л магний сульфаты. Құрал – жабдықтар: 1) 250 мл-ге конусты колбалар ; 2) 100 мл-ге бюреткалар; 3) 25 мл-ге цилиндрлер; 4) 100 мл-ге пипеткалар. Жұмыстың орындалу тәртібі. 250 мл конусты колбаға 100 мл зерттелетін суды құяды. Оған 5 мл аммиакты буферлі ерітіндісін және 5-7 тамшы индикатор құяды да, қатты араластыру кезінде трилон Б ерітіндісімен эквивалентті нүктесіндегі түсі өзгергенге (қызыл түсте сұрғылт – көк немесе күлгін түске ауысқанға дейін)дейін титрлейді. Егер титрлеу кезінде 10 мл-ден аса трилон Б ерітіндісі қолданылса, онда зерттелуге алынған су құрамында Са2+және Mg2+иондарының қосынды мөлшері 5 ммоль/л-ден көп болғандығын көрсетеді. Мұндай жағдайда анықтауды қайта қайталау керек, яғни зерттелетін суды аз көлемде алып, оны 100 мл дистилденген сумен сұйылту керек. Судың жалпы кермектілігін анықтауға мыс, мырыш, марганец иондары және карбонатты және гидрокарбонатты тұздарының жоғары мөлшері кері әсерін тигізеді. Титрлеу барысында эквивалентті нүктедегі түстің анықсыз өзгеруісудағы мыс пен мырыш иондарының бар болуын көрсетеді. Мұндай қарсы әсерді жою үшін титрлеуге алынған судың сынама алып, оған 1-2 мл натрий сульфидін қосып, қайтадан титрлеу жүргізеді. Егер осыдан кейін суға буферлі ерітінді мен индикатор қосқанда, ерітіндісі біртіндеп түссізденесе(сұр түске дейін), олсуда марганецтің бар екендігін куәландырады. Онда су сынамасына 5 тамшы тұз қышқылды гидроксиламин тамызып, одан әрі қарай жоғарыда көрсетілген әдістеме бойынша судың кермектігін анықтайды. Егер эквивалентті нүктеде тұрақсыз түс пайда болса, онда ол жоғары сілтілікті көрсетеді. Сілтілікті жою үшін су сынамасына0,1 моль/л концентрлі тұз қышқылын қосып, 5 минут бойы қайнатады . Бұдан кейін буферлі ерітінді және индикатор қосып, судың жалпы кермектігін анықтайды. Судың жалпы кермектігін (Кж ,моль/л) келесі формула арқылы есептейді: 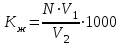 , (4) , (4)мұнда V1 – су сынамасын титрлеуге кеткен трилон Б ерітіндісінің көлемі, мл; V2 – талдауға алынған су көлемі; N –трилон Б ерітіндісінің нормальдығы. Карбонатты емес кермектілік жалпы кермектілік пен карбонатты кермектілік айырмасы бойынша анықталады: Кк.е= Кж – Кк. 3) Магнийлі кермектігін анықтау. Магний көлемдік-аналитикалық әдіспен анықталады. Ол үшін суда болатын бикарбонаттарды және карбонаттарды тұз қышқылымен титрлеу арқылы хлоридтерге айналдырады. Бұл жағдайда түзілетін көміртек қос тотығын қайнату арқылы жояды. Магнийді Са(ОН)2 артық мөлшермен тұнбаға түсіреді: Mg2+ + Ca(OH)2 = Mg(OH)2↓+ Ca2+ (5) Тұнбаны сүзіп, кальций тотығының артық мөлшерін 0,1 нHCl-ментитрлейді. Талдау орындау үшін 100 см3суға метилқызғылт сары индикатордың 3 тамшыны қосады және қызғылт сары түске дейін 0,1 н HCl-мен титрлейді, сонымен бірге бос сынаманы (100 см3дистилген су) да титрлейді. Ек іколбаны қыздырып қайнатады және өлшемі 200 см3 колбаларға ауысады, екеуіне Са(ОН)2 қанныққан ерітіндісін 50 см3 қосып, содан кейін колба мойындағы белгісіне дейін сумен толтырады. Колбаларды араластырады және 30 минутқа су моншаға қояды. Суытқаннан кейін азайған ерітіндісінің көлемін колбаның белгісіне дейін толдырады, араластырады және магний гидрототығының тұнбасын титрлейді. Әр сынамадан 100 см3–ден сүзіндіні фенолфталеин қатысуында 0,1н HCl-мен титрлейді, бұл кезде кальций гидрототығының артық мөлшері байланысады. Магнийдің мөлшері мына формула бойынша анықталады: СMg = 2⋅(N⋅V1 –N⋅V2)⋅10, (6) мұндаN – тұз қышқылының нормальдығы; V1 –бос сынама титрлеуге кеткен тұз қышқылының мөлшері, см3; V2 –су сынамасын титрлеуге кеткен тұз қышқылының мөлшері, см3. Жұмыстың нәтижелерін рәсімдеу. Есеп беруде жасалынған жұмыс туралы қысқа қорытындысын жазып, алынған нәтижелерін 1кесте түрінде көрсетеді. Бақылау сұрақтары: 1. Судың сапасы неге байланысты? 2. Судың негізгі техникалық көрсеткіштерін ата. 3. Судың кермектігі деген не? 4. Судың кермектігінің түрлерін ата. Кермектілігі бойынша су қалай жіктелінеді? 6. Моль-эквивалентті концентрация деген не? Мысалдар келтіріңдер. 7. Ерітіндінің молярлы концентрациясын қалай анықтайды? Мысалдар келтіріңдер. 8. Комплексондар, олардың судың кермектігін анықтауда қолданылуы. 9. Қандай заттармен қарсы қоспа заттарының әсерін жояды? 10. 5 м3суда250 гкальций ионы мен 135 г магний ионы бар. Судың жалпы кермектігін анықтаңдар. Кесте 1 –Эксперимент нәтижелері
ЗЕРТХАНАЛЫҚ ЖҰМЫС № 2 Тақырыбы: ХЛОР-ИОНЫН, КӨМІРТЕГІ ЕКІ ОКСИДІН, ЖҮЗІНДІ БӨЛШЕКТЕР ЖӘНЕ СУДЫҢ ТОТЫҒУЫН АНЫҚТАУ Жұмыстың мақсаты: Су құрамындағы жеңіл тотығатын органикалық қоспалар, жүзінді бөлшектер, хлор-ион мен көміртегі екі оксидін стандартты талдау әдістерін меңгеру. Теориялық бөлім.. Табиғи суларда хлоридтер аниондар ішінде бірінші орын алады. Ауыз суларда көптеген хлоридтер кездеседі. Хлор-ионының күрт өсуі судың ағынды сулармен ластануын көрсетеді. Суда хлорид концентрациясы 300 мг-нан жоғары болса, онда су тұзды дәм береді. Сонымен қатар, темір хлоридінің суда жақсы еритіндігінен хлоридтер темірді коррозияға ұшыратады. Көміртегі оксиді (IV), күкіртті сутек, күкірт оксиді (IV) және оттегі суда жиі кездеседі. Оттегінің сұйылуын анықтау – химиялық талдаудың негізгі бөлімі болып табылады. Оның толық болуы немесе болмауы судың ластануына алып келеді. Газдардың суда ерігіштігі температураға, атмосфераға және қысымға байланысты. Анықтау зерттелетін судан сынама алған соң тез арада жасалынады. Кәсіпорындық ағын сулардың көбінің құрамында қатты бөлшектер мен әртүрлі химиялық құрамды коллоидтер болады. Су шаруашылық, ауыз су үшін, агрегаттарды суыту және басқа да мақсаттар үшін аса қажет. Су құрамында қашанда саз, құм болады.Су құрамындағы жүзінді бөлшектер мен коллоидтарды жою үрдісі тұныған немесе тұнытылған деп аталады. Ол үшін арнайы коагулянт немесе флокулянт деп аталатын реагенттер қолданылады. Коагулянт ретінде суды рН-7-де максималды гидролиздейтін алюминий гидросульфаты қолданылады. Al(OH)3 ұлпалары судағы жүзінді Al(OH)3 бөлшектерді сорбциялап, жинақтайды, ол үшін тез тұнба түсіретін үлкен флокулдар пайдаланылады, содан кейін ерітінді тұнады. Флокулянт ретінде суды өздігінен тазалауға қолданылатын қосымша коагулянт ретінде жоғары молекулалы қосылыстар пайдаланылады. Өндірістерде суларды жоғары көрсеткіштер беретін әдістермен талдайды. Суды тазалау оның құрамындағы кальций мен магний тұздарын жою үшін жүргізіледі (суды жұмсарту мақсатында), сондай ақ жүзінді бөлшектер мен коллоидты бөлшектерден де (коагуляция) тазартады. Тапсырмалар: 1. Оқытушыдан зерттелетін су сынамасын алу керек. 2. Хлор-ионы, көміртегі екі оксиді, құрамындағы жүзінді бөлшектер және судың тотығуын анықтау керек. 3. Алынған нәтижелерді регламентті көрсеткіштермен салыстыру керек. 1) Судың тотығуын анықтау. Судың тотығуын перманганатометрия әдісімен анықтайды. Ол үшін тек жеңіл тотығатын органикалық қоспаларды тотықтырады. Дәл нәтижелер алу үшін калий перманганаты тамшысымен қайта титрлеу жүргізеді. Қайнауға дейін жеткізілген су сынамасына қымыздық қышқылы тамшысын қосады, содан кейін калий перманганаты ерітіндісі және қымыздық қышқылмен тотықтырғаннан кейінгі қалған бөлікті қайта калий перманганаты ерітіндісімен тотықтырады. Ерітінділер : 1) 0,002 моль/л концентрлі калий перманганаты ерітіндісі; 2) 0,05 моль/л қымыздық қышқылы ерітіндісі; 3) 2,5 моль/л концентрлі күкірт қышқылы ерітіндісі. Құрал – жабдықтар: 1) 250 мл конусты колба ; 2) градуирленген бюретка ; 3) 100 мл пипетка . Жұмыстың орындалу тәртібі. Конусты колбаға 100 мл пипеткамен зерттелетін су алып, оған 5 мл күкірт қышқылын және бюреткамен 10 мл калий перманганаты ерітіндісін құяды. Колбаның бетін жауып қайнау уақытынан бастап 10 минут қоспаны қайнатады. Қатты қайнау буы болмай тұрып колбаны әйнекті капиллярмен ауыстырады. Ыстық, боялған сұйықтыққа бюреткамен 10 мл қымыздық қышқылы ерітіндісін қосып араластырады. Ыстық түссізденген ерітіндіні 0,002 моль/л концентрлі калий перманганаты ерітіндісімен әлсіз күлгін түстен түс жоғалғанға дейін 2-3 минут титрлейді. Егер титрлеу кезінде зерттелетін суға қымыздық қышқылын қосқаннан кейінгі калий перманганатын қосу шығыны 5 мл-ден көп болса, онда талдауды зертелетін суды дистилденген сумен сұйылтып қайта жасау керек. Ол үшін дистилденген судың тотығуын және ерігіштігін анықтау керек. Судың тотығуын келесі формуламен есептейді: 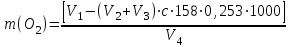 , (5) , (5)мұнда V1 – сынамаға қосылған КMnO4 ерітіндісінің жалпы көлемі, мл; V2 – судағы органикалық заттарды тотықтыруға кеткен және зерттелетін суды ерітуге кеткен КMnO4 ерітіндісінің көлемі; V3 – 10 мл қымыздық қышқылын тотықтыруға кеткен калий перманганатының көлемі, мл; V4 – зерттелетін су мөлшері, мл; С – калий перманганатының концентрациясы, моль/л; 158 – калий перманганатының молярлы массасы, г/моль; 0,253 – судың оттегіне тотығуын қайта есептеу коэффициенті; m (О2) – судың тотығуы, мг/л О2. | |||||||||||||||||||||
