әдістемелік жхт. Әдістемелік ЖХТ. . И. Стбаев атындаы аза лтты техникалы зерттеу университеті
 Скачать 225.11 Kb. Скачать 225.11 Kb.
|
|
Бақылау сұрақтары: 1. Р2О5 фотометриялық әдіспен анықтаудың негізі неде? 2. Фосфатты шикізаттың ыдырау дәрежесі қандай факторлерге байланысты болады? 3. Фосфатты шикізатты ыдыратуды қалай есетейді? 4. Зертханалық және өндірістік жағдайларда өнімнің шығыны нені көрсетеді? 5. Р2О5 жалпы және ерігіштік құрамдарын анықтау әдістері. №6 ЗЕРТХАНАЛЫҚ ЖҰМЫС Тақырыбы: КАЛИЙ НИТРАТЫН АЛУ Жұмыстың мақсаты: Тұздардың өзара ерігіштік диаграммасының анализі негізінде алмасып ыдырау әдісімен калий нитратын алу және өнімнің шығымын есептеу. Теориялық бөлім. Калий хлориді және натрий нитратының алмасып ыдырауы – калий нитратын алудың кең таралған әдістеріне жатады. NаNО3 – КСl – Н2О жүйесіндегі ерігіштіктің квадратты диаграммасы (1-сурет) 1 кестеде келтірілген мәліметтер бойынша тұрғызылды. 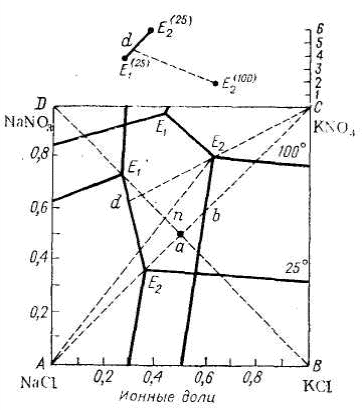 1-сурет. 100 және 25Стемпературада NaNO3–KCl–Н2О жүйесіндегі ерігіштік изотермасы. 1 кесте. NаNО3 – КСl – Н2О жүйесіндегі ерігіштік.
100С температурадағымен салыстырғанда 25С температура кезінде кристалданудан кейін КNО3квадраттың үлкен бөлігін қамтиды. Егер КСlмен NаNО3эквимолекулярлық қоспасының ерітіндісін дайындайтын болса, онда квадрат диагональдерінің қиылысында жатқан осы ерітіндінің тұздық массасының фигуративті нүктесі а 25С температурада КNО3кристалдану өрісіне қарай ығысады. 25С температурада булану кезіндеосы ерітіндіден су буланып біткен соң, КNО3кристалдануы басталады және ертітіндінің тұздық массасының құрамы аЕ2(25)түзуі бойынша өзгере бастайды. Е2(25)нүктесінде ерітінді NаСl, сондай-ақ, КСl-менқаныққан болғандықтан, кристалдануды тоқтата бастау қажет. КNО3алудың осындай жолы тиімсіз, себебі: – 25С температурада бусыздану өте баяу жүреді; сЕ2(25)кристалдану сәулесінің аЕ2(25)ауданында кристалданатын КNО3 мөлшері өте аз; сондықтан бастапқы жұмсалынған материалға қатысты өнім шығымы да төмен болады. Булануды жоғарғы температураларда жүргізу тиімдірек. 100С температурада а нүктесіNаСl кристалдану өрісінде жатады. Сондықтан, суды 100Стемпературада буландыра бастасақ,қанығудан кейін NаСlкристалдануы басталады да, ерітіндінің тұздық массасының құрамы аb түзуі бойынша өзгере бастайды. Егер осы моментке түзілген NаСl кристалдарын 25С температураға дейін бөліп алып, одан кейін суытатын болса, онда b нүктесі КNО3 кристалдану өрісінде жатады; осы тұз суыту кезінде тұнба ретінде бөліне бастайды, ерітіндінің тұздық массасының құрамы bЕ2(25С)түзуі бойынша өзгере бастайды. bЕ2(25С)> аЕ2(25С)болғандықтан, бірінші жағдайға қарағанда КNО3шығымы анағұрлым артық түседі. Диаграммадан көрініп тұрғандай, бөлініп шығатын NаСl мөлшерін арттыру және КNО3шығымын жоғарылату үшін бастапқы ерітіндіге NаNО3 мөлшерін стехиометриялық қатынаста емес, артық мөлшерін қосу керек. Егер NаСl кристалдануы соңында ерітінді үш тұзбен: NаСl, КСl және КNО3қаныққан жағдайда шығым артады, себебі оның тұздық масса Е2(100С) нүктесімен сипатталады. Сонда, булану кезінде тұнбаға түскен NаСl тұзын бөліп алған соң, КNО3кристалдану ерітіндіні суыту кезінде ең ұзын жолмен Е2(100С)d жүргендіктенөнім шығымдылығының артуын қамтамасыз етеді.Бұл, яғни, бастапқы ерітіндінің тұздық құрамы nнүктесіне сәйкес келген уақытта жүзеге асады. Өнеркәсіптік жағдайда, NаNО3 ерітіндісі мен қатты КСl тұзынан КNО3 алу кезінде бір уақытта ерітіндіден NаСl кристалдануы мен ерітіндінің буландыруды 1000С температурада емес, су буланған сайын оның қайнау температурасын арттыра отырып, 120С мәніне дейін жүргізеді, осы температураға жеткен соңерітіндіденNаСl бөліп алады және КNО3 кристалдану үшін оны суытады. Қатты NаNО3 және КСl тұздарынан КNО3 алу барысында бастапқы тұздардың сұйытылған ерітіндісін дайындап, одан кейін бусыздандырудың қажеті жоқ. Е2(100) нүктесінде жүйенің қанығуына сәйкес келетін судың мөлшерін алып, 100С температурада n нүктесіне сәйкес келетін NаNО3және КСl мөлшерлерімен араластыруға болады. Осы кезде бірден тұнба ретінде бөлінеді, оны бөліп алғаннан кейін қалған ерітіндінің тұздық массасы Е2(100С) нүктесіне сәйкес келеді. Есептеу жолы Е2(100С) нүктесімен сипатталатын КNО3 максималды шығымын алу үшін тұздар суммасының 1 моліне есептеуді жүргіземіз. Нүктенің құрамы (1000С) иондық үлесте: Nа+ – 0,38; К+ – 0,62; Сl- – 0,20; NО3- – 0,80; қаныққан ерітінді құрамында тұздар суммасының 1 моліне 1,81 смоль Н2О келеді. Белгілейік: х – Е2 (100С )құрамдағы тұздар суммасының 1 моліне келетін nЕ2(100С) учаскесінде кристалданатын NаСl моль саны; y және z – сәйкесінше алмасу ыдырау үшін алынған NаNО3 және КСl моль саны. Материалды баланстардың жекеленген теңдеулерін құрайық: тұздар суммасы бойынша y + z = 1 + х Nа+ бойынша y = х + 0,38 Сl-бойынша z = х + 0,20 Осы теңдеулерді шеше отырып, аламыз: х = 0,42, y = 0,80, z = 0,72. Сонымен, Е2(100С құрамдағы қаныққан ертіндіні алу үшін 100С температурада 0,80 моль NаNО3, 0,62 моль КСl және 1,81 моль суды алу қажет. Осы кезде 0,42 моль NаСl тұнбаға түседі. Ертінідіні 25С температураға дейін суыту кезінде тұнбаға түскен NаСl бөліп алғаннан кейінгі кристалданған КNО3 мөлшерін есептейік. Кристалданудың соңғы d нүктесіндегі ерітіндінің тұздық массасының құрамы (иондық үлесте): Nа+ – 0,71; К+ – 0,29; Сl- – 0,37; NО3- – 0,63. Белгілейік: х – тұнбаға түскен КNО3 моль саны. Сонда d нүктесінде, ерітіндіде 1–х тұздар молі қалады. Калий бойынша материалды баланстың теңдеуінен: 0,62 = х + 0,29 (1– х), табамыз х =0,465. Сондықтан, 0,465 моль КNО3 кристалданады. Шығым: К+бойынша (0,465/0,62) *100 =75% NО3-бойынша (0,465 /0,80) *100 = 58,1% 1 кесте мәліметтері бойынша (соңғы бағана) Е1(25С)және Е2 (25С)нүктелері арасында сулы диаграмманың учаскесін тұрғызамыз (1-суреттің жоғарғы бөлігі). Осы диаграмма бойынша, d нүктесіндегі қаныққан ерітінді құрамында тұздардың1 моліне 4,19 моль судың келетінін табамыз. Яғни, түнбаға түсен КNО3бөліп алғаннан кейін, ерітіндіде 1 – 0,465 = 0,535 тұздар молі қалатындықтан, онда 0,535 · 4,19 = 2,24 моль су қажет. Алайда, бастапқы ерітіндіде Е2(100С тек қана 1,81 моль су бар. Сондықтан, ерітіндіні суыту кезінде КNО3басқа тұздармен ластанудан сақтау үшін 2,24 – 1,81 = 0,43 моль су мөлшерін қосу керек. Бастапқы мән ретінде 100 г NаNО3 ала отырып, есептеу нәтижелерін массалық бірлікпен сипаттайық. Реакциялық бастапқы қоспаны құрастыру кезінде NаNО3 тұзының осы мәніне қосу қажет: КСl 100 · 0,62 · 74,56/0,8 · 85 = 68 г. Н2О 100 · 1,81 · 18/0,8 · 85 = 48 г. 100Стемпературада 100 г NаNО3, 68 г КСlжәне 48 г Н2О араластырғаннан кейін бөлінетін NаСl массасы: 100 · 0,42 · 58,45/0,8 · 85 = 36 г. NаСl бөлінген соңерітіндіге қосылатын судың массасы: 100 · 0,43 · 18 /0,8 · 85 = 11,4 г 25С температураға дейін ерітіндіні суыту кезінде кристалданатын КNО3массасы: 100 · 0,465 · 101,11 /0,8 · 85 = 69 г. Тапсырма: Келтірілген жұмыста қатты КСl және NаNО3тұздарынан максималды шығыммен КNО3алынуы қарастырылған. Жұмыстың әртүрлі варианттары ұсынылады: берілген қатынастағы бастапқы заттардың мөлшері, тұздар мен судың екі есе азайтылған мөлшерлері. Барық жағдайда да кесте мәліметтері бойынша ерігіштік диаграммасын тұрғызу қажет, процесс есептеулерін жүргізу және оның нәтижелерін калий нитратын алу кезінде басшылыққа алу керек. Жұмыстың орындалу тәртібі. Тұздардың алмасып ыдырауы үшін ыдыс - диаметрі 40 мм, биіктігі 260 мм болатын 1, 150С температуралық термометр 2және мотормен айналуға қосылатын араластырғыш3қамтылғаншыны дөңгелек түпті цилиндр (2-сурет). Термометр және араластырғыш резиналық тығын 4арқылы цилиндрге орнатылған. Цилиндрге сүзгісі бар қисайтылған түтікше де 5 жалғасқан, ол реакциялық кеңістіктің атмосферамен байланысы мен реакторды сумен толықтыру қажет. Ыдыс глицеринді монша–стаканға батырылған. Моншадағы глицерин деңгейі ыдыс ішіндегі реакциялық қоспаның деңгейінен 2-3 см төмен болуы тиіс. Реакциялық ыдыстың сыртынан ыдыс ішінде жылжуы оңай, жылжымалы жіңішке резиналық сақина 6 кигізілген. 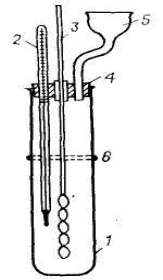 1 – цилиндр; 2 – термометр; 3 – араластырғыш; 4 – резиналық тығын; 5 – қисайтылған түтікшесі бар сүзгі; 6 – резиналық сақина 2-сурет. Ерітіндідегі тұздардың алмасып ыдырауына арналған ыдыс Техникалық таразыда 100 г NаNО мен 68 г КСl өлшеп алады. Осы тұздарды реакторға төгеді және оған 48 см3 су құяды. Реакторды глицеринді моншаға орналастырады, араластырғышты көтере отырып, тығынмен жабады, сосын араластырғыштыыдыс ішіне түсіреді және ол арқылы алдымен қолмен, содан кейін моторды қоса отырып, тұздар қоспасын араластырады. Осыдан кейін қыздыруды бастайды; реактордағы температура 60-65С мәніне жеткенде, араластырғыштың айналуын тоқтатады және жылжымалы резиналық сақинаның көмегімен реактор ішіндегі деңгейді белгілейді. Содан кейін араластырғышты қайтадан қосады және реактордағы температура 100С мәніне жеткенге дейінқыздыруды жалғастырады. Осы температурада тағы 40-60мин бойына қоспаны араластырады. Қыздыру процесінде реакциялық қоспадан аздап су буланады. Сондықтан тәжірибенің аяқталуына 5-10 мин қалғанда сүзгісі бар түтікше арқылы резиналық сақинамен белгіленген деңгейге дейін ыстық суды құяды. Араластыруды тоқтатқаннан кейін реакторды моншадан алады, тез түрде тығынды ашып және реактор ішіндегісін ыстық фильтрелуге арналған сүзгіге орнатылған және алдын-ала қыздырылған фильтрге ауыстырады. Фильтрленген тұнбаны этил спиртінің аз мөлшерімен (30 см3) шаяды, жайпақ кристаллизаторға ауыстырып және кептіру шкафында 105–115С температурада кептіреді. Фильтратты сүзгі астына қойылған, алдын-ала бюреткадан 11,4 см3су құйылған кристаллизаторға жинайды. 25С температураға дейін кристаллизатор құрамын салқындатқаннан кейін, тұнбаға түскен КNО3сүзіп алады, оны сүзгіде этил спиртінің аз мөлшерімен шаяды, жайпақ кристаллизаторға ауыстырып және кептіру шкафында 105 –115С температурада кептіреді. КNО3және NаСl кептірілген кристалдарын техникалық таразыда өлшейді, жұмсалынған калий (КСl) мен NО3- (NаNО3), бойынша, сондай-ақ, теориялық шығымына қатысты КNО3шығымын есептейді. Бақылау сұрақтары: 1. Калий хлориді және натрий нитратының алмасып ыдырауының мәні неде? 2. NаСl кристалдануы қандай температурада басталады? 3. КNО3шығымын арттыру үшін қандай шараларды атқару қажет? | ||||||||||||||||||
