әдістемелік жхт. Әдістемелік ЖХТ. . И. Стбаев атындаы аза лтты техникалы зерттеу университеті
 Скачать 225.11 Kb. Скачать 225.11 Kb.
|
|
Есептерге мысалдар. Зерттелетін суды 10 рет сұйылту керек, яғни 1 көлемде зерттелетін су және 9 көлемде дистилденген су, тұнбаға түскен қоспаның құрамы 8,4 мг/л О2. Дистилденген судың тұнуы 0,4 мг/л О2 тең. Сонда, зерттелетін судың тұнуы: 8,4 – 0,4 . 0,9 = 8,04 Жауап: 8,04 мг/л О2. 2) Судағы хлор-ионын анықтау. Хлор-ионының нейтралды немесе әлсіз сілтілі ортада тұну әдісінің негізі күміс нитратымен индикатор ретінде калийдің екі хроматының қатысуына негізделген. Индикатордың түсінің өзгеруі күміс хлоридінің және күміс хроматының бөлінуін көрсетеді. Ерітінділер : 1) 0,02 моль/л концентрациялы күміс нитраты ерітіндісі; 2) 10 %-ды калийдің екіхроматы. Құрал – жабдықтар: 1) 250 мл конусты колба ; 2) градуирленген бюреткалар; 3) 100 мл пипеткалар. Жұмыстың орындалу тәртібі. Екі колбаға пипеткамен 100 мл зерттелетін су алынады, рН көрсеткіші 6-10 болу керек. Сынамаға 1 мл калийдің екіхроматы ерітіндісін құйып, күміс нитрат ерітіндісімен сарғылт түске дейін титрлейді. Хлор ионы құрамын формула бойынша есептейді: 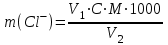 , (6) , (6)мұндаm (Cl-) – хлор-ионының құрамы, мг/л; V1 – титрлеуге кеткен күміс нитратының көлемі, мл; V2 – талдауға алынған судың көлемі, мл; С – күміс нитраты ерітіндісінің концентрациясы, моль/л; М – хлор-ионының молярлы массасы, г/моль. 3) Көміртегі оксидінің (IV) құрамын анықтау. Көміртек оксидінің (IV) құрамын сілтімен индикатор – фенолфталеин қатысуымен эталондық ерітіндінің түсі (қызғылт) пайда болғанша титрлеу арқылы анықтайды. Ерітінділер : 1) 0,1 моль/л концентрациялы натрий гидроксиді ерітіндісі; 2) 1 %-ды фенолфталеин ерітіндісі; 3) эталонды ерітінді. Құрал – жабдықтар: 1) 250 мл конусты колба ; 2) градуирленген бюретка. Жұмысты орындау тәртібі. Конусты колбаға 200 мл зерттелетін су алып, оған 0,2 мл фенолфталеин ерітіндісін қосып, мұқият араластырады. Алынған түсті бақылаушы ерітіндімен салыстырады. Егер түс анық болса, онда ол су құрамында көміртегі оксидінің (IV) жоқ екендігін көрсетеді. Егер су түске боялмаса немесе түс эталоннан әлсіз болса, онда бақылаушы ерітіндінің түсіне дейін натрий гидроксиді ерітіндісімен титрлейді. Көміртегі оксидінің (IV) құрамын келесі формуламен есептейді: 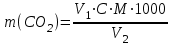 , (7) , (7)мұнда m (CО2) – көміртегі оксидінің (IV) құрамы, мг/л; V1 – титрлеуге кеткен натрий гидроксидінің көлемі, мл; V2 – талдауға алынған судың көлемі, мл; С – натрий гидроксиді ерітіндісінің концентрациясы, моль/л; М – көміртегі оксидінің (IV) молярлы массасы, г/моль. 4) Судағы жүзінді заттардың құрамын анықтау. Судағы жүзінді заттардың құрамын анықтау үшін суды флокулянт- полиакриламидты (ПАА) өңдеу тәсілі қолданылады. Полиакриламид – сополимер полиакриламид және акрил қышқылы тұзы (молекулалық массасы 5,2-5,6 . 105): 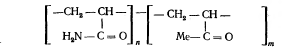 . .Су құрамындағы жүзінді бөлшектер ПАА молекулаларымен және полимер молекуласымен байланысып, ірі ұлпалар түзеді. Флокулянтты аздаған порциямен қосады (0, 4-2,0 % қатты бөлшек массасынан бастап). Ерітінділер: 1) 0,1 %-ды полиакриламид ерітіндісі. Құрал –жабдықтар: 1) шыны стакандар ; 2) фарфорлы табақшалар ; 3) құм моншасы. Жұмыстың орындалу тәртібі. Шлам құрамды су сынамасын (қатты бөлшектер өлшемі 10 мк аз болса), алып, мұқият шайқап, 250 мл-ден екі стаканға бөлек құяды. Содан кейін әр стаканға 5-10 тамшы ПАА (0,1 %-ды) ерітіндісін тамызады және шыны таяқшамен араластырады. Жүзінді бөлшектердің тұнуы 2-3 минут аралығында аяқталады. Стакандағы тұныған суды декантациялап бөліп алып, ал қатты бөлікті өлшенген фарфор табақшаға ауыстырады. Кептіру үшін құм моншасына қойып, тұрақты массаға келгенше кептіреді, кепкен соң өлшеп және судағы жүзінді бөлшектердің құрамын есептейді (г/л). Жұмыстың нәтижелерін рәсімдеу. Есепті жазу кезінде судың техникалық көрсеткіштерін анықтау әдістерін баяндау қажет және орындалған жұмысқа қысқаша түсініктеме беріп, есептерін жазу керек. Нәтижелерін кесте 2-ге толтыру керек. Кесте 2 – Судың техникалық көрсеткіштері.
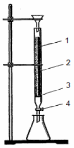
Бақылау сұрақтары: 1. Судағы кедергі келтіретін заттардың әсерін қалай жояды? 2. Судың тотығуы неге байланысты? 3. Судағы хлор-ионы құрамын қалай анықтайды? 4. Көміртегі (IV) оксидінің құрамын қалай анықтайды? 5. Флокулянттар мен коагулянттар не үшін қолданылады? 6. 100 мл зерттелетін суға 10 мл 0,0105 н марганецқышқылды калий ерітінді қосылған. 10 минут қайнағаннан кейін 10 мл 0,01 н қымыздық қышқылын қосады.Титрлеуге 2 мл КМnO4 ерітіндісі жұмсалды. Оттегіге есептегендегі судың тотығуын есептеу керек. ЗЕРТХАНАЛЫҚ ЖҰМЫС № 3 Тақырыбы: СУДЫҢ КЕРМЕКТІГІН ҚАЛПЫНА КЕЛТІРУ ӘДІСТЕРІ Жұмыстың мақсаты:студенттерді суды жұмсартудың физика-химиялық және химиялық әдістерімен таныстыру, зертханалық жағдайда технологиялық көрсеткіштер бойынша үрдістің жүруін бағалауды және суды жұмсартудың химиялық және физика–химиялық әдістерінің тиімділігін мысалдармен салыстыруды үйрету. Теориялық бөлім.. Су дайындау табиғи сулардың құрамында кездесетін коллоидты бөлшектер, еріген тұздар және газдар сияқты зиянды заттарды бөлудегі негізгі комплексті операция болып табылады. Су дайындауға тұндыру, жұмсарту, дегазация, тұзсыздандыру және залалсыздандыру операциялары жатады. Судың кермектігінің төмендеуі немесе ондағы катиондар, кальция, магний және темірді толық жою үшін суды жұмсарту жүргізіледі. Жұмсарту әртүрлі әдістермен жүргізіледі: физикалық (суды термиялық және электромагниттік өңдеу), химиялық (әктік, содалық, фосфатты) және ион алмасу әдістері. Химиялық әдістің негізі кальций, магний және темір тұздарының ерігіштік қабілеті аз еритін немесе ерімейтін қосылыстарда анықталған реагенттерге қарай өтеді (олар тұнба түрінде жойылады). Бұл әдістердің мәні суды өңдеу барысында тиісті реагенттің массасымен араласуы болып табылады. Суды әктік әдіспен қайта өңдеу кезінде барлық карбонатты (уақытша) кермектілік біртіндеп –тұрақты жойылады және көміртегі оксидімен (IV) байланыста болады: Mg(HCO3)2 + 2Ca(OH)2 2CaCO3↓ + Mg(OH)2 + 2H2O Ca(HCO3)2 + 2NaOH CaCO3↓ + Na2CO3 + 2H2O MgCl2 + 2NaOH 2NaCl + Mg(OH)2↓ CO2 + Ca(OH)2CaCO3↓ + H2O.(8) Содалық әдіс тек ғана тұрақты кермектікте жүргізіледі және көміртегі окидімен (IV) байланыста болады: (Ca, Mg)SO4 + Na2CO3 (Ca, Mg)CO3↓ + Na2SO4 CO2 + Na2CO3 + H2O 2NaHCO3. (9) Сондықтан суды жұмсартуда әктік – содалық әдіс кең қолданылатын біріктірілген әдіс болып табылады. Әдіс барысында уақытша және тұрақты кермектілік және темір ионы жойылады, органикалық және басқада қоспалар коагуляцияланады ,сондай ақ көміртегі оксидімен тұрақты (IV) байланыс болады. Әктік – содалық әдісі ең жоғарғы жұмсарту дәрежесін көрсетеді, яғни –0,3 мг-экв/л дейін. Са2+ және Mg2+иондарының толық тұнбаға түсуі фосфатты әдісте суды үшнатрийфосфатпен қайта өңдеу арқылы жүреді. Мұнда карбонатты және карбонатты емес кермектіліктер жойылады: 3(Са, Mg)(HCO3)2 + 2Na3РО4 (Ca, Mg)3(РO4)2↓ + 6NaHСO3 3(Са, Mg)Cl2 + 2Na3РО4 (Ca, Mg)3(РO4)2↓ + 6NaCl (10) Ионалмасу әдісінің негізі суды арнайы материал – иониттер – қатты иониттермен сүзуге негізделген. Бұл материалдар тәжірибе жүзінде суда және басқа да еріткіш заттарда ерімейді, ерітінді құрамындағы иондарды шыққан басқа да иондарға алмастыру қабілетіне ие. Катиондарға алмастырылған иониттерді катиониттер, аниондарға алмастырылған иониттерді аниониттер деп атайды. Аниониттер Н+, Na+немесе NН4+ ион группасынан тұрады. Na-катиониті ретінде пермутит, глауконит, цеолит (табиғи материалдар), алюмосиликаттар, сульфокөмір, шайырлар (жасанды және синтетикалық) қолданылады. Катиониттердің негізгі технологиялық сипаттамасына көлемді алмастыру немесе көлемдік жұтылу (Ек) жатады. Ол мольдық санмен, катион арқылы өткен кездегі суда пайда болған катиониттің көлем бірлігімен өлшенеді. Катиониттің алмасу көлемі келесі формуламен есептелінеді: 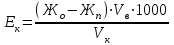 , (11) , (11)мұндаЕк – катиониттің алмасуы бойынша кермектілігі, ммоль/м2; Жо – судың жалпы кермектілігі, ммоль/л; Жп – Суды жұмсартудың берілген кермектігі, ммоль/л; Vв – судың жалпы көлемі, яғни катионит арқылы Жп, л дәрежесіне дейінгі; Vк – катиониттер көлемі, л. Берілген талаптарға байланысты суды жұмсартуда қалған кермек су яғни жұмсартудың жұмыс циклі аяқталғаннан кейінгі кермек су (0,1-0,2 ммоль/л аралығындағы) қолданылады. Сумен және катионит ионымен ион алмасу реакциясы қарама – қарсы жүреді. Реакция барысында тепе – теңдік тез арада орнауы мүмкін: Na2[Кат.] + Ca(HCO3)2 ↔ Ca[Кат.] + 2NaHCO3 Н2[Кат.] + MgCl2 ↔ Mg[Кат.] + 2HCl (12) Натрий тұзының (12) немесе қышқылдың жоғары концентрациясынан реакция тепе-теңдігі ерітіндіде солға қарай ығысады, сонымен бірге суда Са2+, Mg2+, Fe3+ иондарының жұтылуы катиониттердің бөлінуімен қатар басталады. Сондықтан катионит регенерациясының негізі оның аяқталуына байланысты. Na-катионитінің регенерациясы натрий хлориді ерітіндісімен (5-10 %-ды) жүргізіледі: Ca[Кат.] + 2NaCl ↔ Na2[Кат.] + CaCl2. (13) Н-катионит регенерациясы НCl ерітіндісі немесе Н2SO4 (1-2 %-ды) арқылы өтеді: Mg[Кат.] + 2HCl↔ Н2[Кат.] + MgCl2. (14) СаСl2, MgCl2бөлінген тұздарды катиониттен жұмсартылған немесе тұзсыз сумен жуады. Ерімеген судағы қиын анионитті комплекс [АН.] комплексі деп аталады. Аниониттің регенерациясы оған сілтілі ерітіндіні жіберген кезде жүреді: [Ан.]Сl2 + 2NaОН ↔ [Ан.](ОН)2 + 2NaCl. (15) Аниониттер ретінде синтетикалық қарапайым ионалмастыратын шайырлар–аминоформальдегидтержәне карбамидогуанидтер және т.б. қолданылады.Суды тұзсыздандыруды ионалмасу әдісі арқылы жүргізеді, бұл әдістің мәні суды Н-катионит және ОН-анионит арқылы жайлап өткізілуінде. Тапсырмалар: 1. Оқытушыдан зерттелетін су сынамасын алу керек. 2.Әктік–содалық әдіс арқылы суды жұмсарту үшін қажет әк пен соданы есептеу керек. 3.Берілген талдауды суды жұмсартқаннан дейінгі және кейінгі талдаулармен салыстыру керек. 4. Катионалмастырушы колонкаларды дайындау керек. 5. Судың у жұмсару дәрежесін анықтау керек.Алынған нәтижелерді басқа екі әдіс нәтижелерімен салыстыру керек. Ерітінділер мен заттар: 1) натрий гидроксиді; 2) натрий карбонаты; 3) Н- немесеNa-катиониттері; 4) 8 %-ды натрий хлориді ерітіндісі. Құрал –жабдықтар: 1) 250 мл конусты колбалар (4 дана); 2) 2 л колба; 3) сузүге арналған воронка; 4) ионитті колонка (сур.1). Жұмыстың орындалу тәртібі. Зертханалық жағдайда суды химиялық және ионалмасу әдісімен жұмсартуда кішігірім колонкалар қолданылады, колонка құрылысы сурет 1-де көрсетілген. 1) Суды әктік-содалық әдіспен жұмсарту.Мұнда жалпы, карбонатты, карбонатты емес кермектілікті және көміртегі оксидінің(IV) құрамын анықтайды (қарау керек:жұмыс № 1.1). Жұмыстың негізі кермектілікті анықтауда қажет сода мен әкті есептеу болып табылады (қарау керек: есептерге мысалдар). Бұл реагенттер аналитикалық таразыда өлшеніп алынады. Өлшеніп алынған сода 1 л жұмсартылмаған суда ерітіледі де 2 л колбаға ауыстырылады.Колбаны 3 минут үздіксіз араластыру керек. Содан кейін өлшенген натрий гидроксидін қосып тағы да 2-3 минут араластырады. Алынған ерітіндіні біраз тұндырып және фильтр арқылы сүзеді. Бірінші порцияны алып тастайды. Фильтраттан 200 мл су алып оның жалпы, карбонатты, карбонатты емес кермектіліктерін, көміртегі оксидін (IV) анықтайды. Алынған нәтижелерді талдауға дейінгі және кейінгі нәтижелермен салыстырады. Жұмсарту әдістері үшін қолданылатын әдістердің тиімділігі суды жұмсарту дәрежесімен у, судың кермектігімен (жалпы, карбонатты, карбонатты емес) суды жұмсартқаннан кейінгі судың кермектігінің қатынастарымен сипатталады: у(жалпы) =Кж.ж / Кж.шықнемесе у(карб.) =Кк.ж / Кк.шық, у (карб.емес.)= Кк.е.ж / Кк.е.шық (16) Есептерге мысалдар.Мысалы, карбонатты кермектілік 6 мг-экв/л, карбонатты емес кермектілік – 2 мг-экв/л, магнийлік – 3 мг-экв/л, көміртегі диоксиді – 9 мг-экв/л. Суды жұмсарту үшін талап етіледі: 1) Са(ОН)2: 6 + 3 + 9 . (1/22) = 9,4 мг-экв/л, мұнда 1/22 – СО2 мг-экв/л-ге қайта есептегендеге фактор, немесе 9,4 . 74/2 = 347,8 мг/л немесе0,348 г1 л суда. 2) Na2СО3: 2 . 106/2 = 106 мг/л = 0,106 г1 лсуда. 2) Суды ион алмасу әдісімен жұмсарту.Катион алмастыру колонкасы әйнек түтікшеден тұрады1(сурет 1-де көрсетілген).Түтікшенің ұзындығы 60-80 см, диаметрі 2,5-3,5 см, төменгі бөлікке араластыру үшін әйнек мақта немесе әйнек пластинка бекітілген3. Түтікше кранмен жалғанған 4. Оны биіктігі 40-50см катиониттермен (КУ-2 сульфокөмір және т.б.) толтырады.
Жұмыс нәтижелерін рәсімдеу. Есепті жазу барысында жүргізілген жұмысқа қысқаша түсініктеме беру керек. Суды жұмсартудың химиялық теңдеуін құрастыру керек, натрий гидроксиді мен натрий карбонатын есептеу жолдарын жазу қажет, катионит регенерациясы мен суды ионалмасу әдісімен жұмсартудың реакция теңдеулерін құрастыру керек. Суды химиялық және физика – химиялық әдіспен жұмсартудың тиімділігіне салыстырмалы баға беру керек. Есеп нәтижелері кесте 3-ке толтырылады. Кесте3 – Талдау нәтижелері.
| |||||||||||||||||||||||||||||||||||||||||||