32 вариант отправить. xv задачи xvi. Формула
 Скачать 71.66 Kb. Скачать 71.66 Kb.
|
xii. xiii.13. Как связано произведение PV(RT) с суммарной кинетической энергией молекул 1 моля газа? Какой физический смысл вкладывает молекулярно-кинетическая теория в понятие «температура» и «абсолютный нуль» (-2730С)? Используя выводы молекулярно-кинетической теории, рассчитайте недостающие в таблице данные (в соответствии со своим вариантом).
xxx. xxxi.Решение: xxxii.Важнейший вывод молекулярно-кинетической теории газов, связывающий параметры уравнения состояния со средней кинетической энергией движущихся молекул: xxxiii.PV = RT=l/3 Mu2; xxxiv.здесь М – масса моля газа; xxxv.u2 – среднее значение квадрата скорости. xxxvi.Мера абсолютной температуры - это средняя кинетическая энергия поступательного движения молекул идеального газа. Абсолютный нуль (-273,15 0С) - температура, при которой поступательное движение молекул идеального газа замирает. xxxvii.t0=298-273=25 0C xxxviii.PV=RT=2/3 Mu2/2 или RT=Mu2/3, xxxix.где R – универсальная газовая постоянная xl.Т – температура газа, °К; xli.М – молярная масса газа (масса моля), кг; xlii.u – средняя скорость движения молекул. xliii. xliv.Откуда M=3RT/u2=2*8,314*298/609,472=0,02 кг xlv.Ответ: 0,02 кг xlvi. xlvii. xlviii. xlix. l. li. lii. liii.24. Сформулируйте закон Гесса. В каких условиях теплота реакции может быть заменена изменением энтальпии процесса? Найдите энтальпию реакции по величинам энтальпий образования исходных веществ и конечных продуктов (в соответствии со своим вариантом). liv.
lix. lx. lxi.Решение: Формулировка закона Гесса: Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии). Тепловой эффект реакции при постоянном давлении можно представить в виде изменения свойства системы, т. е. QР = Н2 –Н1 =DН, [8], где H1 — энтальпия исходных веществ, а H2 — энтальпия продуктов реакции. Иными словами, Qp, так же как и Qv, не зависит от пути протекания реакции. lxii.
lxxiii. lxxiv.∆rН0298 находим из соотношения : lxxv.∆Н = ∑Нкон - ∑Ннач lxxvi.∆Нх.р298=--241,82*2-393,51*2+484,2=180,82 кДж/моль lxxvii.Ответ: 180,82 кДж/моль lxxviii. lxxix. lxxx. lxxxi. lxxxii. lxxxiii. lxxxiv. lxxxv. lxxxvi. lxxxvii. lxxxviii. lxxxix.45. Что понимается под скоростью реакции? Какие факторы влияют на скорость реакции? Какая реакция называется реакцией первого порядка? Каким кинетическим уравнением она описывается? Найти количество вещества, оставшееся после протекания реакции, или время реакции по данным таблицы:
cxiii. cxiv.Решение: Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени. Факторы: концентрация, температура, катализатор, давление, площадь соприкосновения реагирующих веществ, природа реагирующих веществ. Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка. Реакции первого порядка характеризуются кинетическим уравнением вида: А ––> В . Подставим в него выражение: cxv.Реакция описывается кинетическим уравнением реакции первого порядка, т. е. 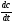 =—к·х, или k·t = ln =—к·х, или k·t = ln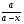 , или кt = 2,3 lg[a/(a–x)], , или кt = 2,3 lg[a/(a–x)],cxvi.где к–константа скорости, t– время реакции, а – начальная концентрация или количество вещества, х – текущая концентрация, прореагировавшее количество, (а—х) – конечная концентрация. cxvii.Кроме того, константа скорости связана с периодом полураспада соотношением к = 0,69/τ. Отсюда 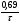 ·t = 2,3 lg ·t = 2,3 lg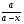 . .cxviii.Подставим данные задачи в полученное уравнение: cxix. cxx.3,44*10-8*30= 2,3·lg 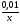 cxxi.Х=0,01 моль/л cxxii.Период полураспада: cxxiii. 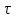 =0,69/3,44*10-8=2.0*107 =0,69/3,44*10-8=2.0*107cxxiv.Ответ: 0,01 моль/ л; 2,0*107. cxxv.67. Для реакции, соответствующей номеру вашего шифра, выполните следующее задание:
cxxvi. cxxvii.
cxxxvi. cxxxvii.Решение: cxxxviii.Принцип Ле Шателье: cxxxix.Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия. cxl.При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом. cxli.Так как количество моль исходных веществ равно количеству продуктов, то давление на равновесие невлияет. cxlii. cxliii.Kр= 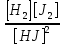 = =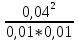 =16 =16cxliv. cxlv.Ответ: Кр=16. cxlvi. cxlvii. cxlviii. cxlix. cl. cli. clii. cliii. cliv. clv. clvi. clvii. clviii.93. Каково биологическое значение буферных смесей? Приведите примеры буферных растворов, встречающихся в живых организмах. Рассчитайте соотношение кислоты и соли (концентрации равные) в буферной смеси с величинами рН, представленными в таблице.* clix.
clxix.Примечание*константы диссоциации даны в приложении clxx.Решение: Буферные системы в живых организмах поддерживают постоянство рН в крови и тканях. Исследования показали, что в процессе обмена веществ в организме образуется большое количество кислых продуктов. Так, в организме человека за сутки образуется такое количество раз личных кислот, которое эквивалентно 20-30 л I н. сильной кислоты. Сохранение постоянства рН среды в организме обеспечивается наличием в нем мощных буферных систем. Большую роль при этом играют белковый, бикарбонатный и фосфатный буферы. Буферной системой крови являются бикарбонатный и фосфатный буферы: Н2С03 + NaHCO3; NaH2P04 + Na2НРО4соответственно. Однако наиболее мощной буферной системой крови является гемоглобиновый буфер (75% всей буферной ёмкости крови), который удаляет из организма большое количество углекислоты. Большое значение в поддержании постоянного рН в клетках тканей имеет белковый буфep. Он состоит из протеина (белка) –Ptи его соли. Компоненты этого буфера можно представить как: 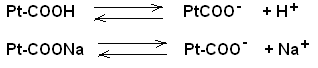 clxxi.рК(кислоты)=2,12 clxxii.Для данного буферного раствора pH рассчитывается по формуле: clxxiii.pH = pK+lgCкисл./C соли clxxiv.lgCкисл./Cсоли=2,12-6,81=4,69 clxxv.Cкисл./Cсоли=2*10-5 clxxvi.Ответ: 2*10-5 clxxvii. clxxviii. clxxix. clxxx. clxxxi. clxxxii. clxxxiii. clxxxiv.112. Что такое адсорбция? Какие виды адсорбции наблюдаются в почвах? Рассчитайте количество уксусной кислоты, адсорбированное 100 г почвы из раствора концентрации «С» (см. таблицу), если в уравнении Фрейндлиха К=9,5; 1/п = 0,22. clxxxv.
cxc. cxci.Решение: cxcii.Адсорбция – это концентрирование веществ на поверхности или в объеме твердого тела. cxciii.В почвах адсорбция может происходить на различных межфазных поверхностях: твердой и жидкой (адсорбция из раствора), твердой и газообразной (адсорбция из паров или газа), жидкой и газообразной и др. Она наиболее выражена в дисперсных грунтах, где доля межфазных поверхностей наиболее значительна. cxciv.Также различают обменную адсорбцию — процесс поглощения поверхностным слоем грунта ионов из порового раствора электролита, сопровождающийся переходом в раствор эквивалентных количеств ионов из грунта (без разрушения его кристаллической структуры), поглощенных им ранее. cxcv.Уравнение Фрейндлиха имеет в данном случае вид: cxcvi.Г = 9,5∙С0,22 cxcvii.Г=9,5*0,0140,22=3,71 ммоль/100 г cxcviii.Ответ: 3,71 моль/100 г cxcix. cc. cci. ccii. cciii. cciv. ccv. ccvi. ccvii. ccviii. ccix. ccx. ccxi. ccxii. ccxiii. ccxiv. ccxv. ccxvi. ccxvii. ccxviii.122. Каковы условия получения коллоидных растворов? Укажите вещества, которые могут служить стабилизаторами для указанных в таблице коллоидных систем, полученных в результате обменных реакций. ccxix.
ix. ccxx.Решение: Для образования устойчивых лиофобных коллоидных растворов необходимо выполнение следующих условий: 1) малая растворимость дисперсной фазы в дисперсионной среде; 2) определенные размеры частиц дисперсной фазы (10-9 -10-7 м); 3) наличие в системе стабилизатора. ccxxi. ccxxii.AgCl+Н2О=Ag2O + 2HCl ccxxiii.m[Ag2O ]∙nAg+ ccxxiv.m[AgCl]∙nAg+ ccxxv.m[AgCl]∙nСl- ccxxvi.Одноименные или близкие по химической природе ионы могут быть ионами-стабилизаторами (потенциалопределяющими ионами). ccxxvii. ccxxviii. ccxxix. ccxxx. ccxxxi. ccxxxii. ccxxxiii. ccxxxiv. ccxxxv. ccxxxvi. ccxxxvii. ccxxxviii. ccxxxix. ccxl. ccxli. ccxlii. ccxliii. ccxliv. ccxlv. ccxlvi. ccxlvii. ccxlviii.145. Что такое электрофорез? Как величина скорости электрофореза зависит от величины 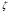 - потенциала? Вычислить величину - потенциала? Вычислить величину 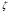 -потенциала указанного ниже золя. -потенциала указанного ниже золя.ccxlix.
cclxii. cclxiii.Решение: cclxiv. Электрофорез - это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля. cclxv. 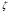 потенциал, связанный с зарядом коллоидной частицы, – важнейшая характеристика устойчивости золя. Величину потенциал, связанный с зарядом коллоидной частицы, – важнейшая характеристика устойчивости золя. Величину 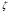 потенциала находят по данным электрофореза с использованием формулы: потенциала находят по данным электрофореза с использованием формулы:cclxvi. 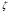 = = 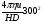 , ,cclxvii.где η — вязкость, пуазы; cclxviii.u — скорость перемещения частиц, см/сек; cclxix.Н — градиент внешнего поля, В/см; cclxx.D — диэлектрическая проницаемость среды. cclxxi.Подставляя в формулу π = 3,14, η=0,01 пуаз, D=81 и учитывая множитель 3002, получим: cclxxii. 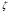 = 139,55 u/Н. = 139,55 u/Н.cclxxiii.Подставляя в формулы данные задачи, получим: cclxxiv. 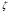 =139,55∙0,00173:8=0,0302 B = 30,2 мB =139,55∙0,00173:8=0,0302 B = 30,2 мBcclxxv.Ответ: 30,2 мВ cclxxvi. cclxxvii. cclxxviii. cclxxix. cclxxx. cclxxxi. cclxxxii. cclxxxiii. cclxxxiv. cclxxxv. cclxxxvi. cclxxxvii. cclxxxviii. cclxxxix. ccxc.156. В чем сущность правила Шульце-Гарди?
ccxci.NaCl, Na2SO4, CuCl2, A12(SO4)3, A1C13, K3[Fe(CN)6]. ccxcii.
ccxcix. ccc.Решение: ccci.Правило Шульце-Гарди (правило значности, эмпирическое): Коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду потенциалопределяющих ионов мицеллы (гранулы), причем, коагулирующее действие тем сильнее, чем выше заряд. cccii.По правилу Шульца – Гарди значение порогов коагуляции для противоионов с зарядами 1, 2 и 3 соотносятся как 1:1/20:1/500, т.е. чем выше заряд, тем меньше требуется электролита, чтобы вызвать коагуляцию. ccciii.{m[Al(OH)3]∙nAl+3∙3(n – x)Cl–}3x+∙3xCl– ccciv. cccv.в фигурных скобках - коллоидная частица m[Al(OH)3]∙nAl+3-ядро m[Al(OH)3]- агрегат (где m - число молекул Al(OH)3, содержащихся в агрегате мицеллы), nAl+3∙3(n – x)Cl–}3x+-адсорбционный слой (где - n Al+3 число потенциалопределяющих ионов, cccvi. (n – x)Cl–– число противоионов, находящихся в адсорбционном слое (как правило, m » n) cccvii.3xCl– диффузный слой (число противоионов, находящихся в диффузном слое); cccviii.3x – общее число противоионов cccix.Заряд образующейся системы, в данном случае положительный. cccx.Значит, ионы-коагуляторы заряжены отрицательно. cccxi.Коагуляционная способность повышается с повышением заряда иона-коагулянта (правило Шульце-Гарди). cccxii. cccxiii.K3[Fe(CN)6]> A12(SO4)3> Na2SO4>A1C13> CuCl2 >NaCl cccxiv. cccxv.A12(SO4)3> Na2SO4 В этих веществах сульфат-аноны двухвалентны, но большую коагулирующую способность будет иметь A12(SO4)3, т.к. при диссоциации 1 моля вещества образуется 3 моля анионов сульфата. cccxvi.A1C13> CuCl2 >NaCl В этих веществах хлорид-аноны одновалнтны, но большую коагулирующую способность будет иметь A1C13, т.к. при диссоциации 1 моля вещества образуется 3 моля анионов хлорида. cccxvii.Задачи для контрольной работы cccxviii.166. Что такое изоэлектрическое состояние полиэлектролита в растворе? Что такое изоэлектрическая точка белка? Определите знак заряда частицы белка в растворах с указанными в таблице значениями рН и укажете, к кому электроду будут двигаться молекула аминокислоты. cccxix.
cccxxxii. cccxxxiii.Решение: cccxxxiv. Состояние, при котором число разноименных зарядов в белковой молекуле одинаково, т.е. суммарный заряд полиамфолита равен нулю, называется изоэлектрическим. Значение рН раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой. cccxxxv.При величинах рН больше чем величина ИЭТ (изоэлектрической точки) молекула белка заряжена отрицательно, а при величинах рН меньше чем ИЭТ положительно, значит в нейтральной среде (рН = 7) будем иметь: cccxxxvi. cccxxxvii. глиадин ИЭТ = 9,8>7 заряд - cccxxxviii.Таким образом, при электрофорезе глиадин будет двигаться к аноду. cccxxxix. cccxl. cccxli. cccxlii. cccxliii. cccxliv. cccxlv. cccxlvi. cccxlvii. cccxlviii. cccxlix. cccl. cccli. ccclii. cccliii. cccliv. ccclv. ccclvi. ccclvii. ccclviii. ccclix. ccclx. ccclxi. ccclxii. ccclxiii. ccclxiv. ccclxv. ccclxvi. ccclxvii. ccclxviii. ccclxix. ccclxx. ccclxxi. ccclxxii. ccclxxiii. ccclxxiv. ccclxxv. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 H2O+CO2
H2O+CO2 2HJ
2HJ