№ 1.1 Квантово-механическая модель атома. Характеристики энергетического состояния электрона системой квантовых чисел. Основное и возбужденное состояние атома.
Атом обладает минимальной энергией, когда все электроны расположены на первых от ядра орбитах. Такое состояние называется основным состоянием атома.
Принцип минимальной энергии гласит, что электроны в основном состоянии заполняют орбиталь в порядке повышения уровня энергии орбитали. При получении порции энергии внутренние электроны могут переходить на внешние орбиты, такое состояние называется возбужденным, оно характеризуется неустойчивостью. Для характеристики поведения электрона в атоме введены четыре квантовых числа. Каждая орбита имеет номер, который называется главным квантовым числом и обозначается n. Оно определяет энергию (энергетический уровень) и размер электронных орбит. Орбитальное квантовое число l определяет форму атомной орбиты. Магнитное квантовое числоml характеризует ориентацию орбитали в пространстве. Магнитное квантовое число изменяется в интервале [-l,l], включая ноль. Все вышеперечисленные квантовые числа принимают только целые значения. Чем сложнее форма атомной орбиты, тем большим числом способов она может быть ориентирована. Четвертое квантовое число называется спин ms. Каждый электрон имеет собственный механический момент движения, в зависимости от направления вращения, проекция спина на соответствующую ось координат имеет значение -½ или +½ . Четыре квантовых числа полностью характеризуют состояние электрона в атоме.
|
№ 1.2 Периодический закон и периодическая система Д. И. Менделеева в свете квантово-механической теории строения атомов; s-, р-, d-, f-блоки элементов.
Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов элементов.
Выводы из переодического закона:
1. Строение внешней электронной оболочки атома является периодической функцией зарядового числа атома Z
2. Химические свойства элементов находятся в периодической зависимости от заряда ядра
3. Номер периода в системе элементов равен главному квантовому числу n энергетического уровня внешних n-орбиталей, заполняемых в этом периоде
4. Число элементов в периоде, т.е. его длина, равно удвоенному числу внешних квантовых орбиталей, заполняемых в этом периоде
5. В одну группу периодической системы входят элементы с однотипной электронной конфигурацией внешней оболочки атома.
Элемент – совокупность атомов с одинаковым зарядом ядра
Однотипные соединения элементов – соединения сходные по химическому составу и структуре.
Электроотрицательность – величина, характеризующая способность атомов этого элемента в молекулах притягивать к себе электроны.
Сродство атома элемента к электрону – величина, измеряемая энтальпией реакции образования аниона
s–блок – 1А – щелочные и 2А – щелочно-земельные металлы. В качестве валентных выступают е s-орбиталей (s-элементы)
d-блок – 3Б–8Б, 1Б, 2Б. Комплексообразующие переходные элементы. Валентные – e s- и d-орбиталей (d-элементы)
p-блок – 3А–8А – неметаллы, амфотерные и благородные элементы. Валентные e p-орбиталей (p-элементы)
|
№ 1.3 Развитие представлений о природе химической связи. Основные характеристики связи. Геометрия связи и молекулы. Водородная связь. Межмолекулярные взаимодействия.
Химическая связь – совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов.
Основные характеристики хим. связей:
Длина связи - rс величина, измеряемая расстоянием между ядрами связываемых атомов
Прочность связи Ec – величина, измеряемая энтальпией ΔНс образования связи.
Ориентация химической связи αс – величина, измеряемая углом, между направлениями связей данного атома с соседними атомами молекулы. αс – валентный угол.
Полярность связи – μс величина, измеряемая электрическим моментом данной связи
Водородная связь – образуется, если положительно заряженный атом H одной молекулы притягивается к отрицательно заряженному атому другой молекулы. Это притяжение имеет частично электростатический (кулоновский), частично ковалентный характер. Между молекулами существует: дипольное взаимодействие, индуцированное или дисперсионное взаимодействие (вандер-ваальсовое взаимодействие) – возникновение сил притяжения и отталкивания при возникновении и исчезновении частичных зарядов внутри молекулы, порождающие заряды на соседних молекулах.
|
|
|
№ 2.1 Классификация веществ живого организма по их биологической роли. Классификация реакций, основанная на природе переносимых частиц.
Аминокислоты – амфотерные органические соединения, содержащие кислотную, карбоксильную и аминогруппу.
Белки – полипептиды(полиамиды , состоящие из α – аминок-т) с большим молекулярным весом.
Углеводы – (сахара),используются как источники энергии в процессах метаболизма, являются компонентами ряда классов веществ клетки, включая нуклеин. к-ты и др.
Липиды – органические соединения, входящие в состав тканей и животных растений, построены по типу сложных эфиров. Нейтральные жиры и жироподобные соединения.
Гормоны – физиологически активные в-ва, которые вырабатываются эндокринными органами в ответ на сигналы из внешней или внутренней среды.
Витамины – группа органических соединений разнообразной химической природы, необходимых для нормальной жизнедеят-ти организма.
Ферменты – специфические белки, образующиеся в тканях организмов, обладающих способностью ускорять химические реакции.
Изменение химической природы реагирующих веществ в ходе химической реакции происходит в результате перераспределения электронов внешних оболочек атомов, т. е. за счет переноса частиц от одного реагента к другому. Такие частицы могут быть простейшими (электрон, протон) или более сложными (атомно-молекулярными). В соответствии с видом переносимых частиц рассматривают следующие основные типы реакций в растворах:
1) протолитические реакции, суть которых заключается в переносе протона от одних частиц к другим; изменение кислотно –основных св-в реагирующих веществ. Кислота –донор протонов, основание – акцептор протонов. Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями – протолитические.
2) редокс-реакции, в ходе которых от одной частицы к другой переносятся электроны, что вызывает изменение окислительно-восстановительных свойств реагирующих веществ;
3) реакции замещения лигандов, сопровождающиеся переносом электронных пар и приводящие к образованию или разрушению комплексных соединений;
4) гетерогенные реакции в растворах электролитов, т. е. реакции образования осадков или их растворения.
|
№ 2.2 Протолитические реакции. Основные положения протолитической теории кислот и оснований: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара, амфолиты. Водородный показатель рН.
К протеолитическим реакциям относятся:
1) Процессы ионизации кислот и оснований:
CH3COOH + H2O CH3COO- + H3O+
NH3 + H2O NH4+ + OH-
c(B-)c(H3O+) с(OH-)c(HB+)
Ka = c(HB) Kb = c(B)
Для удобства расчётов и записи часто пользуются не самими константами, а их показателями, т.е. pKa = - lgKa; pKb = - lgKb
2) Реакции нейтрализации между двумя слабыми электролитами (CH3COOH и NH3): NH3 + CH3COOH NH4+ + CH3COO-
сильными и слабыми электролитами:
NH3 + H3O+ NH4+ + H2O
CH3COOH + OH- H2O + CH3COO-
и сильными электролитами
H3O+ + OH- H2O + H2O
3) ионный гидролиз
CH3COO- + H2O CH3COOH + OH-
Kw
Kh(CH3COO-) = Ka(CH3COOH)
NH4+ + H2O H3O+ + NH3
Kw
Kh(NH4+) = Kb(NH3)
Для характеристики кислотности среды вводят водородный показатель pH.
pH = -lgc(HB) [(HB) = (H3O+)] – для сильных кислот
pH = 14 + lgc(B) – для сильных оснований
pH = 0,5 (pKa + lgc(HB))- раствор слабой кислоты
pH = 14 – 0,5(pKb + lgc(B)) – раствор слабого основания
|
№ 2.3 Окислительно-восстановительные реакции. Редокс-системы первого и второго типа. Типы редокс-реакций: межмолекулярные, внутримолекулярные, диспропорционирования.
ОВР - химические процессы, сопровождающиеся переносом электронов от одних молекул к другим, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ
Окисление – потеря e
Восстановление – присоединение е
Восстановители (Red) – отдают e. Малую СО. ОЭО<1,5
Окислители (Ox) – присоединяют е. Большая СО. ОЭО>3.0
Степень окисления (СО) – формальный заряд атома.
Редокс-системы второго типа, в которых перенос e сопровождается переносом Н+. В них наблюдается совмещённое редокс-протолитическое равновесие. Для расчёта их
RT a(Ox)
редокс-потенциала: φ = φ0 + nF ln a(Red) am(H+)
RT a(Ox)
φ = φ0 + nF ln a(Red) уравнение Нернста для редокс-потенциала (когда и окислитель и восстановитель находятся в растворённом состоянии).
RT
φ = φ0 + nF ln ai – уравнение Нернста для электродного потенциала (на границе раздела металл-раствор)
Межмолекулярные редокс-реакции. Атом-окислитель и атом-восстановитель находятся в составе разных реагентов
2KNO2 + 2KI + 2H2SO4 2NO + I2 + 2K2SO4 + 2H2O
Диспропорционирования – одна часть атомов одного и того же вещества выступает в роли окислителя, а друга (в той же степени окисления) – в роли восстановителя
2NO2 + 2OH- NO2- + NO3- + H2O
Внутримлекулярного окисления-восстановления - атом-окислитель и атом-восстановитель находятся в составе одной формульной единице: 2KClO3 3O2 + 2KCl
|
|
|
№ 2.4 Лигандообменные реакции. Основные понятия координационной теории Вернера. Пространственное строение комплексных соединений. Классы комплексных соединений: хелатные, внутрикомплексные, макроциклические, многоядерные, сэндвичевые и др.
Mz+ + nLx- [MLn]z-nx – образование ковалентной связи по донорно-акцепторному механизму.
Тероия Вернера (1893г) – В молекулах комплексных соединений выделяют центральный атом или ион М и связанные с ним n-молекул (или ионов) L - лигандов
Центральный атом, окружающие линганды – внутренняя координационная сфера MLn
z-nx – внешняя сфера комплекса
Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве. Число (n) лигандов называют координационным числом, а внутреннюю сферу - координационной
Ориентация связей металл-лиганд определяет пространственную конфигурацию комплексных молекул и ионов. Бывают квадратные (ML4), октаэдрические (ML6), линейные (ML2),
Классы комплексных соединений: макроциклические (донорные атомы связаны в кольцо), полидентатные (несколько донорных атомов), хелатные (полидентатные лиганды, координируемые одним и тем же центральным атомом), монодентатные (одна связь с центральным атомом)
с([MLn]z-nc) c(Mz+)cn(Lx-)
β = c(Mz+)cn(Lx-) (константа устойчивости) Kн = с([MLn]z-nc) (константа нестойкости)
|
№ 2.5 Реакции атомно-молекулярного обмена. Реакции радикального, электрофильного и нуклеофильного замещения.
Радикальное замещение (галогенирование) – состоит из стадий: инициирование, рост цепи, обрыв цепи. Это типичные реакции фотолиза. Характерны для насыщенных органических соединений
Электрофильное замещение – характерно для циклических соединений. Вначале происходит образование нестойкого π-комплекса, а затем устойчивого σ-комплекса.. Затем происходит отщепление протона от σ-комплекса и восстанавливается ароматичность.
Нуклиофильное замещение – атакующий реагент (нуклеофил) отдаёт субстрату свою пару электронов, за счёт которой образуется связь между субстратом и нуклеофилом, а хорошо уходящая группа (нуклеофуг) отщепляется со своей парой электронов. Характерны для насыщенных органических соединений включающих различные функциональные группы.
Продуктами таких реакций, в зависимости от количества и расположения атомов галогена в гало-генопроизводном, могут быть спирты, карбонильные соединения, а также карбоновые кислоты, например:
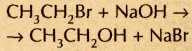 , , 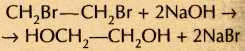 , , 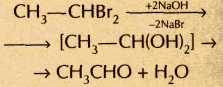 , ,
.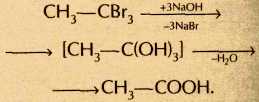 Многие галогеноводороды широко используются в самых разнообразных целях: в качестве растворителей (хлороформ СНСI3, четырёххлористый углерод ССI4), как рабочее вешество в холодильных установках (CF2CI2 и другие фреоны), при химической чистке одежды (трихлорэтилен СНС1=СС12). Многие галогеноводороды широко используются в самых разнообразных целях: в качестве растворителей (хлороформ СНСI3, четырёххлористый углерод ССI4), как рабочее вешество в холодильных установках (CF2CI2 и другие фреоны), при химической чистке одежды (трихлорэтилен СНС1=СС12).
|
№ 2.6 Реакции ассоциации-диссоциадии и агрегации. Реакции присоединения, осаждения.
Диссоциативные (мономолекулярные) – процесс распада молекулы на отдельные части. Участвует одна молекула.
Ассоциативные (бимолекулярные) – нуклеофильная реакция и согласованная реакция
Агрегация – укрепление дисперсных частиц коллоидной системы. Постепенно они становятся настолько большими, что особенности присущие коллоидным системам исчезают.
Реакции осаждения – идут с выпадением осадков.
Химические реакции осаждения подразделяются на две группы:
1. реакции присоединения, например взаимодействие аммиака и фосфорной кислоты с образованием моноаммонийфосфата 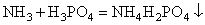
или пероксида водорода и метабората натрия с образованием пербората натрия 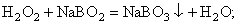
2. реакции обменного разложения, когда один из вновь образующихся компонентов является менее растворимым по сравнению с другим, и высаливается из раствора, например 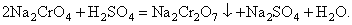
Вторая группа реакций получила более широкое распространение
|
|
|
№ 3.1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики.
Термодинамика – наука о взаимопревращениях теплоты и энергии.
Термодинамический метод основан на ряде понятий:
термодинамическая система – любой объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделённый от других объектов природы
Процессы жизнедеятельности на Земле обусловлены накоплением солнечной энергии в биогенных веществах – белках, жирах, углеводах и последующим превращением этих веществ в живых организмах с выделением энергии. С развитием термодинамики стало возможным количественно рассчитывать превращение энергии в биохимических реакциях и предсказывать их направление.
Химическая термодинамика изучает превращения энергии и энергетические эффекты, сопровождающие химические и физические процессы, а также возможность и направление самопроизвольного протекания процесса. Химическая термодинамика является основой современной химии.
Химическая реакция - процесс, при котором одни связи заменяются другими, образуются одни соединения, разлагаются другие. Следствие - энергетические эффекты, т.е. изменение внутренней энергии системы.
Система - ело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее (вода в стакане). Если такая система не обменивается веществом со средой (стакан покрыт крышкой), она называется закрытой. Если же система имеет постоянный объем и рассматривается как лишенная возможности обмена веществом и энергией с окружающей средой (вода в термосе), такая система называется изолированной.
Внутренняя энергия U - общий запас энергии, включая движение молекул, колебания связей, движение электронов, ядер и. д., т.е. все виды энергии кроме кинетической и потенциальной энергии системы в целом.
|
№ 3.2 Основные понятия термодинамики. Внутренняя энергия. Работа и теплота - две формы передачи энергии. Типы термодинамических систем и процессов.
Понятия термодинамики:
Система – любой объект природы, состоящий из большого числа молекул (структурных единиц) и отделённый от других объектов природы реальной или воображаемой граничной поверхностью (границей раздела).
Состояние системы – совокупность свойств системы, позволяющих определить систему с точки зрения термодинамики.
Внутренняя энергия системы – сумма энергий теплового движения молекул и энергии взаимодействия между ними или функция состояния системы, приращение которой равно теплоте Qv. полученной системойв изохорном процессе.
Внутреннюю энергию нельзя определить, поскольку у системы нельзя отнять всю энергию.
Фаза - гомогенная часть гетерогенной системы (вода и лед в стакане)
Фазовый переход - превращения фаз (таяние льда, кипение воды).
Термодинамические функции: состояния системы: применяются для определения изменения энергии в тех или иных условиях.(например ΔЕ – внутренняя энергия системы)
Изменение ΔЕ обусловлено работой W, которая совершается при взаимодействии системы со средой, и передачей теплоты Q между средой и системой.
Типы ТД систем (по характру обмена веществом и энергией с окружающей средой)
Изолированная система – не обменивается со средой ни веществом, ни энергией (Δm = 0; ΔE = 0)
Закрытая система – не обменивается со средой как веществом, но может обмениваться энергией
Открытая система – может обмениваться со средой как веществом, так и энергией.
(по агрегатному состаянию)
Гомогенная – отсутствие резких изменений физических и химических свойств при переходе от одних областей системы к другим.
Гетерогенная – две или более гомогенные системы в одной.
Теплота образования - тепловой эффект реакции образования вещества из каких-либо исходных веществ.
Энергетические превращения в ходе процесса выражаются в виде теплового эффекта - либо теплота выделяется (экзотермические реакции), либо поглощается (эндотермические реакции).
Количество выделенной или поглощенной теплоты Q называется тепловым эффектом реакции.Изучением тепловых эффектов занимается термохимия.
|
№ 3.3 Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования, стандартная энтальпия сгорания. Закон Гесса. Термохимические процессы. Применение первого начала термодинамики к биосистемам.
Первое начало термодинамики: Приращение внутренней энергии системы ΔE в некотором процессе равно теплоте Q, полученной системой, плюс работа W, совершённая над системой в этом процессе.
ΔE = Q + W
Энтальпия: функция состояния системы, приращение которой равно теплоте, полученной системой в изобарном процессе.
Н = E + pV
Стандартная энтальпия образования вещества (ΔfH0) – увеличение или уменьшение энтальпии, сопровождающее образование 1 моль вещества из простых веществ, при условии, что все участники реакции находятся в стандартном состоянии
Стандартная энтальпия сгорания вещества (ΔсH0) – уменьшение энтальпии при окислении в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления.
Закон Гесса – энергия не создаётся и не уничтожается, а лишь переходит из одного вида энергии в другой.
Следствия из закона Гесса
1) Тепловой эффект кругового процесса равен нулю. Круговой процесс - система, выйдя из начального состояния, в него же и возвращается.
DH1 + DH2 - DH3 = 0 Отсюдаа же вытекает и закон Лавуазье-Лапласа.
2) Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования начальных (исходных) веществ.
3) Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных продуктов.
Термохимические процессы:
Экзотермические – реакции, при протекании которых происходит уменьшение энтальпии системы (ΔН < 0) и во внешнюю среду выделяется теплота
Эндотермические – реакции, в результате которых энтальпия возрастает (ΔН > 0) и система поглощает теплоту Q извне.
-ΔE = -Q – W – в биологических системах, т.к работа совершается системой за счёт убыли внутренней энергии, теплота отдаётся во внешнюю среду.
| |
 Скачать 0.82 Mb.
Скачать 0.82 Mb.