Ответы на Экзаменационные вопросы - 2005 год. 1. 1 Квантовомеханическая модель атома. Характеристики энергетического состояния электрона системой квантовых чисел. Основное и возбужденное состояние атома
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
Скорость прямой реакции (образование веществ D и F) уменьшается по мере расходования исходных веществ (А и В), а скорость обратной реакции будет увеличиваться по мере накопления продуктов реакции (D и F). В связи с этим в химической кинетике пользуются понятием средней скорости в данном интервале времени Δt: Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени: Скорость химической реакции зависит в первую очередь от природы реагирующих веществ. Скорость гомогенной реакции зависит от концентрации реагентов, а гетерогенных — от площади соприкасающихся фаз, т. е. степени дисперсности. Скорости всех реакций зависят от температуры, многих реакций — от присутствия катализаторов. Важной характеристикой реакции является период полупревращения t05 — время, за которое в реакцию вступает половина исходного вещества. Для радионуклидов аналогичная величина называется периодом полураспада. Порядок реакции определяют, сопоставляя изменение величин начальной концентрации (с0) и периода полупревращения (t0,5). Реакции, для которых наблюдается прямая зависимость между изменениями значений с0 и t0>5, относятся к реакциям нулевого порядка; ре-акции с обратной зависимостью величин с0 и t05 — к реакциям второго порядка; реакции, в которых tO,5*f{ca) — к реакциям первого порядка. | ||
| | ||
| | ||
| № 5.2 Зависимость скорости реакции от концентрации. Кинетические уравнения реакций нулевого, первого и второго порядков. Экспериментальные методы определения скорости и константы скорости реакций. Скорость химической реакции (v) определяется изменением концентрации Ас реагирующих веществ (или продуктов реакции) в единицу времени. Размерность скорости химической реакции — концентрация/время: Скорость химической реакции в общем случае не является постоянной в течение всего времени ее протекания. Рассмотрим обратимую реакцию: Скорость прямой реакции (образование веществ D и F) уменьшается по мере расходования исходных веществ (А и В), а скорость обратной реакции будет увеличиваться по мере накопления продуктов реакции (D и F). В связи с этим в химической кинетике пользуются понятием средней скорости в данном интервале времени Δt: Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени: Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например, для реакции: Константа скорости зависит от тех же факторов, что и скорость химической реакции, но не зависит от концентрации реагирующих веществ. Величина p + qопределяет порядок кинетического уравнения реакции, который показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0, 1, 2 и более, он может быть также дробным. Кинетические уравнения. О Д - единица измерения — секунда в минус первой степени. Для реакций второго порядка: | № 5.3 Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль реакции: энергия активации; уравнение Аррениуса. Роль стерического фактора. Понятие о теории переходного состояния. Скорость реакций зависит от температуры. В соответствии с эмпирическим правилом Вант-Гоффа скорость большинства реакций увеличивается приблизительно в 2—4 раза при увеличении температуры на 10°С: Многие каталитические реакции не подчиняются этому правилу, для большинства из них у < 2. Почти все биохимические реакции осуществимы только в присутствии ферментов, следовательно, почти все они не подчиняются данному правилу. Кроме того, при увеличении температуры свыше определенного значения (45—50°С) биохимические реакции резко замедляются, а затем останавливаются, что связано с инактивацией ферментов при высоких температурах. Более точную зависимость скорости химической реакции от температуры устанавливает уравнение Аррениуса: Энергия активации реакции Ел— энергетический барьер, который должны преодолеть исходные вещества по пути превращения в продукты реакции. У г Согласно теории активных соударений химическая реакция происходит при каждом столкновении реагирующих частиц, соответствующим образом ориентированных относительно друг друга и обладающих энергией, равной (или больше) энергии активации. В теории активных соударений используются основные положения молекулярно-кинетической теории и предположения о существовании энергетического барьера, который должен быть преодолен в ходе химической реакции. В простейшем случае теория активных столкновений предполагает, что для осуществления реакции молекулы должны сблизиться на расстояние, равное полусумме их эффективных диаметров, учитывающих взаимодействие, при этом молекулы рассматриваются как жесткие сферы. Чтобы согласовать теоретическую зависимость (7.8) с экспериментальными данными, в уравнение вводят стерический фактор Р, который учитывает тот факт, что для осуществления реакции частицы в момент столкновения должны быть соответствующим образом ориентированы относительно друг друга. По этой причине выражение константы скорости записывают следующим образом: Доказательство в теории переходного состояния того факта, что скорость реакции зависит не только от энергии активации, но и от энтропии активации, позволяет объяснить различие в скоростях реакций с близкими величинами энергии активации. Скорость будет выше у той реакции, энтропия активации которой больше. | № 5.4 Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов. Уравнение Михаэлиса-Ментен и его анализ. Катализом называют явление изменения скорости химической реакции под воздействием катализаторов. Реакции, протекающие с участием катализаторов, называют каталитическими. Гомогенный – это такой катализ, когда катализатор и все реагирующие вещества находятся в одной фазе. Гомогенный катализ в растворах наиболее часто вызывается действием водородных и гидроксильных ионов. Каталитическое действие кислот было открыто в 1811 г. К. Кирхгофом. Инверсия сахара, омыление сложных эфиров, гидролитическое разложение амидов, ацеталей и много других реакций в растворах ускоряются действием водородных ионов, причем с повышением их концентрации примерно пропорционально увеличивается и скорость. Главным положением гомогенного катализа является представление о том, что в ходе реакции образуются неустойчивые промежуточные соединения катализатора с реагирующими веществами, которые затем распадаются с регенерацией катализатора К гомогенному катализу относятся многие реакции кислотно-основного взаимодействия, реакции комплексообразования, многочисленные реакции гидрирования, сульфидирования, реакции, катализированные ферментами. К гетерогенным относятся каталитические процессы, протекающие на границе раздела фаз Т-Г, Т-Ж. При гетерогенном катализе реакция протекает на поверхности катализатора. Поэтому площадь поверхностного слоя катализатора и его строение определяют активность катализатора. Гетерогенный катализ находит большее применение в промышленности, чем гомогенный. В качестве гетерогенных катализаторов используют переходные металлы, металлы первой группы, фосфорную кислоту. Чаще всего для анализа кинетических схем ферментативного катализа используют метод стационарных концентраций (k2 >> k1). Применение этого метода к простейшей схеме катализа дает уравнение Михаэлиса-Ментен: 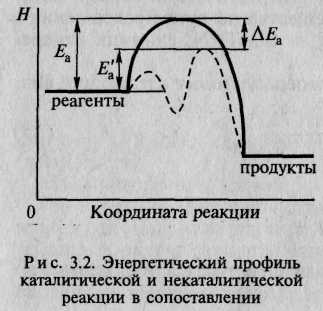 - константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM - от 10-6 до 10-1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 108 мин-1 - константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM - от 10-6 до 10-1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 108 мин-1Во многих случаях скорость реакции резко изменяется в присутствии специальных веществ - катализаторов. Катализаторы участвуют в реакции, но в результате ее не расходуются. Катализаторы биологических процессов, протекающих в живых организмах, представляют собой белковые молекулы, которые называют ферментами, или энзимами. |
| | ||
| | ||
| № 6.1 Понятие биогенности химических элементов. Биосфера, круговорот биогенных элементов. Кларки элементов. Концентрирование биогенных элементов живыми системами. Классификация биогенных элементов по их функциональной роли: органогены, элементы электролитного фона, микроэлементы. Понятие о примесных элементах (аккумулирующихся и неаккумулирующихся). Основные источники поступления примесных элементов в организм человека. Химические аспекты окружающей среды. Биогенные элементы – элементы, необходимые для построения и жизнедеятельности различных клеток и организмов. Биосфера – часть земной оболочки, занятая растительными и животными организмами. Среда, организованная определённым образом, переработанная живыми организмами и космическими излучениями и приспособленная к жизни (по В.И. Вернадскому) Кларки элементов - - числовые оценки средних содержаний химических элементов в земной коре, гидросфере, атмосфере, Земле в целом, различных типах горных пород, космических объектах и др. Кларк может быть выражен в единицах массы (%, г/т и др.) либо в атомных %. Термин "кларк" введен А.Е.Ферсманом, назван по имени Ф. У. Кларка. Биологическое концентрирование элемента – увеличенное содержание элемента в организме по сравнению с окружающей средой. Непропорциональное содержание элементов в организме и среде связано с тем, что усвоение элементов влияет растворимость их природных соединений в воде. Органогены – систем (C, Н, О, N, Р, S) только 6 элементов, составляющих основу живых. Они составляют в организме 97,4% Элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме. Микроэлементы – (I, Cu, As, F, Br, St, Ba, Co) их содержание в организме находится в пределах от 10-3 до 10-5 %. Примесные элементы - биологическая роль не выяснена до конца. Их делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F). | № 6.2 Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов IA- и ПА-групп (комплексообразование, образование осадков). Биологическая роль натрия, калия, кальция, магния. Химическое сходство и биологический антагонизм (натрий-калий, магний-кальций). К блоку S-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. Химические св-ва: s-элементы легко отдают валентные s-электроны, т.е. они представляют собой сильные восстановители. Они имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Как правило они образуют соединения с ионным типом связи, исключение – водород, для него характерна ковалентная связь Биологическая роль Na – содержание в организме массой 70 кг – 60 г. (2610 ммоль) – 0,08%. Около 40% натрия, содержащегося в костной ткани, участвует в обменных процессах и благодаря этому, скелет является либо донором, либо акцептором ионов Na, что способствует поддержанию постоянства концентрации ионов Na во внеклеточной жидкости. Натрий является основным внеклеточным ионом. В организм человека находится натрий в виде его растворимых солей главным образом хлорида, фосфата и водородкарбоната. Биологическая роль К – содержание в организме массой 70 кг составляет примерно 160 г (4090ммоль) – 0,23%. 98% находится внутри клеток. Антагонист Na. Играет важную роль в сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, отдельных реакциях. Биологический антагонизм. Натрий-калиевый градиент обуславливает возникновение разности потенциалов на клеточной мембране. За счёт энергии гидролиз 1 молекулы АТФ три иона Na+ выводятся из клетки, два иона К+ поступают внутрь клетки, что и служит причиной возникновения разности потенциалов. Биологическая роль Mg: его соединения участвуют в формировании костей, в регуляции работы нервной ткани, обмене веществ. Ежедневно человеку требуется примерено 300 – 400 мг Mg. От концентрации ионов Mg2+ зависит устойчивость рибосом Биологическая роль Ca: в организме человека в среднем около 1 кг. кальция. Входит в состав костной ткани в форме ортофосфата. Много в молоке и молочных продуктах. При его недостатке назначают соль глюконата кальция. Биологический антагонизм: наблюдается при сокращении мышцы. Ионы Ca2+ принимают участие в сокращении мышцы, а ионы Mg2+ принимают участие в расслаблении мышцы. Также, при длительном поступлении в организм избыточных количеств солей Mg наблюдается усиленное выделения Ca из костной ткани | № 6.3 Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока: остров биометаллов хром-медь, молибден. Окислительно-восстановительные свойства: закономерности устойчивости степеней окисления, неустойчивость некоторых степеней окисления из-за реакции соединений с водой (кобальт +3, хром +2): диспропорционирование промежуточных степеней окисления (марганец +3, +6). Устойчивость в условиях организма степени окисления. Образование комплексных соединений с органическими лигандами; гидроксокомплексы; амминокомплексы; образование нерастворимых соединений: гидроксиды, фосфаты, карбонаты, оксалаты. |
