№ 9.2 Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов. Диализ, электродиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки. Молекулярно-кинетические свойства коллоидно-дисперсных систем: броуновское движение, диффузия, осмотическое давление, седиментационное равновесие. Оптические свойства: рассеивание света (закон Рэлея). Электрокинетические свойства: электрофорез и электроосмос; потенциал течения и потенциал седиментации. Строение двойного электрического слоя.
Электрокинетический потенциал и его зависимость от различных факторов.
Учение о дисперсных структурах лежит в основе науки о материалах будущего, без которой невозможен технический прогресс. Коллоидная химия указывает рациональные пути разрушения нефтяных эмульсий (деэмульгирование сырых нефтей — основной способ их обезвоживания и обессоливания); создания дисперсных — наиболее эффективных — форм пестицидных препаратов, широко применяемых в сельском хозяйстве; использования поверхностно-активных веществ в составе моющих и очищающих средств, эмульгаторов, флоторсагентов, присадок к смазочным маслам и т.д.
Броуновское движение - беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием толчков со стороны молекул окружающей среды. Б. д. не ослабевает со временем и не зависит от химических свойств среды. Интенсивность Б. д. увеличивается с ростом температуры среды и с уменьшением её вязкости и размеров частиц.
Диффузия возникает не только при наличии в среде градиента концентрации (или химического потенциала). Под действием внешнего электрического поля происходит Д. заряженных частиц (электродиффузия), действие поля тяжести или давления вызывает бародиффузию, в неравномерно нагретой среде возникает термодиффузия.
Осмотическое давление (закон Вант-Гоффа) коллоидного раствора пропорционально числу частиц дисперсной фазы в единице объёма и абсолютной температуре. Осм. давл. Коллоидного раствора при прочих равных условиях обратно пропорционально кубу радиуса коллоидной частицы(когда в результате агрегации коллоидных частиц их размер возрастает, а частичная концентрация соответственно уменьшается + ускоряется оседание частиц.
Сегментационное равновесие: Оседание частиц дисп. Фазы под действием сил разной природы.Оседание происходит с постоянной скоростью, когда сила тяжести становится равной силе трения. Скорость оседания частиц под действием силы тяжести прямо пропоциональна квадрату радиуса частицы, разности плотностей дисп. Фазы и среды и обратно пропорциональна вязкости.
Закон Рэлея, - интенсивность I рассеиваемого средой света обратно пропорциональна 4-й степени длины волны падающего света (I -4) в случае, когда среда состоит из частиц-диэлектриков, размеры которых много меньше .
Электрофорез - перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля. Положительно заряженные гранулы под действием электрического поля перемещяются к котоду, а отрицательные противоионы диффузионного слоя – к аноду.
Электроосмос - перемещение дисперсионной среды относительно неподвижной десперсионной фазы под действием внешнего электрического поля. Под действием внешнего Эл. Поля положительно заряженные противоионы диффузионного слоя вмечте с гидратной оболочкой перемещяются к катоду.
Двойной электрический слой - два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз. Д. э. с. в целом электронейтрален. При пересечении Д. э. с. электрический потенциал изменяется скачком. Д. э. с. на поверхности металла возникает из-за того, что электроны металла несколько выходят за пределы решётки, образованной положительными ионами. Скачок потенциала в таком Д. э. с. является составной частью работы выхода электрона из металла.
Строение Д. э. с. оказывает большое влияние на электрические свойства межфазных границ и на протекающие на них процессы — прежде всего, на механизм и кинетику электрохимических реакций, на электрокинетические явления, на устойчивость коллоидных систем и т. п. Для исследования Д. э. с. используются методы измерения поверхностного натяжения и ёмкости, адсорбционные измерения и др.
|
№ 9.3 Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей. Коагуляция. Порог коагуляции и его определение. Правило Шульце-Гарди. Явление привыкания. Взаимная коагуляция. Понятие о современных теориях коагуляции. Коллоидная защита и пептизация.
Дисперсная система – система, состоящая из дисперсной фазы – совокупности раздробленных частиц и непрерывной дисперсионной среды, в которой во взвешенном состоянии находятся эти частицы.
Под устойчивостью дисперсных систем понимают способность их сохранять своё состояние и свойства неизменными с течением времени.
Седиментационная (кинетическая) устойчивость характеризует способность частиц дисперсной фазы оставаться во взвешенном состоянии.
При нарушении кинетической устойчивости происходит отделение дисперсной фазы от дисперсионной среды. Кинетическая устойчивость определяется размерами кинетически активных частиц и степенью дисперсности. Если размер частиц дисперсной фазы менее 1 мкм, то такая дисперсная система обладает высокой кинетической устойчивостью.
Причиной устойчивости взвешенного состояния коллоидных частиц является то, что частицы находятся в интенсивном броуновском движении, так как из-за их малого размера сила тяжести соизмерима с энергией теплового движения.
Агрегативная устойчивость дисперсной системы характеризует способность частиц дисперсной фазы противостоять их агрегации.
При нарушении этого вида устойчивости частицы дисперсной фазы объединяются в агрегаты, состоящие из первичных частиц, отделенных друг от друга ионными оболочками. При нарушении агрегативной устойчивости степень дисперсности остается неизменной.
Конденсационная устойчивость характеризует способность дисперсных систем сохранять неизменной с течением времени удельную поверхность.
Коагуляцией называется потеря коллоидными системами агрегативной устойчивости.
Коагуляция коллоидных растворов может быть вызвана воздействием различных факторов: концентрированием дисперсной фазы, диализом, механическим воздействием, изменением температуры, различными видами излучений, добавлением электролитов.
При коагуляции коллоидных растворов происходит изменение размеров и числа кинетически активных частиц. Процесс коагуляции можно разделить на две стадии: скрытую и явную.
Минимальная концентрация электролита, по достижении которой начинается коагуляция, называется порогом коагуляции Сп.
Коагуляция золей электролитами подчиняется правилу Шульце — Гарди: коагулирующая способность электролита возрастает с увеличением заряда коагулирующего иона, а коагулирующим действием обладает противоион — тот ион, который заряжен противоположно грануле.
Привыканиемназывается повышение устойчивости золя к коагулирующему действию электролита при уменьшении скорости его поступления.
При смешении двух коллоидных растворов с разноименно заряженными частицами нередко происходит образование осадка, называемое взаимной коагуляцией. Разноименно заряженные коллоиды вызывают коагуляцию друг друга только в том случае, когда суммарный заряд частиц одного золя нейтрализует суммарный заряд другого.
Теория коагуляции. Фрейндлих сформулировал основные положения адсорбционной теории коагуляции. Согласно этой теории коагулирующее действие электролита — следствие адсорбции ионов поверхностью агрегата. Поскольку коагулирующие ионы имеют заряд, противоположный потенциалопределяющим ионам, происходит нейтрализация заряда частиц, и устойчивость падает.
В настоящее время принята физическая теория коагуляции. Согласно теории - повышение концентрации электролита в дисперсионной среде приводит к уменьшению толщины диффузного слой. При достижении пороговой концентрации электролита толщина диффузного слоя уменьшается до таких размеров, на которых начинают действовать силы молекулярного притяжения. Вследствие этого происходит потеря агрегативной, а затем и кинетической устойчивости.
Пептизацией называют процесс перехода свежеполученного при коагуляции осадка в золь под действием веществ, называемых пептизаторами.
Пептизация представляет собой процесс, обратный коагуляции, происходящий в результате дезагрегации частиц осадка до отдельных коллоидных частиц.
Коллоидная защита. Нередко наблюдают повышение устойчивости лиофобных золей к коагулирующему действию электролитов при добавлении некоторых веществ. Такие вещества называют защитными, а их стабилизирующее действие на дисперсные системы — коллоидной защитой.
Защитными свойствами обладают высокомолекулярные соединения, как например, белковые вещества (желатин, альбумины), полисахариды (крахмал), некоторые кoллoидные ПАВ (мыла).
|
№ 9.4 Коллоидные ПАВ. Биологически важные коллоидные ПАВ (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах ПАВ. Определение критической концентрации мицеллообразования. Липосомы.
Коллоидными ПАВ называют вещества, которые с одним и тем же растворителем в зависимости от условий образуют истинный и коллоидный' раствор.
Для таких систем характерно существование динамического равновесия:
Истинный раствор = Коллоидный раствор
Как было уже сказано, молекулы ПАВ дифильны. Они состоят из неполярных и полярных группировок.
За счет гидрофобных взаимодействий углеводородных радикалов и взаимодействия полярных групп с водой образуются мицеллы. Ядро образовавшихся мицелл составляют неполярные радикалы, а внешнюю обкладку — полярные группы, что обеспечивает наименьший контакт гидрофобных групп с водой.
Минимальная концентрация коллоидного ПАВ, начиная с которой в его растворе происходит образование мицелл, получила название критической концентрации мицеллообразования (ККМ).
Форма образующихся мицелл зависит от концентрации раствора. При небольших концентрациях коллоидного ПАВ образуются сферические мицеллы. Повышение концентрации раствора коллоидного ПАВ приводит сначала к росту их числа, а затем и к изменению формы. При более высоких концентрациях вместо сферических мицелл образуются цилиндрические и пластинчатые.
Значение ККМ зависит от различных факторов: природы коллоидного ПАВ, температуры,присутствия примесей посторонних веществ, особенно электролитов. Установлено, что с ростом длины углеводородного радикала молекулы коллоидного ПАВ значение ККМ уменьшается. Понижение температуры также способствует уменьшению ККМ. Присутствие электролитов в растворе не оказывает существенного влияния на ККМ неионогенного коллоидного ПАВ.
ККМ можно определить по свойствам раствора, зависящим от числа и размеров кинетически активных частиц, в частности по изменениям осмотического давления, поверхностного натяжения электрической проводимости, оптических характеристик.
Липосомы - В системе вода — фосфолипид при встряхивании, перемешивании образуются сферические мицеллы — липосомы Молекулы фосфолипидов образуют в липосомах бислойную мембрану, в которой полярные группы обращены к воде, а неполярные — друг к другу. Липосомы можно рассматривать как модель биологических мембран. С их помощью можно изучать проницаемость мембран и влияние на нее разного рода факторов для различных соединений.
Липосомы широко используют для направленной доставки лекарственных веществ к зонам поражения.
Например, противоопухолевых препаратов для лечения опухолей, инсулина для лечения диабета. С помощью липосом можно транспортировать лекарственные вещества внутрь клеток. Липосомальные мембраны используют в иммунологических исследованиях при изучении взаимодействия между антителами и антигенами.
|
|
|
|
№ 9.5 Свойства растворов ВМС. Особенности растворения ВМС как следствие их структуры. Форма макромолекул. Механизм набухания и растворения ВМС. Зависимость величины набухания от различных факторов. Аномальная вязкость растворов ВМС. Уравнение Штаудингера. Вязкость крови и других биологических жидкостей. Осмотическое давление растворов биополимеров. Уравнение Галлера. Полиэлектролиты. Изоэлектрическая точка и методы ее определения. Мембранное равновесие Доннана. Онкотическое давление плазмы и сыворотки крови.
Биополимеры – природные высокомолекулярные соединения (ВМС).
Растворы ВМС характеризуются термодинамическими свойствами, это связано с гибкостью цепей макромолекул, большим числом конформаций. В растворах ВМС возможны процессы ассоциации макромолекул.
ВМС могут находиться в аморфном и кристаллическом состоянии.
Набухание и растворение ВМС. При контакте полимера (ВМС) и растворителя (НМС) происходит набухание и затем растворение полимера.
Набуханием называется проникновение растворителя в полимерное вещество, сопровождаемое увеличением объема и массы образца. Количественно набухание измеряется степенью набухания: ат = (m – m0)/m0 , где m0 — начальная масса; Vo— начальный объем образца полимера; т — масса; V— объем набухшего образца.
Степень набухания зависит от жесткости полимерных цепей. У жестких полимеров с большим числом поперечных связей между цепями степень набухания невелика. (Каучуки (резины) ограниченно набухают в бензине .Добавление бензола к натуральному каучуку приводит к неограниченному набуханию полимеров ).
Зависимость набухания от факторов:
Степень набухания полимера зависит от его природы и природы растворителя. Полимер набухает лучше в растворителе, молекулярные взаимодействия которого с макромолекулами велики. Полярные полимеры набухают в полярных жидкостях (белок в воде), неполярные — в неполярных (каучук в бензоле). Ограниченное набухание аналогично ограниченной растворимости. В результате образуются студни.
Кроме природы растворителя на набухание ВМС влияют присутствие электролитов, рН среды, температура.
Степень набухания уменьшается с увеличением жесткости кислот-катионов в ряду:Cs – Rb – K – Na – Li ; I – Br – Cl- F.
Вязкость (внутреннее трение) — мера сопротивления среды движению. Эту величину характеризуют коэффициентом вязкости η .
Ньютон для ламинарного (послойного) течения жидкости установил зависимость: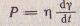 где Р- напряжение, Па; η— коэффициент динамической вязкости Па.с. dy/dt— скорость относительной деформации. где Р- напряжение, Па; η— коэффициент динамической вязкости Па.с. dy/dt— скорость относительной деформации.
Растворы полимеров не подчиняются закону Ньютона.
Для небольших интервалов концентраций существует простая зависимость
ηпр.= а + bс
где а, в — постоянные коэффициенты.
Величина а определяется экспериментально и называется характеристической вязкостью полимера.
Характеристическая вязкость связана с молярной массой полимера формулой Штаудингера:
 где К — коэффициент пропорциональности, а — показатель степени. где К — коэффициент пропорциональности, а — показатель степени.
Формула Штаудингера используется при экспериментальном измерении молекулярной массы ВМС.
Осмотическое давление л растворов ВМС определяется теоретически уравнением Вант-Гоффа π=cRT , где с — концентрация раствора.
Каждая макромолекула ведет себя как совокупность нескольких молекул меньшего размера. Это и проявляется в увеличении осмотического давления. Для расчета осмотического давления растворов ВМС Галлер предложил уравнение 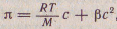 где с — концентрация раствора ВМС, г/л; М — молярная масса ВМС г/моль; β — коэффициент, учитывающий гибкость и форму макромолекулы в растворе. где с — концентрация раствора ВМС, г/л; М — молярная масса ВМС г/моль; β — коэффициент, учитывающий гибкость и форму макромолекулы в растворе.
Если звено полимерной цепи содержит ионогенную группу, то полимер называют полиэлектролитом. Они растворимы в полимерных растворителях, электропроводны, и на их свойствах сильно отражается кулоновское взаимодействие зарядов.
К классу синтетических полиэлектролитов, имеющих широкую область применения, относятся полиамфолиты. В сильнощелочных средах (высокие рН) молекулы полиамфолитов приобретают суммарный отрицательный заряд. При некотором промежуточном значении кислотности (3 < рН < < 11 для белков) суммарный заряд макромолекулы становится равным нулю. Это значение называется изоэлектрической точкойполиамфолита.
Изоэлектрическая точка может быть измерена однозначно с помощью электрофореза, может быть использованы данные по набуханию полиамфолитов в р-рах с разл.pH.
Онкотическое давление – часть осмотического давления крови π(ВМС), создаваемая в ней белками(альбумин, глобулин).
Мембранное равновесие Доннана – равенство электрохимических потенциалов частиц в левой и правой частях.
|
№ 9.6 Устойчивость растворов биополимеров. Высаливание биополимеров из раствора. Коацервация и ее роль в биологических системах. Застудневание растворов ВМС. Свойства студней: синерезис и тиксотропия.
Застудневание. В результате ограниченного набухания ВМС или частичного испарения растворителя из раствора ВМС образуются студни. Студень можно рассматривать как ограниченно набухший полимер или концентрированный раствор полимера.
Высаливание ВМС. Лиотропный ряд ионов, :Cs – Rb – K – Na – Li ; I – Br – Cl- F. характеризует влияние ионов на набухание
ВМС, имеет обратную последовательность по своему высаливающему действию.
Под высаливанием понимают выделение ВМС из раствора при введении ионов или неэлектролитов.
Наименьший высаливающий эффект будут проявлять мягкие основания-анионы I и NCS — слабо гидратирующиеся и хорошо адсорбирующиеся на молекулах ВМС.
Снижение устойчивости раствора ВМС наблюдается при уменьшении лиофильности полимера.
Коацервация. При нарушении устойчивости раствора ВМС возможно образование коацервата — новой жидкой фазы, обогащенной полимером. Коацерват может находиться в исходном растворе в виде капель или образовать сплошной слой.
Коацервация происходит при изменении температуры или состава раствора и обусловлена понижением взаимной растворимости компонентов раствора. Коацервацию используют при капсулировании лекарств.
Студни- это гомогенные системы. При старении гомогенность студней нарушается вследствие синерезиса— постепенного сжатия полимерной сетки (матрицы) и выделения жидкой фазы. Синерезис сопровождается уплотнением пространственной структурной сетки и уменьшением объема студня. Пример синерезиса — отделение сыворотки при свертывании крови.
В отличие от гелей студни не обладают тиксотропией— способностью восстанавливать свою структуру во времени после ее механического разрушения. В студнях, как и в растворах, могут протекать химические реакции. Скорость диффузии ионов и молекул в студнях зависит от концентрации студня.
|
№ 10.1 Титриметрический анализ. Химический эквивалент вещества. Молярная концентрация эквивалента вещества. Закон эквивалентов. Точка эквивалентности и способы ее фиксирования. Способы титрования: прямое, обратное, косвенное. Ацидиметрия и алкалиметрия: титранты, их стандартизация; индикаторы. Расчет массы и массовой доли определяемого вещества по данным титриметрического анализа. Использование титриметрических методов в медицине и в биологии.
Химические методы основаны на проведении реакций между изучаемым образцом и специально подобранными и приготовленными реактивами. По количеству затраченных реактивов или по количеству полученных продуктов реакции рассчитывают состав анализируемого образца.
Титриметрический анализ заключается в точном определении объема раствора химического реактива с известной концентрацией, который необходим для полного протекания реакции с данным объемом анализируемого раствора. Титриметрический анализ широко применяют в клинических и санитарно-гигиенических лабораториях для анализа крови, желудочного сока, мочи, пищевых продуктов, питьевых и сточных вод.
Физико-химические методы анализа основаны на количественном изучении зависимости состав — физические свойства объекта. Физико-химические методы анализа связаны с применением сложной и чувствительной аппаратуры. Достоинствами этих методов являются их объективность, возможность автоматизации и быстрота получения результатов, что дает существенное повышение производительности труда и расширяет возможности исследования.
Примером физико-химического метода анализа является потенциометрическое определение рН раствора с помощью измерительных приборов потенциометров.
В количественном анализе используют также различные оптические методы. Измеряют поглощение видимых, ультрафиолетовых, инфракрасных лучей, и по интенсивности поглощения определяют концентрацию соответствующего вещества.
Химический эквивалент вещества — реальная или условная частица вещества, обменивающая (присоединяющая) 1 однозарядный ион, или 1/2 двухзарядного иона, или 1/3 трехзарядного иона и т. д., или участвующая в переносе 1 электрона. Эквивалент обозначается формулой 1/z X, где 1/z — фактор эквивалентности, а число z равно суммарному
заряду ионов одного знака, обмениваемых структурной единицей вещества, или числу электронов, принимаемых или отдаваемых структурной единицей.
Смысл введения понятия эквивалент состоит в том, что, по определению, в реакции участвует равное число эквивалентов кислоты и основания, окислителя и восстановителя и т. д.
Закон эквивалентов - в химической р-ции участвует равное количество вещества эквивалента веществ: n(1/z1X1) = n(1/z2X2)
Молярная концентрация эквивалента в-ва с (моль/л) – отношение количества вещества к объему раствора С(1/zX) =n(1/zX)/V
Точка эквивалентности – состояние системы, в котором количество вещества эквивалента определяемого в-ва = количеству в-ва эквивалента реагента в добавленном объёме титранта. При достижении точки эквивалентности титрование заканчивают. Если точка эквивалентности достигнута, она обнаруживается резким изменением какого-либо св-ва раствора.(напр. окраска).
Способы титрования:
1. прямое титрование - к раствору определяемого вещества непосредственно добавляют титрант. При работе по этому методу для определения щелочи необходим стандартный раствор кислоты, для определения восстановителя — стандартный раствор окислителя и т. д.
2.обратное титрование - вещество сначала реагирует с точно известным количеством некоторого реагента, взятого в избытке. Не вступивший в реакцию избыток реагента титруют, и результатом титрования определяется количество реагента, прореагировавшего с анализируемым веществом.
3.заместительное(косвенное)титрование - проводят реакцию определяемого вещества с некоторым реагентом, взятым в не контролируемом избытке, и затем титруют продукт реакции, который «заместил» анализируемое вещество. Обычно это делают с целью применения хорошей титриметрической реакции. Расчеты в заместительном титровании проводят по обычной формуле закона эквивалентов.
Ацидиметрия – определение веществ(титрование) с применением стандартных растворов кислот. Можно определять основания и соли, вступающие в необратимое взаимодействие с сильными кислотами. Титрант - р-р HCl
Алкалиметрия - определение веществ(титрование) с применением стандартных растворов щелочей. Можно определять кислоты и гидролизующие соли. Титрант – р-р NaOH.
Стандартизация титранта – использование вспомогательного титрования, для определения точной концентрации титранта. Для р-ра HCl используют декагидрат карбоната Na. Для р-ра NaOH – дигидрат щавелевой к-ты.
Индикаторы - метилоранж(при титре слабого основания сильной кислотой),ф/ф(при титре слабой кислоты сильным основанием).
|
|
№ 10.2 Потенциометрия. Обратимые электроды первого и второго рода. Измерение электродных потенциалов. Электроды сравнения: водородный, хлорсеребряный. Ионоселективные электроды на основе твердых и жидких мембран; их использование для измерения концентрации ионов водорода (стеклянный электрод), калия, кальция, натрия в биожидкостях. Потенциометрическое титрование.
Потенциометрией называют совокупность физико-химических методов исследования, в основе которых лежит измерение электродвижущей силы цепей, составленных из индикаторного электрода и электрода сравнения.
Потенциометрические методы основаны на определении концентрации физиологич. активных ионов (Na,Ca,Cl,Br), измерении потенциалов электродов, явл-щихся функцией активности ионов в растворе. Поскольку измерить абсолютное значение потенциала отдельно взятого электрода невозможно, для практических целей измеряют разницу между потенциалом измерительного электрода, который зависит от активности определяемого электрода, и электрода сравнения, потенциал которого известен и постоянен. Наиб. употребимые электроды - каломельный и хлорсеребряный.
Основная задача – правильный выбор измерительного электрода, который отражает св-ва раствора. По механизму возникновения различают ионно-металлические электроды, редокс электроды, мембранные электроды.
Ионно-металлический электрод, представляющий собой металл, опущенный в раствор соли этого металла, функционирует как электрод первого рода, если его потенциал зависит от активности катиона в раствора. Если же металлический электрод покрыт электролитически нанесенным слоем малорастворимой соли этого металла, то он функционирует как электрод второго рода, т.к. отражает активность аниона, образующего эту малорастворимую соль.
В силу многих причин не все металлы могут быть использованы для изготовления электродов, измеряющих активность их катионов. В атом случае часто используются мембранные электроды, способные давать потенциалы, зависящие от активности ограниченного числа ионов, а в некоторых случаях - только одного типа ионов. Такие электроды называют ионоселективными электродами. Примером ионоселективного электрода является стеклянный электрод, потенциал которого зависит от активности ионов Н3О+.
Силикат натрия, входящий в состав стеклянной мембраны подвергается гидролизу до кремниевой кислоты. Протоны, возникающие при диссоциации кремниевой кислоты, способны к обмену о катионами, содержащимися в растворе, контактирующем с мембраной .При низких значениях рН, т.е. при большой концентрации ионов Н3О+, они переходят в состав мембраны, в результате чего возникает скачок потенциала на границе раздела стекло-раствор. При высоких значениях рН ионы Н3О+ наоборот переходят в раствор.
Потенциометрическое титрование – имеет ряд преимуществ: возможность титрования мутных и окрашенных биологич. жидкостей, легкость автоматизации анализа.
|
№ 10.3 Хроматография. Классификация хроматографических методов по доминирующему механизму разделения веществ. Идентификация веществ на хроматограммах и их количественное определение. Применение тонкослойной, бумажной, газо-жидкостной, высокоэффективной жидкостной, молекулярно-ситовой хроматографии в медико-биологических исследованиях.
Явление адсорбции лежит в основе такого ценного метода анализа, как адсорбционная хроматография.
Хроматография - физико-химический метод исследования, основанный на многократно повторяющихся процессах сорбции и десорбции между двумя фазами - подвижной и неподвижной. Хроматография - динамический метод, разделение веществ многокомпонентных смесей осуществляется за счет различия в скорости движения этих веществ относительно неподвижной фазы.
В основе хроматографического разделения лежат различные механизмы, как правило, дополняющие друг друга.
По доминирующему механизму различают:
1. адсорбционную хроматографию
2. распределительную хроматографию (разделение основано на разнице в коэффициентах распределения вещества между двумя несмешивающимися жидкостями);
3. ионообменную хроматографию (основана на различии в константах ионного обмена разделяемых ионов между раствором и ионитом.)
4. ситовую хроматографию (разделение веществ основано на разнице в размерах молекул, используют в основном для разделения белков на фракции);
5. хемосорбционную хроматографию. (осадочную, редокс-хроматографию, лигандообменную)
Во всех случаях разделение основано на различиях в константах равновесия соответствующих процессов: гетерогенного, окислительно- восстановительного, лигандообменного, образования фермент-субстратного комплекса.
В зависимости от агрегатного состояния подвижной фазы различают жидкостную и газовую хроматографию. По технике эксперимента хроматография может быть колоночной (разновидность - капиллярная хроматография) и плоскостной (тонкослойной - в тонком слое оксида алюминия и бумажной - на поверхности целлюлозы).
Хроматография все глубже проникает в медицину, т.к. во многих случаях является незаменимым инструментом при диагностике острых отравлений ( фосфорорганические препараты бытовой химии, наркотические средства, сильнодействующие лекарственные препараты, суррогаты этил. спирта ).
Для идентификации в-в на хроматограмме используется степень раэделения – величина Rf , представляющая собой отношение пути l(x), пройденного в-вом , к пути, пройденному растворителем l(P).
|
№ 10.4 Избранные методы анализа. Представления о применении в медицине и биологии эбулиометрии, криометрии, осмометрии, электрофореза, кондуктометрии, вискозиметрии.
Скорость движения частиц дисперсной фазы в электрическом поле (скорость электрофореза) рассчитывают по уравнению Гельмгольца — Смолуховского:
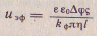 где uэф - скорость электрофореза, ε- относит. диэлектрич. проницаемость среды , где uэф - скорость электрофореза, ε- относит. диэлектрич. проницаемость среды ,
ε0- электрич.постоянная, Δφ- разность потенциалов от внешнего источника тока,
ς- электрокинетич. потенциал, 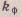 -коэф.,значение кот.зависит от формы коллоидн.частицы, -коэф.,значение кот.зависит от формы коллоидн.частицы,
η -вязкость дисперсной среды, l-расстояние между электродами.
Механизм электрофореза становится понятным при рассмотрении движения частиц дисперсной фазы. Положительно заряженные гранулы под действием электрического поля перемещаются к катоду, а отрицательные противоионы диффузионного слоя — к аноду. Качественно электрофорез аналогичен электролизу. Различие количественное: под действием электрического поля в первом случае движутся частицы, во втором — ионы, и на электродах выделяются существенно разные массы вещества.
С помощью электрофореза можно определить знак заряда частиц дисперсной фазы и числовое значение электрокинетического потенциала.
Используют в клинических исследованиях для диагностики многих заболеваний,для разделения аминок-т, нуклеин. к-т, антибтотиков, ферментов, антител, для определения чистоты белковых препаратов.
Кондуктометрия – физико-химический метод исследования различных с-м, основанный на измерении их электрической проводимости.
Этот метод используют для определения общего содержания и состояния электролитов в различных биологических объектах: плазме и сыворотке крови, желудочном соке, моче, тканевой жидкости, а также в водах минеральных источников и в продуктах питания. Кондуктометрическое титрование широко применяют для количественного определения кислот, оснований и солей в различных жидкостях, в том числе и биологического происхождения. Кондуктометрия является одним из наиболее точных методов измерения констант диссоциации физиологически важных электролитов, изоэлектрических точек аминокислот, пептидов и белков. Кондуктометрию применяют при изучении кинетики биохимических процессов, сопровождающихся изменением концентрации электролитов, для изучения проницаемости биологических мембран, для определения суммарного объема клеток в клеточных взвесях (например, объема эритроцитов в крови), для количественного измерения потоотделения.
Сущность всех кондуктометрических методов изучения различных свойств проводников сводится к измерению их сопротивления или электрической проводимости.
Криометрия – совокупность методов определения молекулярной массы неэлектролитов, степени диссоциации слабых электролитов и осмотического давления, основанных на измерении разности температур замерзания чистого растворителя и растворов используемых в-в (для анализа биологических жидкостей)
Осмометрия – совокупность методов и технических приемов измерения величины осмотического давления. Применяют для определения молекулярной массы биополимеров, при исследовании водно – солевого обмена.
Вискозиметрия – совокупность методов определения и измерения вязкости жидкостей, экспериментальные и диагностические исследования ( для определения вязкости крови или плазмы).
|
|
| |
 Скачать 0.82 Mb.
Скачать 0.82 Mb.