Аминокислоты. дз по уип. 1. Аминокислоты
 Скачать 270.81 Kb. Скачать 270.81 Kb.
|
|
1. Аминокислоты - органические соединения, в молекуле которых одновременно содержатся карбоксильные группы — СООН и аминогруппы — NH2. Аминокислоты могут рассматриваться как производные карбоновых кислот, в углеводородных радикалах которых один или несколько атомов водорода замещены на аминогруппы — NH2. Наибольшее значение имеют так называемые альфа-аминокислоты, в молекулах которых обе функциональные группы связаны с одним и тем же атомом углерода. Общая формула альфа-аминокислот имеет вид: H2N-(R)C(H)-COOH, где R— углеводородный радикал. В состав белков входят 20 альфа-аминокислот. Эти 20 аминокислот являются звеньями (мономерами), из которых построены белки. Аминокислоты различаются структурой боковых радикалов, которые имеют разные размеры, форму, реакционную способность, определяют растворимость аминокислот в водной среде и их электрический заряд. 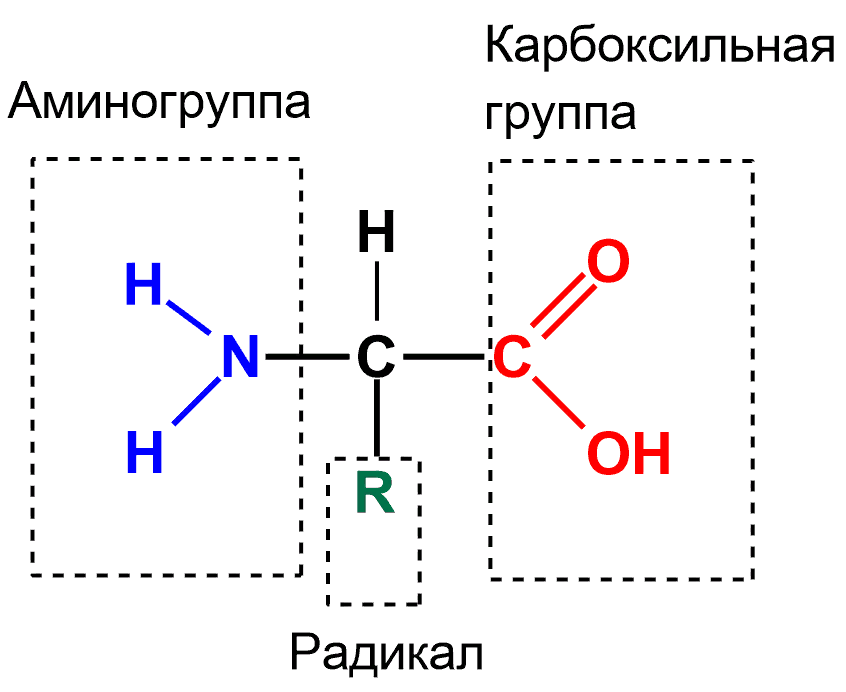 Физические свойства: Физические свойства:Аминокислоты являются твердыми кристаллическими веществами, которые хорошо растворяются в воде. Соединения могут обладать сладким вкусом, не иметь вкуса или горчить. Все вещества характеризуются температурой плавления более 22°С. Водный раствор аминокислот является проводником для электрического тока Аминокислоты являются амфотерными соединениями, поскольку их молекулы содержат две функциональные группы, отличающиеся характером кислотно-основных свойств: аминогруппа с основными свойствами; карбоксильная группа с кислотными свойствами. Водные растворы аминокислот обладают нейтральной, щелочной или кислой средой, исходя из числа функциональных групп. К примеру, глутаминовая кислота образует кислый раствор (две группы -СООН, одна-NH2), лизин — щелочной (одна группа -СООН, две-NH2). Аминокислоты взаимодействуют с металлами и щелочами, что приводит к образованию соли. 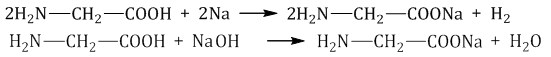 Соединения вступают в химическую реакцию с кислотами. Аминокислоты способны взаимодействовать с азотистой кислотой с выделением азота. Соединения вступают в химическую реакцию с аминами. При взаимодействии аминокислот друг с другом образуются пептиды. Химическая реакция между двумя α-аминокислотами приводит к образованию дипептида. Фрагменты молекул аминокислот, которые в определенном порядке образуют пептидную цепь, носят названия аминокислотных остатков. В данном случае, связь CO–NH называется пептидной связью. 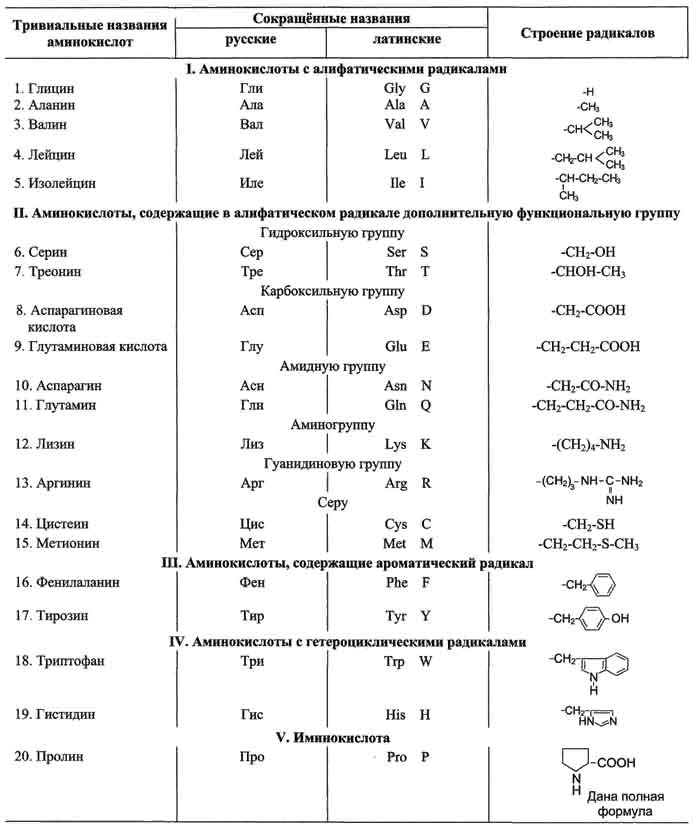 2. 3. При нейтральных значениях рН все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии. Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, - положительный заряд. Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд. Напротив, увеличение концентрации ОН-групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд. 4. Пептидная связь — это ковалентное химическое соединение между первым атомом углерода одной аминокислоты и атомом азота другой, возникающее в результате взаимодействия альфа-карбоксильной группы (COOH) с альфа-аминогруппой (NH 2). При этом происходит нуклеофильное замещение OH-гидроксила на аминогруппу, от которой отделяется водород. В итоге образуется одинарная C-N связь и молекула воды. Пептидная связь имеет характеристику частично двойной связи, мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу. Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами - строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот. 5. Первичная структура белков - это последовательность чередования аминокислотных остатков в полипептидной цепи. Первичная структура белков является ковалентной структурой, поскольку в её основе лежит пептидная связь между амино и карбоксильными группами аминокислот. Вследствие этого полипептидные цепи имеют неразветвленный характер. Первичная структура белков генетически детерминирована, т.е. последовательность аминокислот в белке определяется последовательностью нуклеотидов в ДНК. Для определения первичной структуры отдельной, химически гомогенной полипептидной цепи методом гидролиза выясняют аминокислотный состав: соотношение каждой из двадцати аминокислот в образце гомогенного полипептида. Затем приступают к определению химической природы концевых аминокислот полипептидной цепи, содержащей одну свободную NH2- группу и одну свободную СООН-группу. Для определения природы N-концевой аминокислоты предложен ряд методов, в частности, метод Сэнжера. Этот метод основан на реакции арилирования полипептида 2,4-динитрофторбензолом. Раствор полипептида обрабатывают 2,4-динитрофторбензолом, который взаимодействует со свободной α-аминогруппой пептида. После кислотного гидролиза продукта реакции только одна аминокислота оказывается связанной с реактивом в виде 2,4- динитрофениламинокислоты. В отличие от других аминокислот она имеет желтый цвет. Ее выделяют из гидролизата и идентифицируют методом хроматографии. Для определения С-концевой аминокислоты часто используют ферментативные методы. Обработка полипептида карбоксипептидазой, которая разрывает пептидную связь с того конца пептида, где содержится свободная СООН-группа, приводит к освобождению С-концевой аминокислоты, природа которой может быть идентифицирована методом хроматографии. Существуют и другие методы определения С-концевой аминокислоты, в частности, химический метод Акабори, основанный на гидразинолизе полипептида. Следующий этап работы связан с определением последовательности аминокислот в полипептиде. Для этого вначале проводят частичный (химический и ферментативный) гидролиз полипептидной цепи на короткие пептидные фрагменты, последовательность которых может быть точно определена. После гидролиза с помощью электрофореза и хроматографии составляют пептидные карты. Затем устанавливают последовательность аминокислот в выделенных пептидах и первичную структуру всей молекулы. 6. Вторичной структурой белка называют пространственное расположение полипептидной цепи белка на отдельных ее участках в виде спирали или слоя. Пептидные связи полипептидной цепи содержат группы С=О и N–H, способные образовывать внутримолекулярные водородные связи — основной тип нековалентных взаимодействий, стабилизирующий элементы вторичной структуры. Главную роль в стабилизации периодически повторяющихся элементов вторичной структуры белка играют водородные связи между пептидными группами (C=O…H–N). Основными элементами вторичной структуры, встречающимися в различных белках, являются альфа-спираль и бэтта-складчатый слой, хотя встречаются и другие элементы вторичной структуры. Альфа-спирали: При формировании альфа-спирали происходит закручивание скелета полипептидной цепи в виде спирали вокруг воображаемой оси, сопровождающееся сближением пептидных связей, что благоприятствует образованию внутримолекулярных водородных связей между NH-группами, находящимися на одном витке, и CO-группами, расположенными на другом витке спирали. Направление этих связей параллельно оси спирали. Боковые цепи аминокислот располагаются с наружной стороны спирали. В белках встречается только правозакрученная альфа-спираль. Альфа-спираль стабилизируется не только водородными связями, но и за счет взаимодействия боковых радикалов, располагающихся друг над другом в соседних витках спирали. Бета-слои: Второй элемент вторичной структуры, который часто встречается в белках, называется бета-слоем. Структура типа складчатого слоя формируется двумя параллельно или антипараллельно расположенными участками полипептидной цепи. Боковые цепи аминокислот располагаются перпендикулярно по отношению к плоскости остова цепи, который при этом изгибается, образуя плоский лист. Хотя водородные связи слабее ковалентных, присутствие их в значительном количестве делает структуры типа a-спирали или b-складчатого слоя достаточно прочными. Существуют два типа бета-слоев — параллельный и антипараллельный, в зависимости от того, меняется ли направление хода полипептидной цепи в каждом следующем фрагменте, участвующем в образовании слоя. 7. Альфа-cпиральные участки и бета-структуры типа складчатого слоя подвергаются дальнейшей упаковке, в результате чего формируется третичная структура белка. Растворимые белки обычно бывают глобулярными, то есть их молекулы имеют округлые или эллиптические очертания, хотя среди них встречаются и фибриллярные белки — имеющие форму волокна, или фибриллы, возможно также сочетание глобулярной и фибриллярной структур. В белковой глобуле заряженные и полярные аминокислотные остатки оказываются на поверхности, а гидрофобные — внутри. Бета-складчатые слои часто входят в состав сердцевины многих глобулярных белков. В упакованной в виде глобулы молекуле белка зачастую сближаются аминокислотные остатки, которые в полипептидной цепи расположены далеко друг от друга. Нерастворимые в воде белки часто бывают фибриллярными. 8. ДЕНАТУРАЦИЯ - это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза белковой молекулы длительным кипячением в растворе кислоты или щелочи. Физические факторы: 1. Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-500С. Такие белки называют термолабильными. Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными. 2. Ультрафиолетовое облучение 3. Рентгеновское и радиоактивное облучение 4. Ультразвук 5. Механическое воздействие (например, вибрация). Химические факторы:1. Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая). 2. Соли тяжелых металлов (например, CuSO4). 3. Органические растворители (этиловый спирт, ацетон) 4. Растительные алкалоиды. 5. Мочевина в высоких концентрациях 9. Многие белки состоят из нескольких полипептидных цепей одинаковой или различной структуры. Объединение белков становится возможным в том случае, если на поверхности белка образуется центр связывания для того же самого или другого белка. При объединении нескольких полипептидных цепей образуется белок, для которого характерна четвертичная структура. Такие белки называют олигомерами, а входящие в состав олигомера отдельные полипептидные цепи — мономерами. Отдельные глобулы или фибриллы взаимодействуют друг с другом с образованием комплексов, состоящих из нескольких молекул, что приводит к формированию четвертичной структуры. Сборка протомеров в олигомерный белок. Комплементарность протомеров: Присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом. Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены. Комплементарность - универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других молекул. |
