АМИНОКИСЛОТЫ БЕЛКОВ. Аминокислот и белков см по ссылке на pdf ниже
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
|
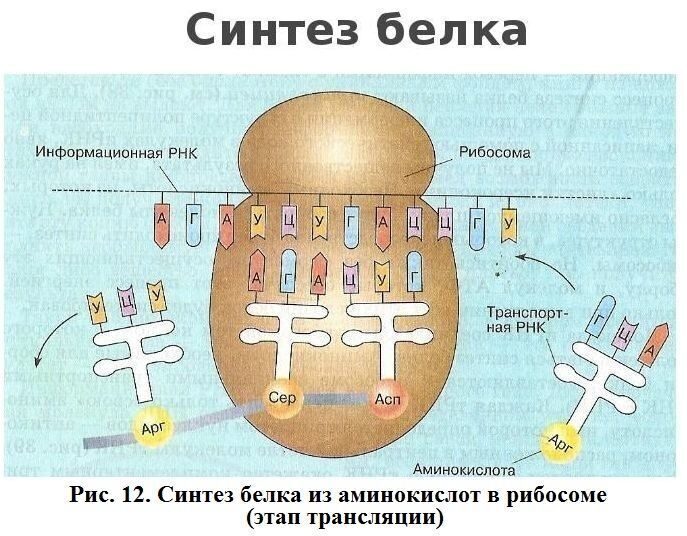
АМИНОКИСЛОТЫ БЕЛКОВ  Подробнее по теме аминокислот и белков см. по ссылке на PDF ниже: Подробнее по теме аминокислот и белков см. по ссылке на PDF ниже: Аминокислоты – (аминокарбоновые кислоты; амк) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы (аминогруппы). Т.е. аминокислоты могут рассматриваться , как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы. Карбоксильная группа (карбоксил) -СООН — функциональная одновалентная группа, входящая в состав карбоновых кислот и определяющая их кислотные свойства. Аминогруппа — функциональная химическая одновалентная группа -NH2, органический радикал, содержащий один атом азота и два атома водорода. Известно более 200 природных аминокислот, которые можно классифицировать по-разному. Структурная классификация исходит из положения функциональных групп на альфа-, бета-, гамма- или дельта- положении аминокислоты. Кроме этой классификации, существуют еще и другие, например, классификация по полярности, рН уровню, а также типу группы боковой цепи (алифатические, ациклические, ароматические аминокислоты, аминокислоты, содержащие гидроксил или серу, и т.д.). В виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе. ОБЩАЯ СТРУКТУРА АМИНОКИСЛОТ. АЛЬФА АМИНОКИСЛОТЫ. ИЗОМЕРИЗАЦИЯ АМИНОКИСЛОТ. Аминокислоты – биологически важные органические соединения, состоящие из аминогруппы (-NH2) и карбоновой кислоты (-СООН), и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод, водород, кислород и азот. Прочие элементы находятся в боковой цепи определенных аминокислот. 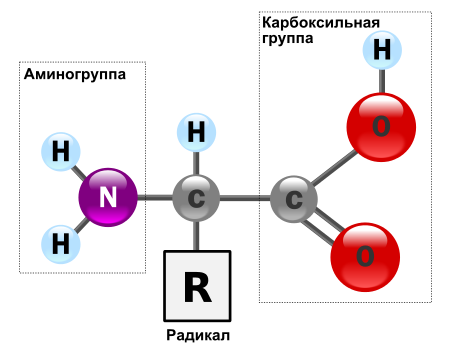 Рис. 1 - Общая структура α-аминокислот, составляющих белки (кроме пролина). Составные части молекулы аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре). В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. Атом углерода, находящийся рядом с карбоксильной группой, называется альфа-углерод, и аминокислоты, боковая цепь которых связана с этим атомом, называются альфа-аминокислотами. Они представляют собой наиболее распространенную в природе форму аминокислот. У альфа-аминокислот, за исключением глицина, альфа-углерод является хиральным атомом углерода. У аминокислот, углеродные цепи которых присоединяются к альфа-углероду (как, например, Лизин (L-лизин)), углероды обозначаются как альфа, бета, гамма, дельта, и так далее. У некоторых аминокислот аминогруппа прикреплена к бета или гамма-углероду, и поэтому они называются бета- или гамма- аминокислоты. По свойствам боковых цепей аминокислоты подразделяются на четыре группы. Боковая цепь может делать аминокислоту слабой кислотой, слабым основанием, или эмульсоидом (если боковая цепь является полярной), или гидрофобным, плохо впитывающим воду, веществом (если боковая цепь неполярна). Термин «аминокислота с разветвленной цепью» относится к аминокислотам, имеющим алифатические нелинейные боковые цепи, это Лейцин, Изолейцин и Валин.  Пролин – единственная протеиногенная аминокислота, боковая группа которой прикреплена к альфа-аминогруппе и, таким образом, также является единственной протеиногенной аминокислотой, содержащей на этом положении вторичный амин. С химической точки зрения, пролин, таким образом, является иминокислотой, поскольку в нем отсутствует первичная аминогруппа, хотя в текущей биохимической номенклатуре он все еще классифицируется как аминокислота, а также «N-алкилированная альфа-аминокислота» (Иминокислоты — карбоновые кислоты, содержащие иминогруппу (NH). Входят в состав белков, их обмен тесно связан с обменом аминокислот. По своим свойствам иминокислоты близки к аминокислотам, и в результате каталитического гидрирования иминокислоты превращаются в аминокислоты. Иминогруппа — молекулярная группа NH. Двухвалентна. Содержится во вторичных аминах и пептидах. В свободном виде двухвалентный радикал аммиака не существует). АЛЬФА-АМИНОКИСЛОТЫ Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота» относится именно к ним. Это 22 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров). 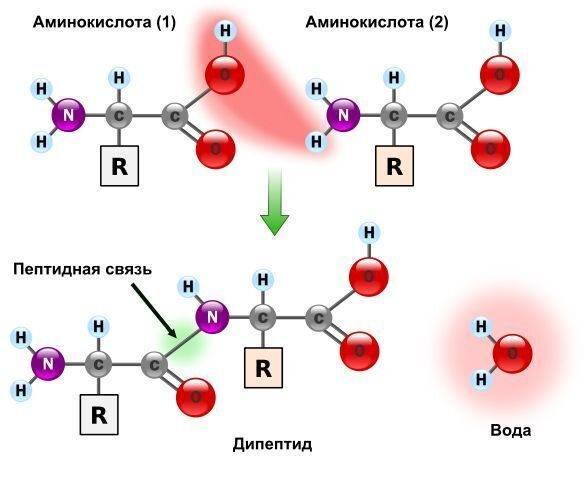 Рис. 2. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R. ОПТИЧЕСКАЯ ИЗОМЕРИЯ АМИНОКИСЛОТ 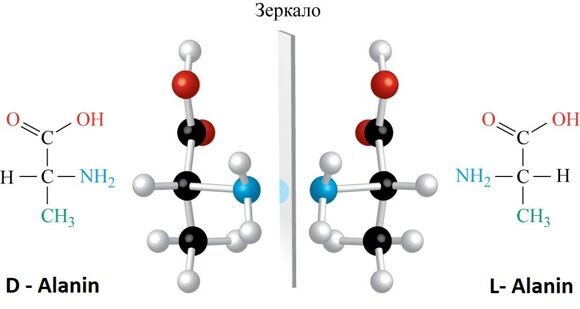 Рис. 3. Оптические изомеры аминокислоты аланина В зависимости от положения аминогруппы относительно 2-го атома углерода выделяют α-, β-, γ- и другие аминокислоты. Для организма млекопитающих наиболее характерны α-аминокислоты. Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах. Все стандартные альфа-аминокислоты, кроме глицина, могут существовать в форме одной из двух энантиомеров, называемых L или D аминокислоты, представляющих собой зеркальные отображения друг друга. D, L -Система обозначения стереоизомеров.  По этой системе L-конфигурация приписывается стереозомеру, у которого в проекции Фишера реперная группа находится слева от вертикальной линии (от лат. "laevus" - левый). Надо помнить, что в проекции Фишера вверху располагают наиболее окисленный атом углерода (как правило, этот атом входит в состав карбоксильной СОOН или карбонильной СН=О групп.). Кроме того, в проекции Фишера все горизонтальные связи направлены в сторону наблюдателя, а вертикальные — удалены от наблюдателя. Соответственно, если реперная группарасположена в проекции Фишера справа, стереоизомер имеет D - конфигурацию (от лат. "dexter" - правый). В α-аминокислотах реперными группами служат группы NH2. Энантиомеры — пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве. Классической иллюстрацией двух энантиомеров могут служить правая и левая ладони: они имеют одинаковое строение, но различную пространственную ориентацию. Существование энантиомерных форм связано с наличием у молекулы хиральности — свойства не совмещаться в пространстве со своим зеркальным отражением. Аминокислоты являются примерами хиральных молекул. Энантиомеры идентичны по физическим свойствам. Они могут быть различены лишь при взаимодействии с хиральной средой, например, световым излучением. Энантиомеры одинаково ведут себя в химических реакциях с ахиральными реагентами в ахиральной среде. Однако, если реагент, катализатор либо растворитель хиральны, реакционная способность энантиомеров, как правило, различается. Большинство хиральных природных соединений (аминокислоты, моносахариды) существует в виде 1 энантиомера. Понятие энантиомерии важно в фармацевтике, т.к. различные энантиомеры лекарств, имеют различную биологическую активность. БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ СТАНДАРТНЫЕ АМИНОКИСЛОТЫ (протеиногенные) См. к теме: Иллюстрации и видео и Строение протеиногенных аминокислот В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом (см. рис. 4). Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. Прим.: В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин и пирролизин. Это так называемые 21-я и 22-я аминокислоты. Аминокислоты являются структурными соединениями (мономерами), из которых состоят белки. Они объединяются между собой, формируя короткие полимерные цепи, называемые пептидами длинной цепи, полипептидами или белками. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединяется к двум соседним аминокислотам. 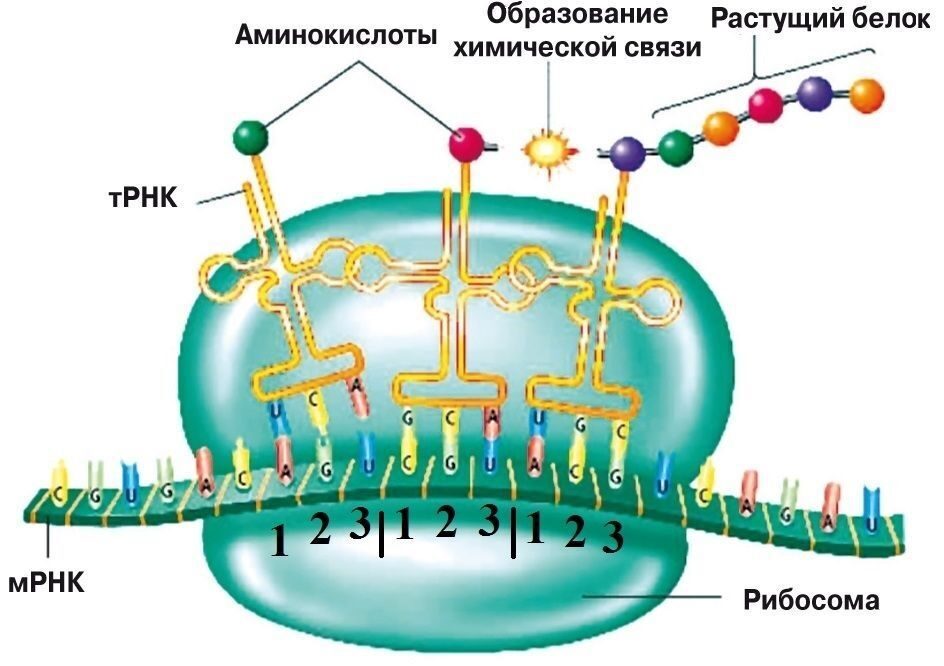 Рис. 5. Рибосома в процессе трансляции (синтеза белка) Процесс построения белка называется трансляцией и включает в себя пошаговое добавление аминокислот к растущей цепи белка через рибозимы, осуществляемый рибосомой. Порядок, в котором добавляются аминокислоты, считывается в генетическом коде с помощью шаблона мРНК, который представляет собой копию РНК одного из генов организма. Трансляция - биосинтез белка на рибосоме  Рис. 6 Стадии элонгации полипептида. Двадцать две аминокислоты естественно включены в полипептиды и называются протеиногенными, или природными, аминокислотами. Из них 20 кодируются с помощью универсального генетического кода. Оставшиеся 2, селеноцистеин и пирролизин, включаются в белки при помощи уникального синтетического механизма. Селеноцистеин образуется, когда транслируемый мРНК включает SECIS элемент, вызывающий кодон UGA вместо стоп-кодона. Пирролизин используется некоторыми метаногенными археями в составе ферментов, необходимых для производства метана. Он кодируется с кодоном UAG, который в других организмах обычно играет роль стоп-кодона. За кодоном UAG следует PYLIS последовательность. 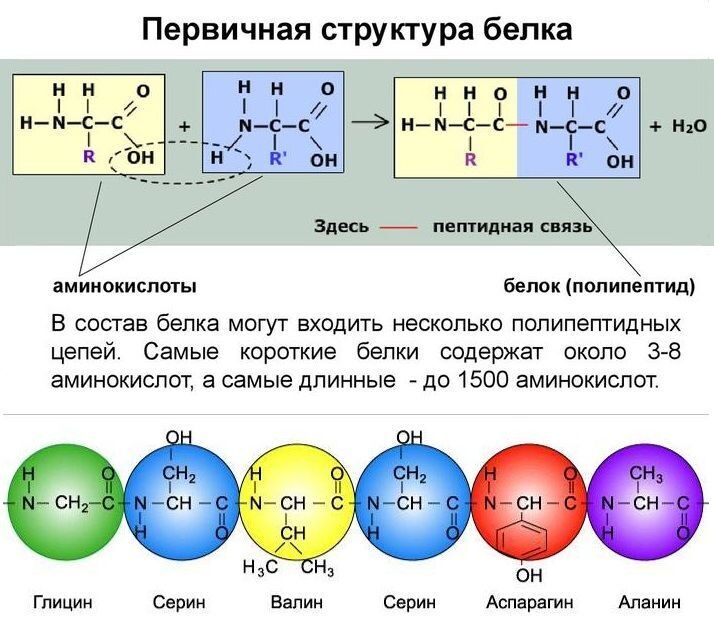 Рис. 7. Полипептидная цепь - первичная структура белка. Белки имеют 4 уровня своей структурной организации: первичная, вторичная, третичная и четвертичная. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями.Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.  Рис. 8. Структурная организация белков НЕСТАНДАРТНЫЕ АМИНОКИСЛОТЫ (Не-протеиногенные) Помимо стандартных аминокислот существует множество других аминокислот, которые называются не-протеиногенными или нестандартными. Такие аминокислоты либо не встречаются в белках (например, L-карнитин, ГАМК), либо не производятся непосредственно в изоляции при помощи стандартных клеточных механизмов (например, оксипролин и селенометионин). Нестандартные аминокислоты, находящиеся в белках, образуются путем пост-трансляционной модификации, то есть модификацией после трансляции в процессе синтеза белка. Эти модификации часто необходимы для функционирования или регуляции белка; например, карбоксилирование глутамата позволяет улучшить связывание ионов кальция, а гидроксилирование пролина важно для поддержания соединительной ткани. Другой пример – формирование гипузина в фактор инициации трансляции EIF5A посредством модификации остатка лизина. Такие модификации могут также определять локализацию белка, например, добавление длинных гидрофобных групп может вызвать связывание белка с фосфолипидной мембраной. Некоторые нестандартные аминокислоты не встречаются в белках. Это лантионин, 2-аминоизомасляная кислота, дегидроаланин и гамма-аминомасляная кислота. Нестандартные аминокислоты часто встречаются в качестве промежуточных метаболических путей для стандартных аминокислот - например, орнитин и цитруллин встречаются в орнитиновом цикле как часть катаболизма кислоты. Редкое исключение доминированию альфа-аминокислоты в биологии - бета-аминокислота Бета-аланин (3-аминопропановая кислота), которая используется для синтеза пантотеновой кислоты (витамина B5), компонента коэнзима А у растений и микроорганизмов. Ее, в частности, продуцируют пропионовокислые бактериии. ФУНКЦИИ АМИНОКИСЛОТ БЕЛКОВЫЕ И НЕ БЕЛКОВЫЕ ФУНКЦИИ Многие протеиногенные и непротеиногенные аминокислоты также играют важную, не связанную с образованием белка, роль в организме. Например, в головном мозге человека глутамат (стандартная глутаминовая кислота) и гамма-аминомасляная кислота (ГАМК, нестандартная гамма-аминокислота), являются основными возбуждающими и тормозящими нейромедиаторами. Гидроксипролин (основной компонент соединительной ткани коллагена) синтезируют из пролина; стандартная аминокислота глицин используется для синтеза порфиринов, используемых в эритроцитах. Нестандартный карнитин используется для транспорта липидов. Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов. 1. АМИНОКИСЛОТЫ, БЕЛКИ И ПИТАНИЕ О биологической роли и последствиях дефицита аминокислот в организме человека см. информацию в таблицах незаменимых и заменимых аминокислот. При введении в организм человека с пищей, 20 стандартных аминокислот либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза. Из 20 стандартных аминокислот, 8 (валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин) называют незаменимыми потому, что человеческий организм не может синтезировать их самостоятельно из других соединений в необходимых для нормального роста количествах, их можно получить только с пищей. Однако по современным представлениям Гистидин и Аргинин также являются незаменимыми аминокислотами для детей. Другие могут быть условно незаменимы для людей определенного возраста или людей, имеющих какие-либо заболевания. Кроме того, Цистеин, Таурин, L-Тирозин считаются полузаменимыми аминокислотами у детей (хотя таурин технически не является аминокислотой), потому что метаболические пути, которые синтезируют эти аминокислоты, у детей еще не полностью развиты. Необходимые количества аминокислот также зависят от возраста и здоровья человека, поэтому довольно сложно давать здесь общие диетические рекомендации. БЕЛКИ Белки́(протеины, полипептиды) —высокомолекулярныеорганические вещества, состоящие из альфа-аминокислот, соединённых в цепочкупептидной связью. В живых организмах аминокислотный состав белков определяетсягенетическим кодом, при синтезе в большинстве случаев используются 20 стандартных аминокислот. 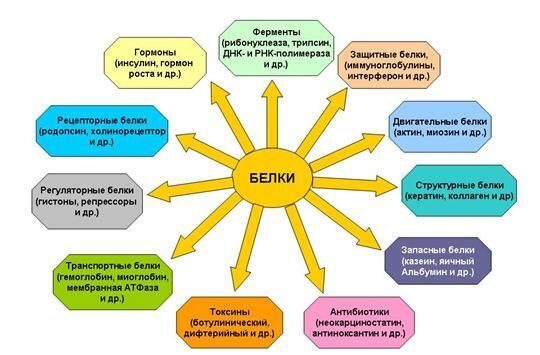 Рис. 9. Белки не только пища... Типы белковых соединений. Каждый живой организм состоит из белков. Различные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит белков в организме опасен для здоровья. Каждый белок уникален и существует для специальных целей. ПИТАНИЕ И БЕЛКИ  Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Стоит подчеркнть, что современная наука о питании утверждает, что белок должен удовлетворять потребности организма в аминокислотах не только по количеству. Данные вещества должны поступать в организм человека в определенных соотношениях между собой. Процесс синтеза белков идет в организме постоянно. Если хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным нарушениям здоровья - от расстройств пищеварения до депрессии и замедления роста у детей. Разумеется, данное рассмотрение вопроса весьма упрощенное, т.к. функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Также, кроме белков, из аминокислот образуется большое количество веществ небелковой природы (см. ниже), выполняющих специальные функции. К ним, напроимер, относится холин (витаминоподобное вещество, входящее в состав фосфолипидов и являющееся предшественником нейромедиатора ацетилхолина - Нейромедиаторы - это химические вещества, передающие нервный импульс с одной нервной клетки на другую. Таким образом, некоторые аминокислоты крайне необходимы для нормальной работы головного мозга). 2. НЕБЕЛКОВЫЕ ФУНКЦИИ АМИНОКИСЛОТ Нейромедиатор аминокислоты  Прим.: Нейромедиаторы (нейротрансмиттеры, посредники) — биологически активные химические вещества, посредством которых осуществляется передача электрохимического импульса от нервной клетки через синаптическое пространство между нейронами, а также, например, от нейронов к мышечной ткани или железистым клеткам. Для получения информации от собственных тканей и органов организм человека синтезирует особые химические вещества – нейромедиаторы. Все внутренние ткани и органы тела человека, «подчиненные» вегетативной нервной системе (ВНС), снабжены нервами (иннервированы), т. е. функциями организма управляют нервные клетки. Они как датчики собирают информацию о состоянии организма и передают ее в соответствующие центры, а от них корректирующие воздействия идут к периферии. Любое нарушение вегетативной регуляции приводит к сбоям в работе внутренних органов. Передача информации, или управление, осуществляется с помощью специальных химических веществ-посредников, которые называются медиаторами (от лат. mediator – посредник) или нейромедиаторами. По своей химической природе медиаторы относятся к различным группам: биогенным аминам, аминокислотам, нейропептидам и т. д. В настоящее время изучено более 50 соединений, относящихся к медиаторам. В организме человека многие аминокислоты используются для синтеза других молекул, например: Триптофан является предшественником нейромедиатора серотонина. L-Тирозин и его предшественник фенилаланин являются предшественниками нейромедиаторов дофамина катехоламинов, адреналина и норадреналина. Глицин является предшественником порфиринов, таких как гем. Аргинин является предшественником оксида азота. Орнитин и S-аденозилметионин являются предшественниками полиаминов. Аспартат, Глицин и глутамин являются предшественниками нуклеотидов. Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот. Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, канаванин является аналогом аргинина, который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей. КЛАССИФИКАЦИЯ ПРОТЕИНОГЕННЫХ АМИНОКИСЛОТ Рассмотрим классификацию на примере 20 протеиногенных α-аминокислот, необходимых для синтеза белка Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения (см. рис. полипептидной цепи вверху страницы). Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты. 1. ПО СТРОЕНИЮ БОКОВОГО РАДИКАЛА ВЫДЕЛЯЮТ: алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин) — соединения, не содержащие ароматических связей. ароматические (фенилаланин, тирозин, триптофан)
серусодержащие (цистеин, метионин), содержащие атом серы S содержащие ОН-группу (серин, треонин, опять тирозин), содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты), дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин). 2. ПО ПОЛЯРНОСТИ БОКОВОГО РАДИКАЛА Существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные). 3. ПО КИСЛОТНО-ОСНОВНЫМ СВОЙСТВАМ По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты. 4. ПО НЕЗАМЕНИМОСТИ По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей. Таблица 1. Классификация аминокислот
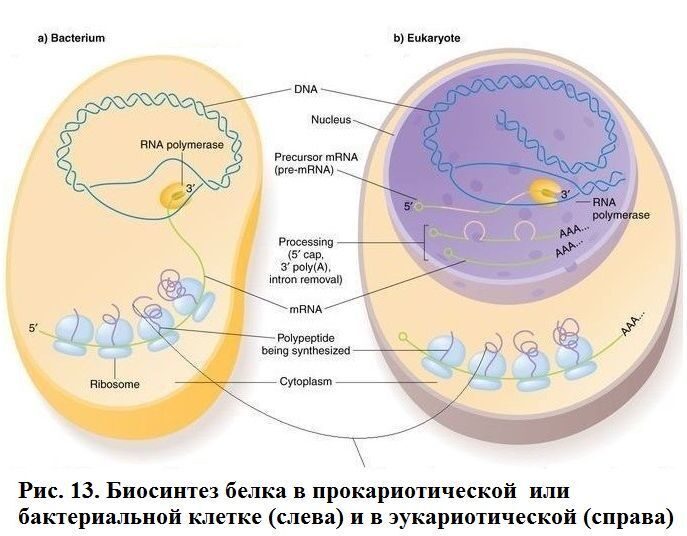
ИЛЛЮСТРАЦИИ И ВИДЕО СИНТЕЗ БЕЛКА ИЗ АМИНОКИСЛОТ 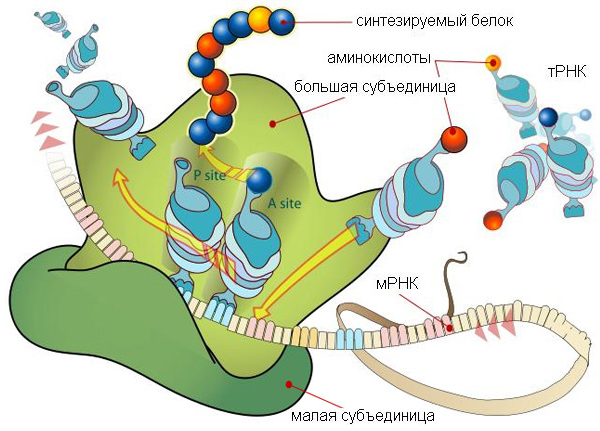 Рисунок 10. Рибосома в процессе синтеза белка или трансляции (трансляция - это синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК)) Рибосома — это важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром от 15—20 нанометров у бактерий (до 25—30 нанометров у эукариот), состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой (информационной) матричной РНК, или мРНК. Этот процесс называется трансляцией. Прим.: У этой красивой схемы вверху есть один недостаток (рисунок рибосомы был взят ранее из википедии): непонятно, что имел в виду художник, изображая на мРНК между тройками нуклеотидов (триплетами), кодирующими аминокислоту, какие-то вставки, состоящие как будто из двух нуклеотидов. В действительности триплеты в мРНК идут подряд, без промежутков. КАК ГЕНОМ РАБОТАЕТ НАД СОЗДАНИЕМ БЕЛКА ГЕНОМ — совокупность наследственного материала, заключенного в клетке организма. Геном содержит биологическую информацию, необходимую для построения и поддержания организма. ТРАНСКРИПЦИЯ - процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК 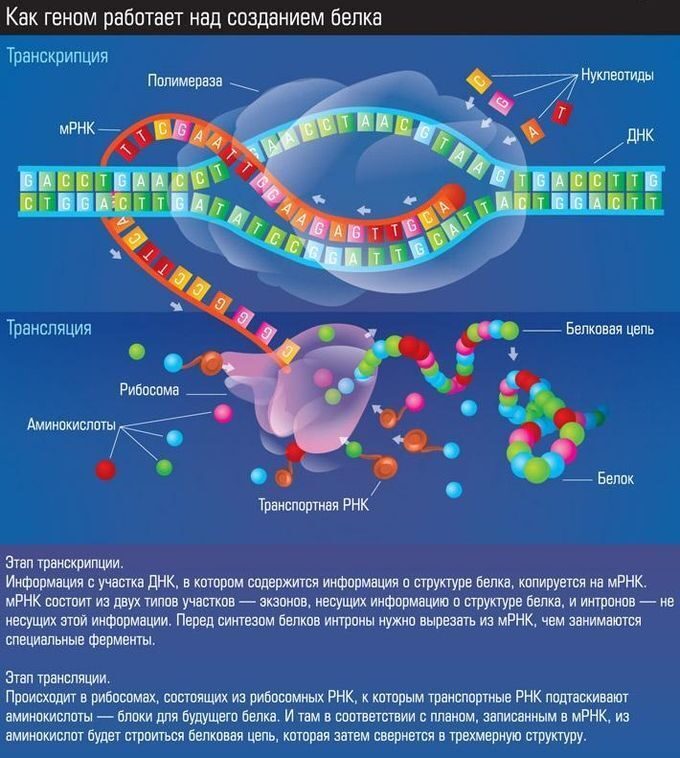 Рис. 11. Геном работает над созданием белка
Видео по теме СИНТЕЗ БЕЛКА ИЗ АМИНОКИСЛОТ (Примечание: в ролике показан общий принцип синтеза белка из аминокислот на рибосомах в клетках. Более подробно о кодировке белка см. в видео по теме ДНК) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||