фармация. задача 1. Пример ответа на билет 1 Тестовый контроль в компьютерном классе (20 тестовых заданий 20 баллов)
 Скачать 105.5 Kb. Скачать 105.5 Kb.
|
|
ПРИМЕР ОТВЕТА НА БИЛЕТ №1 1. Тестовый контроль в компьютерном классе (20 тестовых заданий – 20 баллов).
2. Гидролиз соли, образованной слабой одноосновной кислотой и сильным основанием. Расчет константы гидролиза, рН и степени гидролиза этой соли. (10 баллов) Ответ. Обозначим соль МВ. Соль в воде распадается на катион и анион, при этом анион будет взаимодействовать с водой, т.е. подвергаться гидролизу: MB = M+ + B B + H2O = HB + OH Константа равновесия этой реакции называется константой гидролиза соли: [HB][OH] Kh = [B] Умножим числитель и знаменатель на [H+], тогда [HB][OH][H+] Kw Kh = Kh = [B][H+] Kк-ты Таким образом, численное значение Kh можно найти, зная константу автопротолиза воды (Kw) и константу ионизации образующейся слабой кислоты (Kк-ты). Пусть общая концентрация соли равна Cсоли моль/л, тогда равновесные концентрации будут равны: [HB] = [OH] [B] = Cсоли [OH] Отсюда можно записать: [HB][OH] Kw Kh = = [B] Kк-ты [OH]2 Kw = Cсоли [OH] Kк-ты При степени гидролиза соли h5% концентрацией [OH] в знаменателе можно пренебречь. Следовательно, можно записать: [OH]2 Kw = Cсоли Kк-ты Найдем [OH]: [OH] = Пролагорифмируем: рОН = ½(14 pKк-ты lgCсоли ) = 7 ½ pKк-ты ½ lgCсоли т.к. рН + рОН = 14, расчетная формула рН раствора соли, образованной сильным основанием и слабой кислотой будет иметь вид: рН = 7 + ½ pKк-ты + ½ lgCсоли Степень гидролиза может быть найдена из следующего выражения: Cгидр [OH] h = = Cсоли Cсоли Подставляя вместо [OH] выражение (1) и вводя под корень Cсоли, получим расчетную формулу степени гидролиза соли: h = 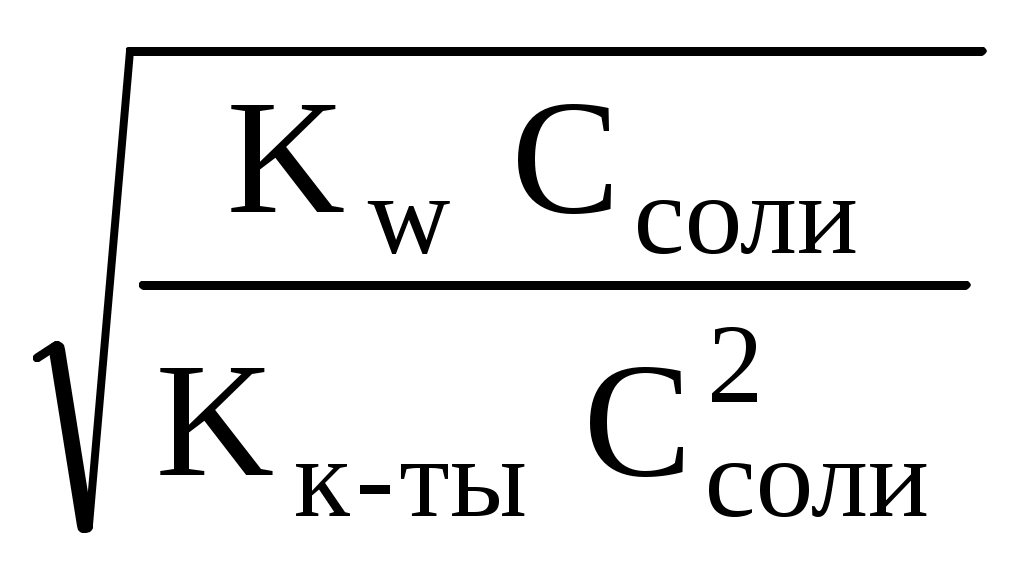 = = 3. Рассчитайте активную концентрацию сульфат-ионов в растворе, в 250 мл которого содержится 0,1462 г хлорида натрия, 0,0678 г фосфорной кислоты и 0,1776 г сульфата натрия. (10 баллов) Решение. Для расчета активной концентрации сульфат-ионов необходимо знать ионную сиу раствора и коэффициент активности сульфат-ионов. Рассчитаем ионную силу раствора. Фосфорная кислота является слабым электролитом, её вклад в ионную силу невелик, поэтом ей пренебрегаем. Найдем молярную концентрацию хлорида натрия и сульфата натрия: 0,1462 0,1776 С(NaCl) = = 0,01 (моль/л) С(Na2SO4) = = 0,005 (моль/л). 58,44 0,25 142,04 0,25 где 58,44 и 142,04 – молярные массы натрия хлорида и натрия сульфата, соответственно (периодическая система элементов Д.И. Менделеева выдается на экзамене). Тогда: NaCl Na+ + Cl 0,01 0,01 0,01 Na2SO4 Na+ + SO42 0,005 0,01 0,005 Таким образом, суммарная концентрация ионов натрия составляет 0,02 моль/л, хлорид-ионов – 0,01 моль/л и сульфат-ионов 0,005 моль/л. Рассчитаем ионную силу раствора: I = 0,5(0,0212 + 0,0112 + 0,00522) = 0,025 моль/л. По таблице (выдается на экзамене) находим коэффициент активности сульфат-ионов для ионной силы 0,025 моль/л – 0,545. Тогда активная концентрация сульфат-ионов будет равна: а(SO42) = 0,545 0,005 = 0,0027 моль/л. Ответ: 0,0027 моль/л. 4. Фармакопейные реакции на ионы калия и тиосульфат-ионы (10 баллов) Ответ. Фармакопейные реакции на ионы калия: 1. Реакция с гидротартратом натрия: KCI + NaHC4H4O6 KHC4H4O6 + NaCI белый 2. Реакция с гексанитрокобальтатом(III) натрия: 2KCI + Na3[Co(NO2)6] K2Na[Co(NO2)6] + 2NaCI желтый 3. Проба на окрашивание пламени: соли калия окрашивают пламя в фиолетовый цвет, а при рассматривании через синее стекло – в пурпурно-красный. Фармакопейные реакции на тиосульфат-ионы: 1. Реакция с сильными минеральными кислотами: Na2S2O3 + 2HCl SO2 + S + H2O + 2NaCl желтый 2. Реакция с нитратом серебра: 2AgNO3 + Na2S2O3 Ag2S2O3 + 2NaNO3 белый Белый осадок тиосульфата серебра быстро разлагается до черного сульфида серебра(I): Ag2S2O3 + H2O Ag2S + H2SO4 белый черный 5. Классификация растворителей, применяемых в неводном титровании. Их влияние на силу растворенных в них кислот и оснований. (10 баллов) Ответ. По способности отдавать или присоединять протоны (в рамках протолитической теории Брёнстеда-Лоури) растворители подразделяют: 1. Апротонные: бензол, толуол, гексан, CCl4, хлороформ и др., которые мало влияют на кислотно-основные свойства растворенных в них веществ 2. Протонные или протолитические, которые в свою очередь подразделяют на протогенные, протофильные и амфипротные. Протогенные растворители – растворители с выраженными протонодонорными свойствами: ледяная (безводная) уксусная кислота, муравьиная кислота, Н2SO4 безводная, уксусный ангидрид, нитрометан. Протогенные растворители повышают силу растворенных в них оснований и понижают силу растворенных в них кислот. Протофильные растворители обладают ярко выраженными протоноакцепторными свойствами: ДМФА, жидкий аммиак, пиридин, этилендиамин. Протофильные растворители повышают силу растворенных в них кислот и понижают силу растворенных в них оснований. Амфипротные растворители – растворители, которые могут как отдавать, так и принимать протоны: вода, одно- и многоосновные спирты, ДМСО, ацетонитрил. Применяются для создания среды при титровании веществ как кислотного, так и основного характера. 6. Иодиметрия. Количественное определение кислоты аскорбиновой (химизм реакций, условия титрования, индикатор, расчетные формулы титра и массовой доли (%) вещества, фактор эквивалентности вещества и титранта). (10 баллов) Ответ. 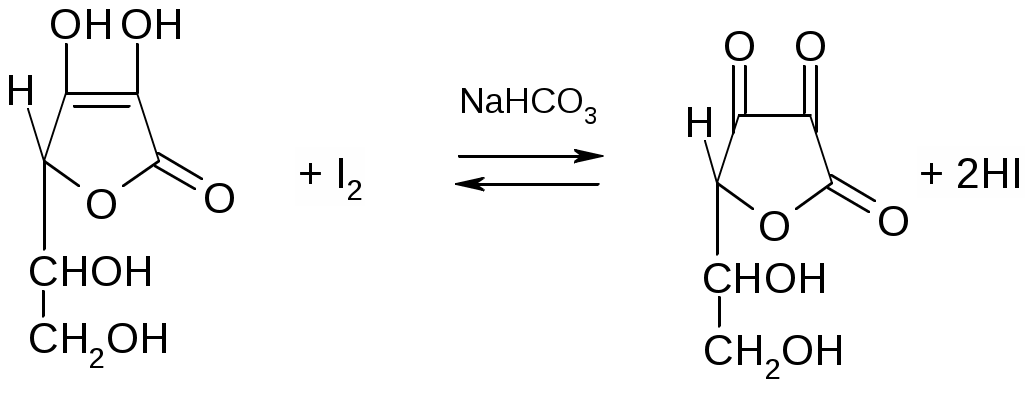 Индикатор – крахмал, титруют до появления синего окрашивания. Для смещения равновесия в сторону образования йодистоводородной кислоты титрование ведут в присутствии гидрокарбоната натрия, который связывает ионы водорода: H+ + HCO3 H2O + CO2 и сдвигает равновесие вправо, что обеспечивает достаточную полноту протекания реакции. Титрование следует проводить на холоду во избежание улетучивания йода. Кроме того, при повышении температуры снижается чувствительность крахмала.  fэкв (I2) = 1/2, т.к. I2 + 2e 2I; fэкв (аск.к-ты) = 1/2, т.к. 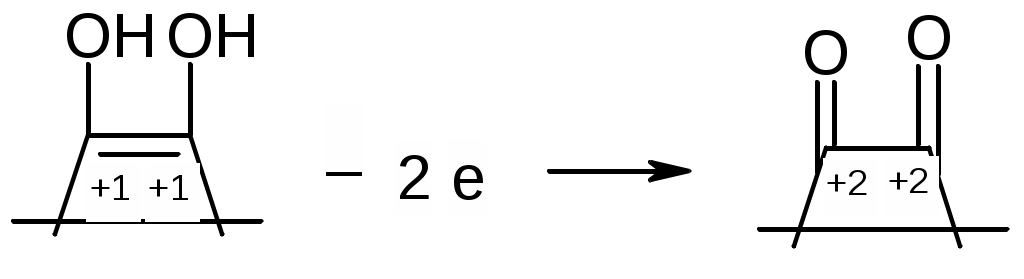 7. К 0,2181 г хлоралгидрата (М.м. 165,40 г/моль) добавили 50,0 мл 0,05 н. раствора гидроксида натрия (К=1,012). Рассчитайте содержание (%) хлоралгидрата в препарате, если на титрование избытка гидроксида натрия израсходовалось 24,42 мл 0,05 н. раствора хлористоводородной кислоты (К=0,996). Напишите уравнения реакций, укажите фактор эквивалентности хлоралгидрата и титранта. (10 баллов) Решение. 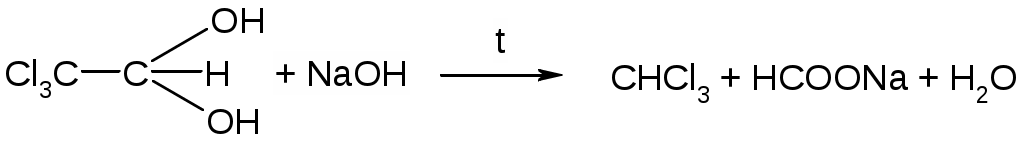 NaOH + HCl NaCl + H2O остаток fэкв(NaOH) = 1, т.к. одной молекуле хлоралгидрата соответствует один гидроксид-ион. 0,05 165,40 Т(NaOH/хлоралгидрату) = = 0,00827 1000 (50,0 1,012 24,42 0,996) 0,00827 100 , хлоралгидрата, % = = 99,64 0,2181 Ответ: 99,64% 8. Способы определения содержания вещества в ВЭЖХ. Ответ. Количественный анализ основан на допущении, что площадь пика на хроматограмме, соответствующая данному компоненту, прямо пропорциональна его количеству. Способы определения концентрации вещества: 1. Метод внутренней нормализации. Применяется, если на хроматограмме зарегистрированы пики всех компонентов, входящих в состав анализируемой смеси. Тогда доля площади пика компонента соответствует его содержанию (%). На одной и той же хроматограмме измеряют площади всех пиков и находят их сумму. Массовую долю (%) каждого компонента рассчитывают по формулам: Sа · 100 Sb · 100 Sc · 100 (а) = ———— % (b) = ————% (c) = ————% Sa + Sb + Sc Sa + Sb + Sc Sa + Sb + Sc 2. Метод внутреннего стандарта. Применяют при отсутствии на хроматограмме пиков некоторых компонентов анализируемой смеси. Метод основан на том, что в анализируемую смесь вводят некоторое определенное количество стандартного вещества. Это вещество должно быть химически инертным и отсутствовать в определяемой пробе и полностью отделяться от других компонентов смеси, время его удерживания должно быть близким к времени удерживания определяемых компонентов, пик симметричным. Для определения поправочных коэффициентов (нормированных множителей) составляют различные смеси (известного состава) внутреннего стандарта с каждым из компонентов и получают хроматограммы таких смесей. Определяют площади пиков и для каждого компонента рассчитывают поправочный коэффициент: Тогда Sст mх k = —— ——— Sх mст Sст и Sст – площади пиков внутреннего стандарта и определяемого компонента, mст и mх – масса стандарта и исследуемого вещества в искусственных смесях. Зная поправочные коэффициенты, содержание компонента (%) рассчитывают по формуле: Sx mст (х),% = k —— ——— 100 Sст mх 3. Метод внешнего стандарта. Применяется при определении отдельных веществ или определении примесей. Для этого отдельно хроматографируют анализируемое вещество и стандарт Тогда: Sх mх — = —— Sст mст Отсюда находят массу анализируемого вещества mх или находят содержание вещества в %: Sx mст (х),% = —— ——— 100 Sст mх Частным случаем метода внешнего стандарта является метод абсолютной калибровки (метод калибровочной кривой). Готовится серия эталонных растворов с известной массой определяемого вещества. Каждый эталонный раствор хроматографируется и определяется площадь пика Sэт. Строится графическая зависимость «площадь пика Sэт» — «масса m компонента». Далее хроматографируется раствор с неизвестной массой, определяется площадь пика и по графику находится масса анализируемого компонента. 9. Оптическая плотность испытуемого раствора левомицетина составляет 0,598. Рассчитайте концентрацию левомицетина (%), если удельный показатель погашения составляет 299, толщина поглощающего слоя – 1 см. (10 баллов) Решение. 0,598 С(левомицетина), % = —————— = 0,002 299 1 Ответ: 0,002%. |
