|
|
1 Атомномолекулярное учение
1)Атомно-молекулярное учение. Предмет химии. Атом, молекула, химический элемент. Простое вещество, сложное вещество. Моль. Относительная атомная и молекулярная масса. Молярная масса.
Закон сохранения массы вещества. Закон постоянства состава. Закон кратных отношений. Закона Авогадро и следствия из него. Эквивалент. Закон эквивалентов. Основные классы неорганических соединений. Номенклатура. Химические свойства оксидов, гидроксидов (основания, кислоты, амфотерные гидроксиды) и солей.
Химия - наука о веществах и их превращениях. Химические явления включают изменение веществ, например, горение, разложения и образование новых веществ. Такие превращения веществ характеризуют их химические свойства или реакции. Предмет химии — химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции.
Атом - частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом.
Молекула - электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества. В физике к молекулам причисляют также одноатомные молекулы, то есть свободные (химически не связанные) атомы (например, инертных газов, ртути и т. п.).
Химический элемент - совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева.
Простое вещество – вещество, состоящее из атомов одного элемента. В некоторых простых веществах атомы одного элемента соединяются друг с другом и образуют молекулы. Такие простые вещества имеют молекулярное строение. Другие простые вещества имеют атомное строение, т.е. состоят из атомов, между которыми существуют определённые связи. Существует также группа простых веществ, которые называют благородным газами. Эти простые вещества состоят из химически не связаннх друг с другом атомов.
Сложное вещество – вещество, которое состоит из атомов разных элементов. Сложные вещества часто называют химическими соединениями. В химических соединениях свойства простых веществ, из которых образуются эти соединения не сохраняются.
Моль – это количество вещества, которое содержит столько молекул(атомов) этого вещества, сколько атомов содержится в 12 г углерода.
Относительная молекулярная масса – молярная масса вещества М
Молекулярная атомная масса – молярная масса М, если вещество состоит из атомов.
Молярная масса – масса одного моля вещества (М).
Закон сохранения массы вещества (1748 Ломоносов, 1789 Лавуазье) - масса всех веществ, которые вступают в реакцию, равна массе всех продуктов реакции.
Закон постоянства состава (Пруст 1808) - любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Закон не распространяется на бертоллиды (соединения перменного состава).
Закон кратных отношений (Дальтон 1803) - Если два элемента (вещества) образуют друг с другом несколько
химических соединений, то масса одного из элементов, приходящихся
в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон Авогадро ( Авогадро 1811) - равные объёмы газов при одинаковых давлении и температуре содержат одинаковое число молекул. Следствия из него: 1. При одинаковых условиях равные количества различных газов занимают равные объёмы. При нормальных условиях (0oC, 1 атм) 1 моль различных газов занимает объем равный 22,4 л (молярный объем газа Vm=22/4л/моль при н.у.)
2. Отношение масс одинаковых объемов газов (относительная плотность одного газа по другому) равно отношению их молярных масс
D= m1/m2 = M1/M2
DH2=M/2 DB=M/29
Эквивалент - количество вещества, которое присоединяет (замещает) один моль атомов водорода или принимает (отдает) один моль электронов.
Закон эквивалентов - Массы реагирующих друг с другом веществ, а также продуктов реакции, прямо пропорциональны их эквивалентным массам (вещества реагируют и получаются в эквивалентных количествах)
m 1 /m 2 = МЭ1/МЭ2
Основные классы неорганических соединений:
- оксиды – соединения двух жлементов, один из которых кислород.
- основания – сложные вещества, молекулы которых состоят из атома металла и одной или нескольких групп –ОН.
- кислоты – сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла.
- амфотерные гидроксиды – сложные вещества, которые имеют свойства кислот и свойства оснований.
- соли – продукты замещения атомов водорода в молекулах кислот атомами металла или это продукты замещения гидроксильных групп в молекулах оснований кислотными остатками.
Номенклатура:
- Название оксида = «Оксид» + Название элемента + Валентность элемента
- Название основания = «Гидроксид» + Название металла + Валентность элемента.
- Название бескислородной кислоты = Название элемента + соедин. гласная «о» + «водородная кислота»
- Название оксокислоты образуется из русских названий кислотообразующих элементов с добавлением различных суффиксов и окончаний.
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na2O + H2O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + H2SO4 → CuSO4 + H2O.
4. Реагируют с амфотерными оксидами:
Li2O + Al2O3 → 2LiAlO2.
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO2, SO3, P2O5, N2O3, Cl2O5, Mn2O7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO3 + H2O → H2SO4.
Но не все кислотные оксиды непосредственно реагируют с водой (SiO2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO2 + CaO → CaCO3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO2 + Ba(OH)2 → BaCO3 + H2O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH)2 и H2ZnO2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl2 + H2O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na2 ZnO2 + H2O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H2O => Na2[Zn(OH)4].
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле. Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Химические свойства оснований
В водных растворах основания диссоциируют, что изменяет ионное равновесие:
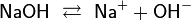
это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
лакмус становится синим,
метилоранж — жёлтым,
фенолфталеин приобретает цвет фуксии.
При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
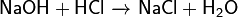
Примечание: реакция не идёт, если и кислота и основание слабые.
При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
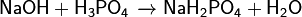
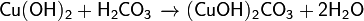
Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
![\mathsf{zn(oh)_2 + 2koh \ \xrightarrow{}\ k_2[zn(oh)_4] }](21412_html_c7be482.png)
Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
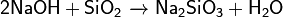
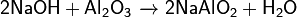
Основания вступают в обменные реакции (реагируют с растворами солей):
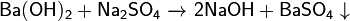
Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
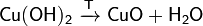
Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.
Основания щелочных металлов (кроме лития) при нагревании плавятся, расплавы являются электролитами.
Химические свойства кислот
Взаимодействие с основными оксидами с образованием соли и воды:
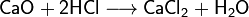
Взаимодействие с амфотерными оксидами с образованием соли и воды:
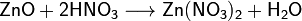
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
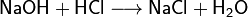
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
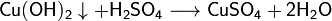
Взаимодействие с солями, если выпадает осадок или выделяется газ:
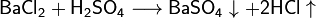
Сильные кислоты вытесняют более слабые из их солей:
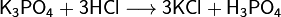
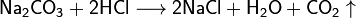
(в данном случае образуется неустойчиваяугольная кислота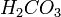 , которая сразу же распадается наводуиуглекислый газ) , которая сразу же распадается наводуиуглекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты 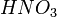 любой концентрации и концентрированной серной кислоты любой концентрации и концентрированной серной кислоты 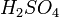 ), если образующаяся соль растворима: ), если образующаяся соль растворима:
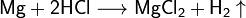
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
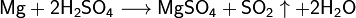
См. статью Взаимодействие кислот с металлами.
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
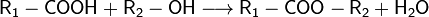
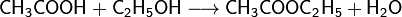
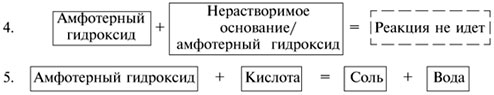
Химические свойства амфотерных гидроксидов

(См. свойства основных оксидов.)
Например:
2Al(OH)3 + Na2O  2NaAlO2 + 3H2O 2NaAlO2 + 3H2O . .

Некоторые амфотерные гидроксиды (Be(OH)2, Zn(OH)2, Pb(OH)2) реагируют с кислотным оксидом СО2 с образованием осадков основных солей и воды. Например:
2Be(OH)2 + CO2 = (BeOH)2CO3 + H2O. + H2O.
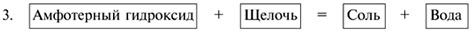
(См. свойства оснований.)
Например:
Zn(OH)2 + 2KOH (тв.)  K2ZnO2 + 2H2O K2ZnO2 + 2H2O , ,
Zn(OH)2 + 2KOH = K2[Zn(OH)4].
(См. свойства кислот.)
Например:
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
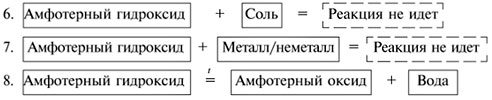
Все амфотерные гидроксиды (как и большинство оснований) разлагаются при нагревании на оксид и воду. Например:
2Al(OH)3  Al2O3 + 3H2O. Al2O3 + 3H2O.
В связи с этим нужно учитывать, что фактически в процессе сплавления их со щелочами и оксидами участвует не сам амфотерный гидроксид, а соответствующий ему оксид.
Химические свойства солей
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода или другие оксиды ) :
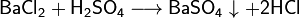
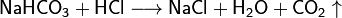
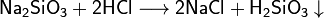
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
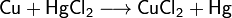
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
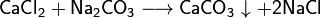
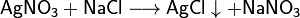
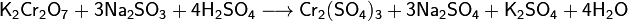
Некоторые соли разлагаются при нагревании:
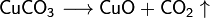
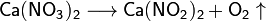
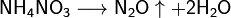
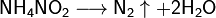
2) Строение атома. Ранние модели строения атома. Элементарные частицы атома. Состав атомного ядра. Изотопы.
|
|
|
 Скачать 0.54 Mb.
Скачать 0.54 Mb.