1 Атомномолекулярное учение
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
коррозия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 6Н2О + ЗО2 = 4Fe(OH)3. Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной. Коррозия электрохимическая и химическая. Разрушение металла под воздействием окружающей среды называют коррозией. Коррозия помимо уничтожения металла отрицательно влияет на эксплуатационные характеристики деталей, содействуя всем видам разрушения. Коррозия в зависимости от характера окружающей среды может быть химической и электрохимической. Электрохимическая коррозия имеет место в водных растворах, а так же в обыкновенной атмосфере, где имеется влага. Сущность этой коррозии в том, что ионы металла на поверхности детали, имея малую связь с глубинными ионами, легко отрываются от металла молекулами воды. Металл, потеряв часть положительно заряженных частиц, ионов, заряжается отрицательно за счет избыточного количества оставшихся электронов. Одновременно слой воды, прилегающий к металлу, за счет ионов металла приобретает положительный заряд. Разность зарядов на границе металл – вода обуславливает скачок потенциала, который в процессе коррозии изменяется, увеличиваясь от растворения металла, и уменьшаясь от осаждения ионов из раствора на металле. В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков. Методы защиты от коррозии повышение химического сопротивления конструкционных материалов, изоляция поверхности металла от агрессивной среды, понижение агрессивности производственной среды, снижение коррозии наложением внешнего тока (электрохимическая защита). 8)Комплексные соединения. Строение комплексных соединений (комплексообразователь, лиганды, координационное число, внутренняя и внешняя сфера комплекса). Природа химической связи в комплексных соединениях. Катионные анионные и нейтральные комплексы. Номенклатура комплексных соединений. Типы комплексных соединений. Диссоциация комплексных соединений. Константа нестойкости комплекса. Химические свойства комплексных соединений (реакции внутренней и внешней сферы). Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение. Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю. Лиганды — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+. Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица. Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные. Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью, бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д. Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом. Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность. Существует несколько классификаций комплексных соединений в основу которых положены различные принципы. По заряду комплекса 1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.). [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II) 2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы. K2[BeF4] — тетрафторобериллат(II) калия Li[AlH4] — тетрагидридоалюминат(III) лития K3[Fe(CN)6] — гексацианоферрат(III) калия 3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул. [Ni(CO)4] — тетракарбонилникель [Pt(NH3)2Cl2] — дихлородиамминплатина(II) [править]По числу мест, занимаемых лигандами в координационной сфере Структура комплексного иона, образованного катионом металла и анионом ЭДТА 1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.). 2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−. 3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.). По природе лиганда 1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др. 2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др. 3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4]. 4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6]. 5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др. Номенклатура 1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион. 2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил. 3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д. 4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя. 5) После обозначения состава внутренней сферы называют внешнюю сферу. 6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса. Примеры: K3[Fe(CN)6] — гексацианоферрат(III) калия (NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония [Сr(H2O)3F3] — трифторотриаквахром [Сo(NH3)3Cl(NO2)2] — динитритохлоротриамминкобальт [Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV) [Li(H2O)4]NO3 — нитрат тетрааквалития По тем же причинам чаще пользуются константой нестойкости комплексного соединения: Константа нестойкости – величина отрицательная, следовательно, чем меньше , тем утойчивее комплекс. 9)Основы аналитической химии. Предмет аналитической химии. Качественный и количественный анализ. Требования, предъявляемые к химическому анализу. Качественные реакции. Химические, физико-химические, биологические методы анализа. Объекты анализа. Основы титриметрического метода анализа (оборудование, техника выполнения, расчеты). Аналитическая химия – это наука о методах определения химического состава вещества и его структуры. Предметом аналитической химии является разработка методов и практическое выполнение анализов, исследование теоретических основ аналитических методов, к которым относятся: изучение форм существования элементов и их соединений в различных средах и агрегатных состояниях, определение состава и устойчивости координационных соединений, оптических, электрохимических и других характеристик вещества, исследование скоростей химических реакций, определение метрологических характеристик методов. Теоретическую основу аналитической химии составляют фундаментальные законы естествознания: периодический закон Д.И. Менделеева, законы сохранения энергии и массы вещества, законы постоянства состава, действующих масс и т.д. Аналитическая химия тесно связана с физикой, неорганической, физической, коллоидной химией, электрохимией, термодинамикой, теорией растворов, метрологией. В современной аналитической химии используются учения о координационных соединениях, квантово-химических методах и теории строения вещества, о кинетике реакций. Качественный анализ решает вопрос : какие компоненты входят в состав соединения, минерала. Качественный анализ показывает, из каких химических элементов состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному. ^ Количественный анализ позволяет установить количественные соотношения составных частей исследуемого вещества, минерала или смеси веществ. В отличие от качественного анализа количественный анализ определяет содержание отдельных компонентов в анализируемом веществе или общее содержание вещества в исследуемом продукте. К химическим реакциям в качественном анализе предъявляют следующие требования. 1. Реакция должна протекать практически мгновенно. 2. Реакция должна быть необратимой. 3. Реакция должна сопровождаться внешним эффектом (АС): а) изменением окраски раствора; б) образованием или растворением осадка; в) выделением газообразных веществ; г) окрашиванием пламени и др. 4. Реакция должна быть чувствительной и по возможности специфичной. К химическим реакциям, применяемым в этом анализе, предъявляют следующие требования: 1) реакция должна протекать достаточно быстро и быть практически необратимой; 2) вещества, вступившие в реакцию, должны реагировать в строго определенных количественных соотношениях, т.е. реакция должна быть стехиометрической и не сопровождаться побочными реакциями; 3) в результате реакции должны получаться соединения с определенным молекулярным составом; 4) на ход реакции не должны оказывать влияние примеси, присутствующие в анализируемом веществе; 5) реакция должна позволять достаточно просто устанавливать момент ее окончания, а также массу продукта реакции или объем раствора реагента, затраченный на ее проведение. Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны. Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы. Основоположником качественного анализа считается Р.Бойль, который ввёл представление о химических элементах как о неразлагаемых основных частях сложных веществ и систематизировал все известные в его время качественные реакции. Титриметрический метод анализа был предложен Ж. Л. Гей-Люссаком в прошлом веке и благодаря простоте выполнения, экспрессное, высокой точности и возможности использования реакций самого разного типа получил очень широкое распространение для определения неорганических и органических веществ как в водных, так и в неводных растворах. В процессе развития этот метод послужил основой для многих современных физико-химических титриметрических методов анализа. Ранее использовавшееся название метода «объемный анализ», связанное с тем, что в большинстве случаев количество прибавленного реагента (титранта) находят по объему его раствора, теперь заменено на более правильное «титриметрический анализ», так как иногда при наиболее точных определениях измеряют не объем, а массу раствора реагента. Основы титриметрического анализа Цель: познакомить учащихся с основными операциями и расчетами в титриметрическом анализе. Оборудование: пипетки на различные объемы растворов, бюретка, 2 конические колбы для титрования на 250 мл, воронка, штатив лабораторный с лапкой. Титриметрический метод анализа основан на определении количества вещества в анализируемом объекте по количеству (объему) титранта, вступившего во взаимодействие. Процесс постепенного приливания раствора-титранта к раствору анализируемого вещества называют титрованием. Момент, когда титрант добавили в исследуемый раствор в количестве, химически эквивалентном определяемому веществу, называют точкой эквивалентности. Для определения этого момента в исследуемый раствор добавляют индикатор. Окраска индикатора изменяется, когда реакция между определяемым веществом и титрантом доходит до конца. Практически изменение цвета не точно совпадает с точкой эквивалентности. В этом случае говорят о точке конца титрования (к.т.т.). В зависимости от типа используемых реакций титриметрические методы разделяют на четыре группы: 1) методы кислотно-основного титрования, основаные на использовании реакций нейтрализации; 2) методы окислительно-восстановительного титрования; 3) методы осаждения; 4) методы комплексообразования. По способу проведения титриметрические методы разделяют: 1) на прямое титрование; 2) обратное титрование; 3) титрование заместителя. Независимо от типа используемой реакции для любого титриметрического определения необходимо иметь: 1) титрант – рабочий титрованный раствор; 2) индикатор (иногда раствор титранта одновременно является индикатором); 3) измерительную посуду для точного установления объемов реагирующих веществ. Расчет концентрации по результатам титриметрического анализа проводится по закону эквивалентов: . 10)Основы органической химии. Валентные возможности углерода в органических соединениях. Гомологические ряды, гомологи. Изомерия, изомеры. Классификация органических соединений по строению углеродного скелета. Классификация органических соединений по функциональным группам. Основы номенклатуры углеводородов, галогенпроизводных, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов. Основные типы органических реакций (замещения, присоединения, разложения, изомеризации, разложения, окисления-восстановления) Изомеры - это вещества, имеющие одинаковый качественный и количественный состав молекул, но разное строение, и поэтому различные физические и химические свойства. Различают несколько видов изомерии: 1) изомерия карбоновой цепи. Например, нормальный бутан CH3-CH2-CH2-CH3 имеет неразветвленной строение, а его изомер 2-метилпропан имеет разветвленную строение. 2) изомерия кратного (двойного или тройного) связи. Например, 1-бутен CH3 = CH-CH2-CH3 и 2-бутен CH3-CH = CH-CH3; 3) изомерия функциональной группы. Например, 1-пропанол CH3-CH2-CH2-OH и 2-пропанол CH3-CH-CH3; 4) межклассовых изомерия. Например, одинаковую молекулярную формулу C2H6O имеют и спирт этанол C2H5OH и диметиловый эфир CH3-O-CH3. Для алкенов характерна еще пространственная, или стереоизомерия. Стереоизомеры имеют одинаковый порядок химических связей, но различное размещение атомов или групп атомов в пространстве. При этом образуются цис-, транс-изомеры. Цис-2-бутен транс-2-бутен Гомологи - это соединения, которые сходны по строению и химическим свойствам, но отличаются по составу молекул на одну или несколько групп CH2, которая называется гомологичной разницей. Гомологи образуют гомологичные ряды. Гомологический ряд - это ряд соединений, сходных по своему строению и химическим свойствам, которые отличаются друг от друга по составу молекул на одну или несколько гомологичных разниц CH2. Вы уже знакомы с гомологичными рядами алканов, алкенов, алкинов, аренов. Первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие. Это тривиальная (историческая) номенклатура. Рациональная номенклатура — по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении. Систематическая номенклатура — номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу. Процесс создания международной номенклатуры был начат в 1892 г. (Женевская номенклатура), продолжен в 1930 г. (Льежская номенклатура), с 1947 г. дальнейшее развитие связано с деятельностью комиссии ИЮПАК по номенклатуре органических соединений. Публиковавшиеся в разные годы правила ИЮПАК собраны в 1979 г. в “голубой книге” [Nomenclature of Organic Chemistry, Section A, B, C, D, E, F and H, Oxford Pergamon Press, 1979]. Своей задачей комиссия ИЮПАК считает не создание новой, единой системы номенклатуры, а упорядочение, “кодификацию”, имеющейся практики. Результатом этого является сосуществование в правилах ИЮПАК нескольких номенклатурных систем, а, следовательно, и нескольких допустимых названий для одного и того же вещества. Правила ИЮПАК опираются на следующие системы: заместительную, радикало-функциональную, аддитивную (соединительную), заменительную номенклатуру и т.д. В настоящее время для точного обозначения состава и строения органических соединений используют рациональную и систематическую номенклатуры. Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации). Очевидно, что все многообразие реакций органических соединений невозможно свести в рамки предложенной классификации (например, реакции горения). Однако такая классификация поможет установить аналогии с уже знакомыми вам из курса неорганической химии классификациями реакций, протекающих между неорганическими веществами. Как правило, основное органическое соединение, участвующее в реакции, называют субстратом, а другой компонент реакции условно рассматривают как реагент. Реакции замещения Реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов, называются реакциями замещения. В реакции замещения вступают предельные и ароматические соединения, такие, как, например, алканы, циклоалканы или арены. Приведем примеры таких реакций. Под действием света атомы водорода в молекуле метана способны замещаться на атомы галогена, например на атомы хлора: СН4 + Сl2 —> СН3Сl + НСl Другим примером замещения водорода на галоген является превращение бензола в бромбензол: При этой форме записи реагенты, катализатор, условия проведения реакции записывают над стрелкой, а неорганические продукты реакции — под ней. Реакции присоединения Реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну, называют реакциями присоединения. В реакции присоединения вступают ненасыщенные соединения, такие, как, например, алкены или алкины. В зависимости от того, какая молекула выступает в качестве реагента, различают гидрирование (или восстановление), галогенирование, гидрогалогенирование, гидратацию и другие реакции присоединения. Каждая из них требует определенных условий. 1. Гидрирование — реакция присоединения молекулы водорода по кратной связи: СН3—СН = СН2 + Н2 -> СН3—СН2—СН3 пропен пропан 2. Гидрогалогенирование — реакция присоединения гало-геноводорода (например, гидрохлорирование): СН2=СН2 + НСl —> СН3—СН2—Сl этен хлорэтан 3. Галогенирование — реакция присоединения галогена (например, хлорирование): СН2=СН2 + Сl2 —> СН2Сl—СН2Сl этен 1,2-дихлорэтан 4. Полимеризация — особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой — макромолекул. Реакции полимеризации — это процессы соединения множества молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы) полимера. Примером реакции полимеризации может служить получение полиэтилена из этилена (этена) под действием ультрафиолетового излучения и радикального инициатора полимеризации R. Реакции отщепления (элиминирования) Реакции, в результате которых из молекулы исходного соединения образуются молекулы нескольких новых веществ, называют реакциями отщепления или элиминирования. Примерами таких реакций может служить получение этилена из различных органических веществ. Особое значение среди реакций отщепления имеет реакция термического расщепления углеводородов, на котором основан крекинг (англ. to crack — расщеплять) алканов — важнейший технологический процесс: В большинстве случаев отщепление малой молекулы от молекулы исходного вещества приводит к образованию дополнительной п-связи между атомами. Реакции элиминирования протекают в определенных условиях и с определенными реагентами. Приведенные уравнения отражают лишь конечный результат этих превращений. Реакции изомеризации Реакции, в результате которых из молекул одного вещества образуются молекулы, других веществ того же качественного и количественного состава, т. е. с той же молекулярной формулой, называют реакциями Классификация органических соединений. Органические соединения классифицируют по двум основным признакам: строению углеродного скелета и функциональным группам. По строению углеродного скелета различают ациклические, карбоциклические и гетероциклические соединения. Ациклические соединения – содержат открытую цепь атомов углерода. Карбоциклические соединения – содержат замкнутую цепь углеродных атомов и подразделяются на алициклические и ароматические. К алициклическим относятся все карбоциклические соединения, кроме ароматических. Ароматические соединения содержат циклогексатриеновый фрагмент (бензольное ядро). Гетероциклические соединения - содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов. По природе функциональных групп органические соединения делят на классы. Таблица 1. Основные классы органических соединений. 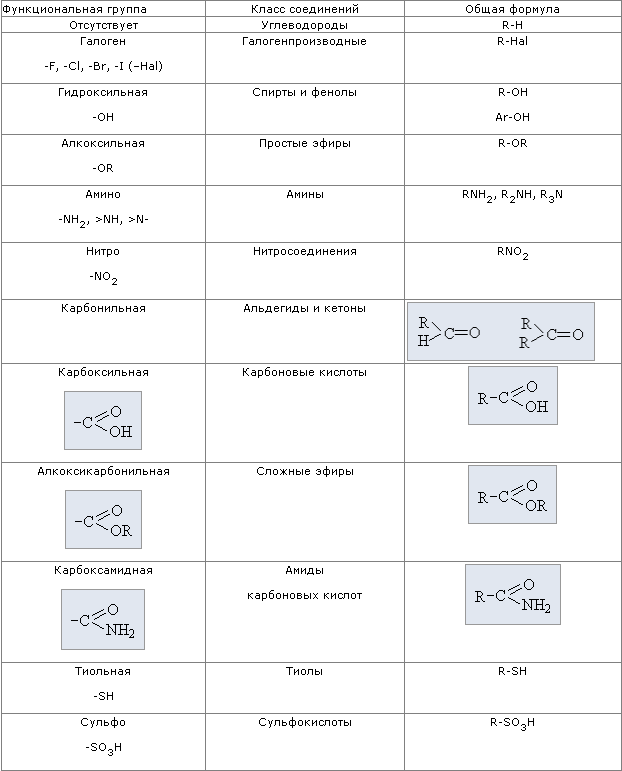 Таблица 2. Названия алканов и алкильных радикалов, принятые систематической номенклатурой IUPAC. 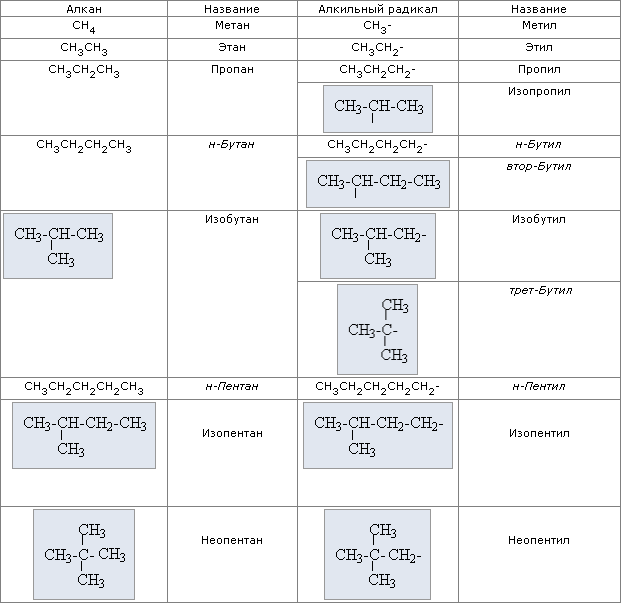 Таблица 3. Названия характеристических групп (перечислены в порядке убывания старшинства). 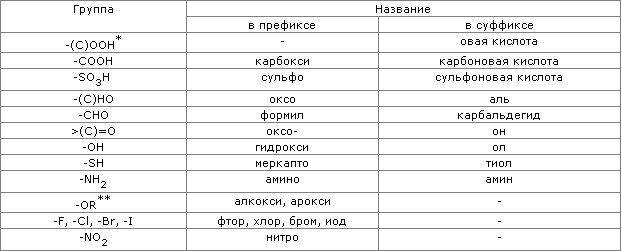 |
