Химия металлов вопросы к экзамену. 1. Элементы подгр. 1А. Строение атомов, сравнение свойств атомов, распространение в природе. Получение простых веществ и их свойства
 Скачать 274.84 Kb. Скачать 274.84 Kb.
|
|
4)Оксиды и гидроксиды элементов 2а. Свойства, получение Соединения металлов главной подгруппы II группы Оксиды металлов IIА группы Общая формула МеО Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде. Способы получения: Окисление металлов (кроме Ba, который образует пероксид) 2Са + О2 → 2СаО 2) Термическое разложение нитратов или карбонатов CaCO3 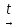 CaO + CO2 CaO + CO22Mg(NO3)2 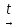 2MgO + 4NO2 + O2 2MgO + 4NO2 + O2Химические свойства ВеО – амфотерный оксид Оксиды Mg, Ca, Sr, Ba – основные оксиды Взаимодействуют с водой(кроме ВеО), образуя щелочи(MgO – слабое основание): СаО + H2O → 2. Взаимодействуют с кислотами, образуя соль и воду: СаО + НCl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO3 → 4. ВеО взаимодействует со щелочами: ВеО + 2NaOH + H2O → Na2[Ве(OH)4] Гидроксиды металлов IIА группы Общая формула – Ме(ОН)2 Физические свойства: Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН)2 – в воде нерастворим. Основные свойства усиливаются в ряду: Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2 → Вa(ОН)2 Способы получения: Реакции щелочноземельных металлов или их оксидов с водой: Ba + 2H2O → Ba(OH)2 + H2 CaO(негашеная известь) + H2O → Ca(OH)2(гашеная известь) Химические свойства Ве(ОН)2 – амфотерный гидроксид Mg(ОН)2 – слабое основание Са(ОН)2, Sr(ОН)2, Ва(ОН)2 – сильные основания – щелочи. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют с кислотами, образуя соль и воду: Ве(ОН)2 + Н2 SO4 → 3. Взаимодействуют с кислотными оксидами. Са(ОН)2 + SO3 → 4. Взаимодействуют с растворами солей, если образуется газ или осадок. Ва(ОН)2 + K2SO4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН)2 + 2NaOH → Na2[Ве(OH)4] При нагревании разлагаются: Са(ОН)2 → 5)Алюминий. Характеристика элемента. Получение простого вещества и его свойства.Алюминий — элемент 3-й группы периодической таблицы химических элементов, третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Простое вещество алюминий — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. История: Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году. До открытия промышленного способа получения алюминия этот металл был дороже золота. Распределение электронов по орбиталям выглядит следующим образом: +13Al)2)8)3; 1s22s22p63s23p1. Наиболее характерная степень окисления атома алюминия +3. Отрицательная степень окисления проявляется редко. Получение: В настоящее время в промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленнном криолите. Al2O3 = Al3+ + AlO33- Химические свойства: С кислородом взаимодействует только в мелкораздробленном состоянии при высокой температуре: 4Al + 3O2 = 2Al2O3, (реакция сопровождается большим выделением тепла) Выше 200°С реагирует с серой с образованием сульфида алюминия: 2Al + 3S = Al2S3. При 500°С – с фосфором, образуя фосфид алюминия: Al + P = AlP. При 800°С реагирует с азотом, а при 2000°С – с углеродом, образуя нитрид и карбид: 2Al + N2 = 2AlN, 4Al + 3C = Al4C3. С хлором и бромом взаимодействует при обычных условиях, а с йодом при нагревании, в присутствии воды в качестве катализатора: 2Al + 3Cl2 = 2AlCl3 С водородом непосредственно не взаимодействует. С металлами образует сплавы, которые содержат интерметаллические соединения – алюминиды, например, CuAl2, CrAl7, FeAl3 и др. Очищенный от оксидной пленки алюминий энергично взаимодействует с водой: 2Al + 6H2O = 2Al(OH)3 + 3H2 Легко взаимодействует с разбавленными кислотами, образуя соли: 2Al + 6HCl = 2AlCl3 + 3H2; 2Al + 3H2SO4 = Al2(SO4)3 + 3H2; 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O (в качестве продукта восстановления азотной кислоты также может быть азот и нитрат аммония). С концентрированной азотной и серной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли и продукта восстановления кислоты: 2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O; Al + 6HNO3 = Al(NO3)3 + 3NO2 + 3H2O. Взаимодействие со щелочами Алюминий – амфотерный металл, он легко реагирует со щелочами: в растворе с образованием тетрагидроксодиакваалюмината натрия: 2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2 при сплавлении с образованием алюминатов: 2Al + 6KOH = 2KAlO2 + 2K2O + 3H2. Восстановление металлов из оксидов и солей Алюминий – активный металл, способен вытеснять металлы из их оксидов. Это свойство алюминия нашло практическое применение в металлургии: 2Al + Cr2O3 = 2Cr + Al2O3. 6)Оксид и гидроксид алюминия. Получение и свойства Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы. Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия, открытый Бекетовым: Cr2O3 + Al = Al2O3 + 2Cr Химические свойства: Оксид алюминия проявляет амфотерные свойства 1. взаимодействие с кислотами А12О3 +6HCl = 2AlCl3 + 3H2O 2. взаимодействие со щелочами А12О3 + 2NaOH – 2NaAlO2 + H2O Al2O3 + 2NaOH + 5H2O = 2Na[Al(OH)4(H2O)] 3. при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Мп, V, W и др.) в свободном состоянии 2А1 + WO3 = А12Оз + W 4. взаимодействие с солями, имеющими сильнощелочную среду, вследствие гидролиза Al2O3 + Na2CO3 = 2 NaAlO2 + CO2 Гидроксид алюминия – А1(ОН)3. Физические свойства: гидроксид алюминия – белы, аморфный (гелеобразный) или кристаллический. Почти не растворим в воде; Получение: 1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О; 2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?; 3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-; 4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3. Химические свойства: 1. взаимодействие с кислотами Al(OH)3 +3HCl = 2AlCl3 + 3H2O 2. при взаимодействии с сильными щелочами образуются соответствующие алюминаты: NaOH + А1(ОН)з = Na[A1(OH)4] 3. термическое разложение 2Al(OH)3 = Al2О3 + 3H2O Гидроксид алюминия не реагирует с гидратом аммиака, хлоридомаммония, диоксидами углерода и серы, сероводородом. 7.Амфотерность оксида и гидроксида алюминия. Комплексные соединения алюминия. Al2O3 – твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется. Типичный амфотерный оксид, поэтому реагирует с кислотами и щелочами. Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O При сплавлении образуется метаалюминат натрия: Al2O3 (тв)+ 2 NaOH (тв) t→ 2 NaAlO2 + H2O, В растворе щёлочи образуется тетрагидроксоалюминат натрия: Al2O3 + 2 NaOH + 3 H2O = 2Na[Al(OH)4] Алюминаты неустойчивы и даже при слабом подкислении разрушаются: Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3 Al(OH)3 – белое вещество, нерастворимое в воде, амфотерный гидроксид. Получают косвенно реакцией обмена между солью алюминия и щелочью: AlCl3 + NaOH (по каплям)= Al(OH)3 ↓ + 3 NaCl Взаимодействует с кислотами и щелочами. Al(OH)3 + 3 HCl = AlCl3 + 3 H2O В растворе: Al(OH)3 + NaOH(избыток) = Na[Al(OH)4] или Al(OH)3 + 3 NaOH = Na3[Al(OH)6] Врасплавах: Al(OH)3 + NaOH = NaAlO2 + 2H2O Очень часто амфотерные гидроксиды элементов в степени окисления +III существуют также в мета-форме, например: AlO(OH) - метагидроксид алюминия FeO(OH) - метагидроксид железа (орто-форма "Fe(OH)3" не существует). Амфотерные гидроксиды практически нерастворимы в воде, наиболее удобный способ их получения - осаждение из водного раствора с помощью слабого основания - гидрата аммиака: Al(NO3)3 + 3(NH3 · H2O) = Al(OH)3↓ + 3NH4NO3 (20 °C) Al(NO3)3 + 3(NH3 · H2O) = AlO(OH)↓ + 3NH4NO3 + H2O (80 °C) В случае использования избытка щелочей в обменной реакции подобного типа гидроксид алюминия осаждаться не будет, поскольку алюминий в силу своей амфотерности переходит в анион: Al(OH)3(т) + OH− = [Al(OH)4]− Пример молекулярного уравнения реакции этого типа: Al(NO3)3 + 4NaOH(избыток) = Na[Al(OH)4] + 3NaNO3 Образующаяся соль относится к числу комплексных соединений (комплексных солей): они включают комплексный анион [Al(OH)4]−. Названия этой соли таково: Na[Al(OH)4] - тетрагидроксоалюминат натрия Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2]-, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый — наиболее прочный. Координационное число алюминия в этом комплексе равно 6, т.е. алюминий является шестикоординированным. Комплексным (координационным) соединением (комплексом) называется такое соединение, в узлах кристаллической решетки которого находятся комплексные ионы, обладающие высокой симметрией, устойчивые как в твердом состоянии, так и в растворах. В центре комплексного иона находится металл (обычно d-металл, реже р-металл), который называется комплексообразователь. Вокруг него очень симметрично располагаются лиганды, за счет чего электронная плотность распределяется равномерно и комплекс становится устойчивым. Лигандами могут быть анионы кислот или нейтральные молекулы (Н2О, СО, NH3), которые имеют неподеленную пару электронов. Она принимает участие в донорно-акцепторном взаимодействии с вакантной орбиталью комплексообразователя. 8. Бериллий. Получение и свойства Бериллий — светло-серый, легкий, достаточно твердый, хрупкий металл. На воздухе покрывается оксидной пленкой. Получение: В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия: BeCl2+2K=Be+2KCl.B e C l 2 + 2 K ⟶ B e + 2 K C l {\displaystyle {\mathsf {BeCl_{2}+2K\longrightarrow Be+2KCl}}} В настоящее время бериллий получают, восстанавливаяфторид бериллиямагнием: BeF2+Mg=Be+MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия. Химические свойства: Для бериллия характерна только одна степень окисления +2. По многим химическим свойствам бериллий больше похож на алюминий, чем на находящийся непосредственно под ним в таблице Менделеева магний (проявление «диагонального сходства»). Металлический бериллий относительно мало реакционноспособен при комнатной температуре. Пассивируется в холодной воде, концентрированных серной и азотной кислотах. Восстановитель, реагирует с кипящей водой, разбавленными кислотами, концентрированными щелочами, неметаллами, аммиаком, оксидами металлов, при нагревании сгорает в кислороде и на воздухе. С металлами бериллий образует интерметаллические соединения. 2Be + O2(900°С) = 2BeO С водородом бериллий не реагирует даже при нагревании до 1000°C, зато он легко соединяется с галогенами, серой и углеродом. Be + Hal2(нагр.) = 2BeHal2 (7Be+2F→Be7F2; 2Be+I2→2BeI ) 3Be + C2H2 = BeC2 + H2↑ Be + MgO = BeO + Mg Взаимодействие с серой: 2Be+S→Be2S Взаимодействие с азотом(N): 2Be+N2→2BeN Бериллий хорошо растворяется во всех минеральных кислотах, кроме, как это ни странно, азотной. От нее как и от кислорода, бериллий защищен окисной пленкой. Be + 2HCl(разб.) = BeCl2 + H2↑ 3Be + 8HNO3(разб) = 3 Be(NO3)2 + 2 NO + 4 H2O Со щелочами бериллий реагирует, образуя соли-бериллаты, подобные алюминатам. Многие из них имеют сладковатый вкус, но пробовать на язык их нельзя – почти все бериллаты ядовиты. Be + 2NaOH(конц.) + H2O = Na2BeO2 + H2↑ Be + 2NaOH(расплав) = Na2[Be(OH)4] + H2↑ Взаимодействие с водой: 2Be+3H2O→2H2 + ВеО + Ве(OH)2 2Be + 3H2O(кип.) = BeO↓ + Be(OH)2↓ + 2H2↑ Бериллий склонен к образованию комплексных соединений при взаимодействии с водными растворами щелочей. Взаимодействие с азотной кислотой: Взаимодействие с растворами щелочей: Be + 2KOH + 2H2O = K2[Be(OH)4] + H2 Производство и применение: В России планируется строительство нового комбината по производству бериллия к 2019 году. На долю остальных стран приходилось менее 1 % мировой добычи. Всего в мире производится 300 тонн бериллия в год (2016 год). Легирование сплавов Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твёрдость и прочность сплавов, коррозионную устойчивость поверхностей, изготовленных из этих сплавов изделий. РентгенотехникаБериллий слабо поглощает рентгеновское излучение, поэтому из него изготавливают окошки рентгеновских трубокЯдерная энергетика В атомных реакторах из бериллия изготовляют отражатели нейтронов, его используют как замедлитель нейтронов. Лазерные материалыВ лазерной технике находит применение алюминат бериллия для изготовления твердотельных излучателей (стержней, пластин).Аэрокосмическая техника В производстве тепловых экранов и систем наведения с бериллием не может конкурировать практически ни один конструкционный материалРакетное топливоСтоит отметить высокую токсичность и высокую стоимость металлического бериллия, и в связи с этим приложены значительные усилия для выявления бериллийсодержащих топлив, имеющих значительно меньшую общую токсичность и стоимость. Одним из таких соединений бериллия является гидрид бериллия.Огнеупорные материалыОн служит высокотеплопроводным высокотемпературным изолятором и огнеупорным материалом для лабораторных тиглей и в других специальных случаях.Акустика Ввиду своей легкости и высокой твёрдости бериллий успешно применяется в качестве материала для электродинамических громкоговорителей. Биологическая роль и физиологическое действие: В живых организмах бериллий не несёт какой-либо значимой биологической функции. Однако бериллий может замещать магний в некоторых ферментах, что приводит к нарушению их работы. Ежедневное поступление бериллия в организм человека с пищей составляет около 0,01 мг. |
