Химия металлов вопросы к экзамену. 1. Элементы подгр. 1А. Строение атомов, сравнение свойств атомов, распространение в природе. Получение простых веществ и их свойства
 Скачать 274.84 Kb. Скачать 274.84 Kb.
|
|
1. Элементы подгр. 1А. Строение атомов, сравнение свойств атомов, распространение в природе. Получение простых веществ и их свойства. В 1А подгр. входят Li(литий), Na(натрий), К(калий), Rb(рубидий), Cs(цезий), Fr(франций) Это щелоч. Me, тк при взаим. с H2O обр. едкие щелочи Fr-радиоактивный эл-т, поэтому его св-ва изучены мало Атомы этих эл-тов имеют на внешн. энергетич. уровне 1 s-электрон. 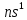 Вступая в хим. взаим., атомы легко отдают электрон внешн. энерг. ур-ня, проявляя постоянную степень окисл +1 Поэтому они сильные восстанов. По группе ↓ увелич. радиусы атомов, тк увелич. число электр. слоев. Уменьш. энергия ионизации (кол-во энергии, кот. требуется для того чтобы оторвать электрон от свободного атома. След. увелич. восстанов. и металл-ие св-ва. Li+ образует кристаллогидраты. Поляризующая способность велика (смещение электр. плотности иона под действием электр. поля Na+ половина соед-ий обр-ют кристаллогидраты. Увелич. радиуса уменьш. поляризующую способность K+ Rb+ Cs+ комплексов не обр., след их соли не явл. кристаллогидратами По многим химическим свойствам несколько отличается от других щелочных металлов Li+, имеющий диагональное сходство с Mg2+ Распр. в природе: Na, K - 2% Li - 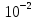 % %Rb, Cs - 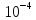 % %Rb, Cs рассеянные эл-ты, не обр собств. минералов, сопутствуют минералам Na, K Минералы Li: Li2O • Al2O3 • 4SiO2 – сподумен Na: NaCl – поваренная соль Na2SO4 • 10H2O – глауберова соль NaNO3 – чилийская селитра Na3AlF6 - криолит Na2B4O7· 10H2O - бура Ka: KCl • NaCl – сильвинит KCl • MgCl2 • 6H2O – карналлит K2O • Al2O3 • 6SiO2 – полевой шпат (ортоклаз) Физ. св-ва Низкие темпер. плавл. (30-180⁰):( Cs-28.5 Li - 180.5) , малые знач. плотн., мягкие, режутся ножом, проводят эл. ток. Серебристо-белые. Легкоплавкие. Прим-ние Li: явл. Me оборонной промышл. Примен. в виде сплавов с Mg в произв. водородных бомб, в состав смазочных масел, аккумуляторов, стекла. Токсичен. Li2СO3 исп. для лечения маниакально-депрессивного психоза. Повышенное содерж. Li в крови явл признаком нарушения ф-ции почек Na: использ. в промышл. в теплообменниках ядерных реакторов. В организме чел. содерж. 100 г. 30% в костях. Явл. межклеточным катионом, регулирующим гомеостаз К: исп. в производстве удобрений, в хим промышл, для варки стекла. В организме 140 г. 98% внутри клеток. Необходим для поддержания нервно-мышечной возбедимости, внутриклеточного осмотического давления, обеспечивает сокращение мышц, проницаемость мембран Rb, Cs: в организме в очень малых кол-вах. По св-вам в орган. схожи с К Получение: *электролиз расплавов NaOh (небольшие энергозатраты, но О2 выделяющийся окисляет Na) K (-): Na+ +1e =Na A (+): 4OH− −4e =2H2O + O2 *электролиз расплава NaCl (высокая темп. плавл - 800) K (катод) (-): Na+ + 1e = Na A (анод) (+): Cl− — 2e = Cl2 *эвтектический сплав - NacK. натрий отделяют путем вакуумной перегонки от калия. Потом сублимируется Хим. св-ва *+H2 = гидраты (белые кристаллические порошки) 2Li+h2=2LiH (небольш. темп) (остальные при высоких темп) *+ галогены. р-ция активная с воспламенением 2Na+Br2=2NaBr *2 Na + S = Na2S (совзрывом) *6Li + N2 = 2Li3N (литий при комнатн. темп, остальные при высоких - 2000) *2Li + 2C =2Li2C2 (карбиды) (1000) * + вода 2Na + 2H2O = 2NaOH + H2(может загореться) 2Li + 2H2O = 2LiOH + H2(спокойно, не загораясь) 2K+H2O=2KOH + H2 (возгорание) *+кислород (при комннат. темп) 4Li + O2 → 2Li2O(оксид лития) 2Na + O2 → Na2O2 (пероксид натрия) K + O2 → KO2 (надпероксид калия) На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.). *+ кислоты Щелоч. ме взаим. с хлороводородной и разб. серной кислотами с выдел. водорода: 2Na + 2HCl = 2NaCl +H2 Конц. серную кислоту восстанавливают главным образом до сероводорода: 8Na + 5H2SO4 = 4Na2SO4 + H2S + 4H2O с разб. азотной кислотой получается аммиак или нитрат аммония, а с конц. – азот или оксид азота (I): 8Na +10HNO3(разб.)= 8NaNO3 + NH4NO3 + 3 H2O 8K +10HNO3(конц.)= 8KNO3 + NO2 + 5H2O * окрашивание пламени Li+ – карминово-красный Na+ – желтый K+, Rb+ и Cs+ – фиолетовый 2.Элементы подгр. 2А. Строение атомов, сравнение свойств атомов, распространение в природе. Получение простых веществ и их свойства. Бериллий Be, Магний Mg, Кальций Ca,Стронций Sr, Барий Ba, Радий Ra Щелочноземельными эти ме называют, т.к. они содержатся во всех минералах земли — поэтому «земельные», а «щелочные» — т.к. они придают воде щелочную реакцию. Электронное строен. внешн. слоя у всех этих эл. одинаково – на нем всего 2 электрона на s-подуровне, след валентность-2, степень окисл +2 ↓ по подгр. радиус увелич., металлические св-ва увел., увел. восстанов. св-ва С увелич. радиуса уменьш. устойчивость комплекс.соед. У магния появ. d орбиталь Ca, Sr, Ba- энергия ионизации низкая Координац. число 4, а у магния 6 Распр. в природе Be 3BeO • Al2O3 • 6SiO2 – берилл Mg MgCO3 – магнезит CaCO3 • MgCO3 – доломит KCl • MgSO4 • 3H2O – каинит KCl • MgCl2 • 6H2O – карналлит Ca CaCO3 – кальцит (известняк, мрамор и др.) Ca3(PO4)2 – апатит, фосфорит CaSO4 • 2H2O – гипс CaF2 – плавиковый шпат (флюорит) Sr SrSO4 – целестин SrCO3 – стронцианит Ba BaSO4 – барит BaCO3 – витерит Физ.св-ва Ме серого цвета, твердые, ножом не порезать, плотные, на воздухе устойчивы но покрываются оксидной пленокой, электро- и теплопроводны Применение Стронций. При выплавке бронз и меди. В пиротехнике. Для изгот. фотоэлементов. Барий. В рентгенодиагностике(поглощает излучение) Кальций.(в чистом виде почти не примен) Для удаления серы из нефтепродуктов, для обезвоживание орг.в-в В стекольной промышленности. Биогенный э-т. Необх. для протекания жизненных процессов. Фосфаты в удобрениях примен. Ионы учавств в процессе свертывания крови Бериллий использ в качетсв добавки к сплавам для прочности. Исп для изготовл ренген.аппаратов. Сплав Be, Ni, W- в Швейцарии делают пружины для часов Магний. сплавы легкие. исп для произ самолетов, ракет. Необходим при синтезе АТФ. передает нервные импульсы Получение *Бериллий получают восстановлением фторида: BeF2 + Mg = Be + MgF2 *Барий получают восстановлением оксида: 3BaO + 2Al = 3Ba + Al2O3 *Остальные металлы получают электролизом расплавов хлоридов: CaCl2 = Ca + Cl2 катод: Ca2+ + 2ē ® Ca0 анод: 2Cl- – 2ē ® Cl02 Хим.св-ва Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba *с водой В обыч. усл. поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, кот. явл. сильными основаниями: Mg + 2H2O = Mg(OH)2 + H2 Ca + 2H2O =Ca(OH)2 + H2 *с кислородом Все металлы образуют оксиды, барий-пероксид – BaO2: 2Mg + O2 =2MgO Ba + O2 = BaO2 *С неметаллами Be + Cl2 = BeCl2(галогениды) Ba + S = BaS(сульфиды) (при высок. темп) 3Mg + N2 = Mg3N2(нитриды) (при высок. темп) Ca + H2 = CaH2(гидриды) Ca + 2C = CaC2(карбиды) (при высок темп) 3Ba + 2P = Ba3P2(фосфиды) *растворяются в кислотах Ca + 2HCl = CaCl2 + H2 Mg + H2SO4(разб.) = MgSO4 + H2 *Бериллий также растворяется в водных растворах щелочей Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 Природная вода, содерж. ионы Ca2+ и Mg2+, назыв. жесткой. она при кипячении обр. накипь, в ней не развариваются пищевые продукты; моющие средства не дают пены. Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов. Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной. Удаляют жесткость кипячениемСa(HCO3)2 =CaCO3 + CO2 + H2O добавл. соды MgCl2 + Na2CO3 = MgCO3 + 2NaCl 3. ОКСИДЫ И ГИДРОКСИДЫ МЕТАЛЛОВ IA ГРУПЫ Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород. Основания - сложные вещества, состоящие из атомов металла, соединенных с одной или несколькими гидроксогруппами. Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов. N   a a O, Mg+2O , Al O, Mg+2O , Al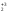 O3 O3основные амфотерный Na+1OН, Mg+2OН , Al+3(OН)3 щелочь Слабое Амфотерный основание гидроксид В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз. Соединения металлов IА группы Оксиды щелочных металлов Общая формула Ме2О Физические свойства: Твердые, кристаллические вещества, хорошо растворимые в воде. Li2O, Na2O – бесцветные, К2О, Rb2O – желтые, Cs2О – оранжевый. Способы получения: Окислением металла получается только оксид лития 4Li + O2 → 2Li2O (в остальных случаях получаются пероксиды или надпероксиды ( ИЗ ЛЕКЦИИ 2Na+O2→Na2O; K+O2→KO2). Все оксиды (кроме Li2O) получают при нагревании смеси пероксида (или надпероксида) с избытком металла: Na2O2 + 2Na → 2Na2O KO2 + 3K → 2K2O Химические свойства Типичные основные оксиды: Взаимодействуют с водой, образуя щелочи: Na2О + H2O → 2. Взаимодействуют с кислотами, образуя соль и воду: Na2О + НCl → 3. Взаимодействуют с кислотными оксидами, образуя соли: Na2О + SO3 → 4. Взаимодействуют с амфотерными оксидами образуя соли: Na2О + ZnO → Na2ZnO2 Гидроксиды щелочных металлов Общая формула – МеОН Физические свойства: Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие. NaOH – едкий натр КОН – едкое кали Сильные основания - Щелочи. Основные свойства усиливаются в ряду: LiOH → NaOH → KOH → RbOH → CsOH Способы получения: 1. Электролиз растворов хлоридов: 2NaCl + 2H2O → 2NaOH + H2+ Cl2 2. Обменные реакции между солью и основанием: K2CO3 + Ca(OH)2→ CaCO3 + 2KOH 3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой: 2Li + 2H2O→ 2LiOH + H2 Li2O + H2O→ 2LiOH Na2O2 + 2H2O→ 2NaOH + H2O2 Химические свойства 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют со всеми кислотами. NaOH + HCl → NaCl + H2O 3. Взаимодействуют с кислотными оксидами. 2NaOH + SO3 → Na2SO4 + H2O 4. Взаимодействуют с растворами солей, если образуется газ или осадок. 2 NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H2O → Na2SiO3 + 2H2↑ 6. Взаимодействуют с амфотерными оксидами и гидроксидами 2 NaOH + ZnО + H2O → Na2[Zn(OH)4] 2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4] 7. При нагревании не разлагаются, кроме LiOH. |
