Курсовая работа. Курсовая работа 3 курс. 1 Физические свойства металлов и сплавов 4 2 Химические свойства металлов и сплавов 9 1 Взаимодействие с простыми веществами 9
 Скачать 72.77 Kb. Скачать 72.77 Kb.
|
2 Химические свойства металлов и сплавовМеталлы в свободном виде являются восстановителями. Это связано с тем, что атомы металлов имеют большие радиусы. В главных подгруппах Периодической системы сверху вниз радиусы атомов увеличиваются, а значит, электроны отдавать становится все проще, и восстановительные свойства простых веществ возрастают. Кроме того, в связи с увеличением радиуса атома усиливаются и основные свойства соответствующих гидроксидов. В периодах слева направо радиусы атомов уменьшаются, восстановительные свойства простых веществ ослабевают и увеличивается кислотная природа гидроксидов. Реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, очень прочной и устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей 15. 2.1 Взаимодействие с простыми веществамиС кислородом взаимодействует при обычных условиях или нагревании большинство металлов, кроме благородных (Ag, Au, Pt). На поверхности некоторых металлов (Al, Cr, Ni) имеется прочная пленка оксида ( 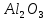 , , 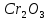 , NiO), которая предохраняет их от дальнейшего окисления. Они устойчивы на воздухе. Реакция активных металлов с кислородом приводит к разным продуктам. , NiO), которая предохраняет их от дальнейшего окисления. Они устойчивы на воздухе. Реакция активных металлов с кислородом приводит к разным продуктам. Литий, кальций и стронций сгорают в кислороде с образованием нормальных оксидов (где кислород находится в степени окисления -2), как и большинство других металлов: 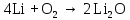 (1) (1)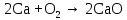 (2) (2)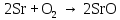 (3) (3)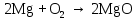 (4) (4)Натрий, барий и радий окисляются с образованием пероксидов (где кислород находится в степени окисления -1), которые можно считать солями перекиси водорода 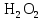 : : 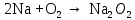 (5) (5)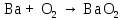 (6) (6)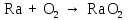 (7) (7)Калий, рубидий и цезий в кислороде переходят в надпероксиды (где кислород находится в степени окисления –1/2): 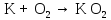 (8) (8)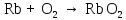 (9) (9)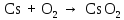 (10) (10)С другими неметаллами простые вещества металлы образуют соли, как правило, в наиболее устойчивых для себя степенях окисления: 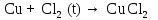 (11) (11)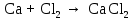 (12) (12)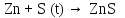 (13) (13)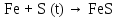 (14) (14)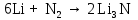 (15) (15)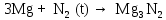 (16) (16)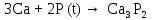 (17) (17)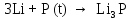 (18) (18)2.2 Взаимодействие со сложными веществами1. С водой Активные металлы (гидроксиды которых неплохо растворимы в воде) активно взаимодействуют с водой при комнатной температуре с выделением водорода: 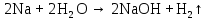 (19) (19)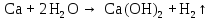 (20) (20)Менее активные металлы взаимодействуют с водой при нагревании, образуя оксид или гидроксид: 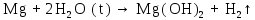 (21) (21)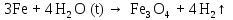 (22) (22)2.С кислотами-неокислителями. Для того чтобы определить будет ли металл взаимодействовать с такой кислотой или не будет, необходимо знать его положение в ряду напряжений металлов. Напомним, что электрохимический ряд напряжения передает восстановительную активность металлов в водном растворе. Чем левее расположен металл в этом ряду, тем большими восстановительными свойствами он обладает, т. е. легче окисляется и переходит в виде катиона в раствор, но зато труднее восстанавливается из катиона в свободное состояние. Когда речь идет о кислотах-неокислителях, то окисляться металл должен катионом водорода. Значит, с такими кислотами будут взаимодействовать металлы, стоящие в ряду напряжения до водорода. Обязательным условием является то, что образующиеся соли должны быть хорошо растворимы: 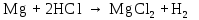 (23) (23)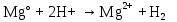 (24) (24)Pb + 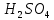 (разбавленная) → (разбавленная) → 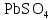 ↓ + ↓ + 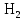 ↑ – такая реакция будет возможна, если из системы будет удаляться плохо растворимая соль сульфата свинца. 20 с. 88 ↑ – такая реакция будет возможна, если из системы будет удаляться плохо растворимая соль сульфата свинца. 20 с. 883. С кислотами-окислителями C кислотами-окислителями (H 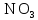 и и 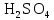 концентрированная) реагируют почти все металлы, в том числе стоящие в ряду напряжений после водорода, кроме золота, платины и некоторых других. При этом глубина восстановления металла зависит не только от концентрации кислоты, но и от активности металла: концентрированная) реагируют почти все металлы, в том числе стоящие в ряду напряжений после водорода, кроме золота, платины и некоторых других. При этом глубина восстановления металла зависит не только от концентрации кислоты, но и от активности металла: Cu + 2 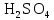 → Cu → Cu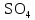 + + 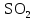 ↑+ 2 ↑+ 2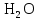 (25) (25)3Zn + 4 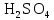 → 3Zn → 3Zn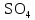 + S↓ + 4 + S↓ + 4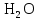 (26) (26)Cu + 4H 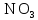 (разб.) → (разб.) → 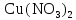 + NO↑ + 2 + NO↑ + 2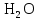 (27) (27)5Mg + 12H 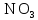 (разб.) → 5Mg (разб.) → 5Mg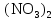 + + 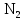 ↑ + 6 ↑ + 6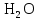 (28) (28)4Mg + 10H 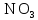 (оч. разб.) → 4Mg (оч. разб.) → 4Mg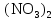 + + 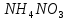 + 3 + 3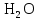 (29) (29)Cu + 4H 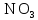 (конц.) → Cu (конц.) → Cu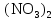 + + 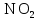 ↑ + 2 ↑ + 2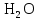 (30) (30)5Mg + 12H 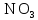 (конц.) → 5Mg (конц.) → 5Mg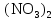 + NO↑ + 6 + NO↑ + 6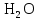 (31) (31)На окисление золота и платины у азотной кислоты «силы не хватает», эти металлы переводятся в раствор более сильным окислителем – царской водкой (смесь азотной и хлороводородной кислот). Au + H 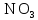 + 3HCl → Au + 3HCl → Au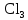 + NO + 2 + NO + 2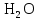 (32) (32)4.Со щелочами Металлы, которым соответствуют амфотерные гидроксиды ( 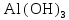 , , 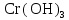 , Be , Be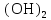 , Zn , Zn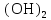 ), могут взаимодействовать с растворами щелочей: ), могут взаимодействовать с растворами щелочей: 2Al + 2NaOН + 10 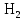 O → 2Na[Al O → 2Na[Al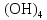 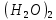 ] + 3 ] + 3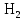 ↑ (33) ↑ (33)Zn + 2NaOН + 2 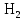 O → O → 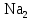 [Zn [Zn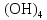 ] + ] + 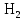 ↑ (34) ↑ (34)2Cr + 4NaOH + 3 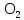 (t) → 2 (t) → 2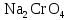 + 2 + 2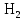 O (35) O (35)5. Реакция замещения металла с солями Для того чтобы данные окислительно-восстановительные реакции протекали, необходимо учитывать расположение металлов в ряду напряжения металлов. Более активный металл, т. е. имеющий более отрицательный электродный потенциал, может вытеснять (восстанавливает) менее активный металл: Zn + Fe 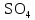 → Zn → Zn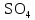 + Fe↓ (36) + Fe↓ (36) |
