Курсовая работа. Курсовая работа 3 курс. 1 Физические свойства металлов и сплавов 4 2 Химические свойства металлов и сплавов 9 1 Взаимодействие с простыми веществами 9
 Скачать 72.77 Kb. Скачать 72.77 Kb.
|
2.3 КоррозияКоррозия это разрушение твердых тел, вызываемое химическими и электрохимическими воздействиями агрессивной среды, в результате чего происходит утрата материалом его функциональных свойств. Наибольшее внимание уделяется коррозии металлов и их сплавов, так как именно она приводит к огромным убыткам за счет разрушения конструкций, необходимости замены оборудования, нарушения технологических процессов и т. д. По механизму протекания коррозию можно разделить на два вида: химическую и электрохимическую. Химическая коррозия возникает в результате воздействия на металл сухих газов и жидких неэлектролитов, в результате чего на поверхности контактирующих фаз не возникает электрохимических процессов, т. е. происходит непосредственный переход электронов от восстановителя к окислителю. Наиболее распространенным видом этой коррозии является газовая коррозия (окисление металлов при высокой температуре при отсутствии влаги). Если в результате реакции газообразного агента с металлом образуются нелетучие соединения, представляющие собой плотную пленку, процесс коррозии со временем уменьшается и может вовсе прекратиться. Примерами газовой коррозии могут служить взаимодействие металлов с кислородом воздуха, обезуглероживание сталей под действием водорода, наводороживание металлов, образование летучих комплексных соединений ([Fe 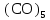 ]). ]). Процессы газовой коррозии существенно ускоряются, если в составе газовой атмосферы присутствуют диоксид углерода, соединения серы. Образующиеся карбонаты, сульфиды и сульфаты термически разлагаются, обнажая поверхность металла, а вновь образовавшаяся оксидная пленка оказывается более пористой, чем та, которая образуется в чисто кислородной атмосфере. 13 с. 30 Электрохимическая коррозия это разрушение металлов и их сплавов под действием электролитов, влажного воздуха или растворенного в воде кислорода. Механизм этого вида коррозии можно описать следующим образом. В растворах электролитов на границе металл-раствор устанавливается динамическое равновесие: Ме + m 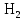 O – nē ↔ O – nē ↔  ; (37) ; (37)Ме + m 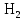 O ↔ O ↔ 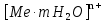 + nē. (38) + nē. (38)Из уравнения (38) видно, что в данном равновесии высвобождающиеся электроны можно считать равноправными продуктами разрушения металла. При наличии в растворе частиц, которые способны принимать электроны, протекают сопряженные реакции: n 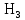 O ++ nē → 0,5n O ++ nē → 0,5n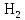 + + 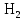 O; (39) O; (39)n 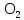 +2n +2n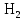 O + 4nē → 4n O + 4nē → 4n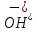 (40) (40)Протекание реакций (39) и (40) смещает равновесие реакции (37) в сторону растворения металла. При коррозии такого вида образующийся гидратированный катион металла вступает в реакцию не непосредственно с окислителем, а с другими компонентами коррозионной среды; окислителю же передаются электроны, освобождающиеся при образовании катиона. Таким образом, при электрохимической коррозии удаление атома металла из металлической кристаллической решетки осуществляется в результате двух независимых, но сопряженных электрохимических процессов: анодного (переход катионов металла в раствор) и катодного (связывание окислителем освобождающихся электронов). Следовательно, процесс электрохимической коррозии можно замедлить за счет торможения анодного процесса, а также регулируя скорость катодного процесса. Скорость электрохимической коррозии будет зависеть в том числе и от растворимости продуктов реакции (37). 22 По типу агрессивных сред, в которых протекает процесс разрушения, коррозию можно классифицировать следующим образом: газовая коррозия; атмосферная коррозия разрушение металлов при обычной температуре в атмосфере с высокой влажностью; коррозия в растворах неэлектролитов; коррозия в растворах электролитов; подземная коррозия коррозия металлических сооружений в почвах и грунтах. По своему механизму является электрохимической; биокоррозия разрушение металлов за счет продуктов жизнедеятельности микроорганизмов, которые присутствуют в воде и грунте; коррозия под воздействием блуждающих токов это электрохимическая коррозия металлов, вызванная действием блуждающих токов. Основные источники блуждающих токов в земле: шахтный электротранспорт, трамваи, метро, линии электропередачи постоянного тока по системе земля-провод. По условиям протекания коррозионного процесса различаются следующие виды коррозии: контактная коррозия это разрушение металлических изделий в результате контакта двух металлов с различным значением электродных потенциалов. Такой вид коррозии также может наблюдаться и при контакте изделий из одного и того же металла, но соединенных при помощи пайки либо сварки; коррозия при неполном погружении конструкции; коррозия при полном погружении конструкции; коррозия при переменном погружении конструкции; коррозия при трении; межкристаллитная коррозия разрушение металла происходит вдоль границы зерен; коррозия под напряжением имеет место при одновременном воздействии коррозионноагрессивной среды и механических напряжений; концентрационная коррозия. По характеру разрушения разграничиваются: сплошная коррозия это разрушение всей поверхности металла: равномерная; неравномерная; избирательная; локальная (местная) коррозии неравномерное разрушение поверхности металла: пятнами; язвенная; точечная; сквозная; межкристаллитная. При локальной коррозии происходит глубокое поражение металла при небольшом поверхностном разрушении 17. |
