Биохимия. 1. Хімічна природа та будова ферментів. Активний, регуляторний (алостеричний) центри ферментів
 Скачать 155.92 Kb. Скачать 155.92 Kb.
|
|
1.Хімічна природа та будова ферментів. Активний, регуляторний (алостеричний) центри ферментів. Ферменти — біологічні каталізатори білкової природи, які синтезуються в клітинах живих організмів та забезпечують необхідні швидкість і координацію біохімічних реакцій, що становлять обмін речовин (метаболізм). Розділ біохімії, що вивчає структуру, властивості та механізми дії ферментів, називається ензимологією. Властивості ферментів; - ферменти підвищують швидкість перебігу біохімічних реакцій, але не входять до складу кінцевих продуктів реакції; – забезпечують перебіг лише тих біохімічних реакцій, якіможливі, виходячиіззаконів термодинаміки; – прискорюють швидкість якпрямої, так ізворотної реакції перетворення субстрату, не змінюючи константи рівноваги (Кр ) реакції та зменшуючи термін часу до досягнення стану рівноваги (або стаціонарного стану у відкритійметаболічній системі); – протягом реакції фермент певним чином взаємодіє із субстратом, що перетворюється, але до складу кінцевих продуктів реакції не входить. Під час перебігу біохімічної реакції, що каталізується, відбувається циклічнийпроцес, в рацієюферменту; – ферменти є високоспецифічними каталізаторами, За своєю природою всі ферменти - білки. Доказом білкової природи ферментів є ряд їх фізико-хімічних властивостей, характерних для білків. Ферменти так само, як і білки, у розчині знаходяться в колоїдному стані, є амфотерними електролітами. При додаванні нейтральних солей, особливо сульфату амонію, ферменти випадають в осад, тобто висолюються. Під впливом високої температури, сильних кислот і лугів, солей важких металів і інших чинників, що викликають денатурацію білків, ферменти денатурують і втрачають каталітичні властивості. Важливим доказом білкової природи ферментів є розщеплення їх пепсином і трипсином - ферментами, що розщеплюють білки. Ферменти як речовини білкової природи діляться на прості і складні, або, як їх ще називають, ферменти-протеїни і ферменти-протеїди. Ферменти-протеїни складаються тільки з амінокислот. У більшості з них до складу молекули входить один поліпептидний ланцюг, який має характерну вторинну структуру у вигляді α- і β-спіралей (іноді вони мають третинну і четвертинну структури). Ферменти-протеїди складаються з двох частин: термолабільної білкової і термостабільної небілкової. Білкова частина складного ферменту називається апоферментом, небілкова - кофактором. Комплекс кофактора з апоферментом називається холоферментом. Зв'язок між апоферментом і кофактором у молекулах складних ферментів неоднаковий. У багатьох випадках кофактори слабо зв'язані з апоферментом, з'єднуються з ним тільки під час ферментативної реакції і легко відокремлюються в процесі діалізу. У цьому разі кофактор називають коферментом Спеціалізовані центри ферментів. Молекули ферментів мають великі розміри (загалом більші, ніж субстрати) і складну просторову конфігурацію. У молекулі ферменту розрізняють три спеціалізованих центри: активний, субстратзв'язуючий і алостеричний. При цьому кожна частина молекули строго спеціалізована, тобто виконує певну роль. Активний центр - це динамічне утворення. У простих ферментів він являє собою унікальне об'єднання залишків певних амінокислот, які розміщені в різних місцях поліпептидного ланцюга молекули білка. Такими залишками є радикали гістидину, серину, аргініну, триптофану, цистеїну, тирозину, аспарагінової і глутамінової кислот. У молекулах простих ферментів активний центр виникає в результаті того, що поліпептидний ланцюг молекули білка набуває такої конфігурації, за якої радикали зазначених вище амінокислот з'являться поруч. Утворюється своєрідна “кишеня”, в якій відбуваються каталітичні перетворення субстрату. Такою конфігурацією, як правило, є третинна структура поліпептидного ланцюга. Таким чином, активний центр ферментів 6 6 протеїнів виникає в той момент, коли білкова молекула набуває характерної для неї третинної структури. Тому зміна цієї структури може викликати деформацію або руйнацію активного центру й ослаблення ферментативної активності. 2.Прості та складні білки-ферменти, простетичні групи складних білків-ферментів (кофактори, коферменти). Залежно від хімічного складу ферменти прийнято поділяти на прості та складні. Прості ферменти — прості білки, побудовані лише із залишків амінокислот. Вони представлені одним або кількома поліпептидними ланцюгами і при гідролізі розщеплюються до амінокислот. Складні ферменти — білки, молекула яких має небілкову частину, зокрема, кофермент. (двокомпонентні) ферменти крім білкової частини містять групу небілкової природи – кофактор. Усі кофактори ферментів поділяються на коферменти, простетичні групи та активатори. Простетичні групи — підклас кофакторів, відрізняються від коферментів постійним зв'язком з білком, на відміну від тимчасового зв'язку коферментів. У ферментах простетичні групи зазвичай залучені в активні ділянки. Одним з прикладом простетичних груп є гем в складі гемоглобіну. Простетичні групи зв’язані з апоферментом ковалентними зв’язками (ФМН, ФАД, ТПФ). Коферменти зв’язані з білковою частиною ферменту слабкими електростатичними або вандерваальсівськими силами (НАД+, НАДФ+, ліпоєва кислота, кофермент А). До активаторів ферментів належать такі кофактори, які прискорюють реакції, що каталізуються ферментами. Активаторами часто є іони металів – магнію, цинку, марганцю, кобальту та ін. 3. Класифікація коферментів за хімічною природою, типом реакції, яку вони каталізують. Найбільш поширені коферменти: похідні вітаміну В1, В2, В3, В5, В6, В9, В12, Н та похідні ліпоєвої кислоти. Класифікація коферментів за хімічною природою: невітамінні; вітамінні; вітаміноподібні. До невітамінних коферментів належать: гем, глутатіон, нуклеотиди. До вітаміноподібних коферментів належать: ліпоєва кислота, коензим Q, хінонові коферменти, карнітин та ін. 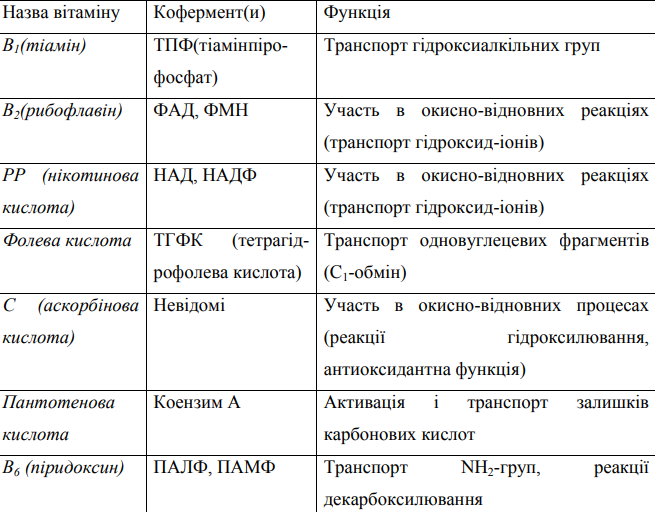 • B1 (тіамін) • B2 (рибофлавін) • В3 (ніацин) • B4 (холін, аденін) • В5 (пантотенова кислота) • В6 (піридоксин, піридоксаль) • B7 (біотин) • B8 (аденозин, інозитол) • В9 (фолієва кислота) • В10 (параамінбензойна кислота) • В11 (левокарнітин) • В12 (ціанокобаламін) • B13 (оротова кислота) • В14 (Пирролохинолинхинон) • В15 (пангамова кислота) • В16 (Диметилглицин) • В17 (амігдалпін) 4.Властивості ферментів як біокаталізаторів: залежність активності ферментів від температури; залежність активності ферментів від рН середовища; специфічність дії ферментів та її види. 1. Активність ферментів. Характерною особливістю дії ферментів є їх висока каталітична активність. Вона значно вища, ніж неорганічних каталізаторів. Активність ферментів характеризується швидкістю хімічних реакцій, які вони каталізують. Активність ферментів виражають в одиницях, які називаються каталами (скорочено кат.). Катал – це каталітична активність, яка здійснює хімічне перетворення 1 моль субстрату за 1 с. 2. Вплив температури на активність ферментів. Ферменти – термолабільні речовини. Зміна температури зумовлює зміну їх активності. Так, підвищення температури на 10 оС прискорює швидкість хімічних реакцій приблизно в 2 рази. Однак ферменти є білками і підвищення їх каталітичної активності відбувається доти, поки не починається денатурація білка. Денатурація ферменту викликає руйнування його нативної структури, а це, в свою чергу, зумовлює втрату ферментативної активності. Температура, при якій фермент має максимальну активність, називається оптимальною температурою ферменту. Для більшості ферментів, виділених з організму людини і тварин, оптимальна температура коливається від 37 до 45 оС. 3. Вплив рН середовища на активність ферментів. Активність ферментів досить чутлива до кислотності середовища. Вважають, що вплив концентрації водневих іонів на активність ферментів пов’язаний насамперед з їх дією на активні центри ферментів. Залежно від рН середовища активний центр ферменту може бути в різній мірі іонізований, що впливає на формування активного фермент-субстратного комплексу. 4. Специфічність дії ферментів. Під специфічністю дії ферментів розуміють відповідну спрямованість їх впливу на певний субстрат, групу субстратів, близьких за своїми властивостями, або певний тип зв’язку. Залежно від цього розрізняють абсолютну, відносну (групову) і просторову (стереоізомерну) специфічність ферментів. Абсолютна специфічність. Ферменти, які каталізують лише одну реакцію і діють на один точно визначений субстрат, мають абсолютну специфічність (уреаза каталізуює гідролітичне розщеплення сечовини). Групова специфічність характерна для ферментів, які діють на різні субстрати, що мають однаковий тип зв’язку (естерази каталізують гідролітичне розщеплення зв’язку складноефірного типу). Стереоізомерна (просторова) специфічність ферментів виявляється тоді, коли вони діють на оптично активні сполуки, або сполуки, для яких характерна цис- і транс-ізомерія (наприклад, це такі ферменти, які каталізують окислення тільки L-амінокислот або тільки D-амінокислот). +Активність ферментів часто змінюється під дією різних хімічних сполук, що знаходяться в середовищі. Речовини, які підвищують активність ферментів, називаються активаторами, а ті, що знижують їх активність, - інгібіторами. 5.Номенклатура ферментів та їх класифікація за типом реакції. Зазвичай фермент іменують за типом реакції, яку він каталізує, додаючи суфікс -аза до назви субстрату (наприклад лактаза — фермент, що бере участь в перетворенні лактози). Таким чином, у різних ферментів, що виконують одну функцію, буде однакова назва. Такі ферменти розрізняють по інших властивостях, наприклад, по оптимальному pH (лужна фосфатаза) або локалізації в клітині (мембранна аденозинтрифосфатаза). Тривіальні назви- пепсин (від грецьк. «травлення»), папаїн- (від назви дерева, із соку якого одержували фермент)., Раціональна номенклатура- ферменти називають за субстратом, на який вони діють з додаванням суфікса - аз(а). З'явились назви амілаза, ліпаза, уреаза та ін.{\898 р. Дюкло). Систематична або наукова номенклатура- назви ферментів складаються з двох частин. Перша частина вказує на назву субстрату, на який діє фермент, а друга - на природу хімічної реакції, яку він каталізує, з додаванням суфікса - аз(а). Наприклад, фермент, який каталізує реакцію гідролізу дипептиду гліцин - лейцину, має назву гліцин-L-лейцин-гідролаза.Якщо при ферментативному перетворенні субстрату відбувається перенесення будь-яких хімічних груп з однієї сполуки на іншу, то в номенклатурі ферменту називають обидві речовини, розділяючи їх двома крапками. Наприклад, лактатдегідрогеназа за науковою номенклатурою L-лактат: НАД-оксидоредуктаза. Технічна номенклатура(існує в межах СНД) - назва ферментів складається з трьох частин. У першій частині: наводять назву субстрату, що перетворюється, та назву мікроорганізму, який синтезує фермент; у другій - тип культивування мікроорганізму; у третій - ступінь очищення ферментного препарату. Наприклад, амілосубтилін Г10х. За типом реакцій, що каталізують, ферменти поділяються на 6 класів згідно з ієрархічною класифікацією ферментів (КФ або EC — EnzymeCommissioncode). Класифікацію було запропоновано Міжнародним союзом біохімії і молекулярної біології (InternationalUnionofBiochemistryandMolecularBiology). Кожен клас містить підкласи, так що фермент описується сукупністю чотирьох чисел, розділених крапками. Наприклад, пепсин має код КФ 3.4.23.1. Перше число описує клас реакцій, що каталізує фермент:[5] КФ 1: Оксидоредуктази — ферменти, що каталізують окиснення або відновлення. Приклад: каталаза, алкогольдегідрогеназа КФ 2: Трансферази — ферменти, що каталізують перенесення хімічних груп з однієї молекули субстрата на іншу. Серед трансфераз особливо виділяють кінази, що переносять фосфатну групу, як правило, з молекули АТФ. КФ 3: Гідролази — ферменти, що каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеїнліпаза. КФ 4: Ліази — ферменти, що каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів. КФ 5: Ізомерази — ферменти, що каталізують структурні або геометричні зміни в молекулі субстрату. КФ 6: Лігази — ферменти, що каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ. Приклад: ДНК-полімераза. Кф7: Транслокази ферменти що переносять молекули Ферменти є каталізаторами, тому вони прискорюють як пряму, так і зворотну реакції, тому, наприклад, ліази здатні каталізувати і зворотну реакцію — приєднання по подвійних зв'язках. Тим не менш напрямок реакції може залучати кілька субстратів і бути таким, що зворотна реакція практично не відбувається. |
