Фиты. 1. Исторические этапы развития фитохимии и организации производства фитопрепаратов
 Скачать 3.58 Mb. Скачать 3.58 Mb.
|
|
51. Смолы. Их характеристика и методы их удаления. Смолы являются продуктами вторичного метаболизма. Они образуются в растениях как побочный продукт при обмене веществ и выполняют защитную функцию. Подобно эфирным маслам (часто вместе с ними) они содержатся в межклеточных пространствах, вместилищах или смоляных ходах. При повреждении растения смолы выделяются, заполняя повреждённый участок ткани и предотвращая испарение влаги, а также проникновение микроорганизмов внутрь. Смолы обладают бактерицидным действием. В растении смолы часто находятся в смеси с камедями или эфирными маслами. Физические свойства. Смолы обычно растворимы в спирте и некоторых других органических растворителях (эфире, дихлорэтане, ацетоне, хлороформе и т.д.), не растворимы в воде и не перегоняются с водяным паром. Смолы — очень устойчивые соединения (не про¬горкают, не загнивают, не портятся), при продолжительном хра¬нении на свету самоокисляются и становятся мало растворимыми. К типичным смолам относят янтарь (смолу хвойных деревьев). По консистенции различают смолы жидкие, мягкие и твёрдые. Химический состав. Природные смолы, подобно другим продук¬там, полученным из растений, представляют собой смеси разнород¬ных веществ. В смолах преобладают гидроциклические и аромати-ческие соединения (часто являющиеся продуктами окисления и полимеризации эфирных масел), подразделяемые на четыре группы. -Смоляные спирты, или резинолы, содержащие одну или несколько гидроксильных групп. Смоляные спирты находятся в смолах в свободном состоянии, иногда в виде эфиров. В качестве спиртов в смолах присутствуют как дитерпеновые циклические алкоголя, так и тритерпеновые спирты с тридцатью углеродными атомами. -Смоляные, или резиноловые, кислоты — типичные карбоксильные производные дитерпенов. Они обладают явно выраженным кислым характером и могут образовывать хорошо кристаллизующиеся соли. Смоляные кислоты преобладают в смолах в свободном состоянии, Сложные эфиры — резины — образуются соединением смоляных кислот и спирта, могут соединяться с ароматическими кислотами (бензойной, салициловой и др.). -Индифферентные вещества — резены — в химическом отношении очень стойкие, выдерживают действие щёлочей и кислот (в том числе сильных). Предположительно резены'— углеводороды сескви- и политерпенового ряда. Резены придают особые свойства смолам: возможность длительного хранения, химическую устойчивость. Так, янтарь содержит в составе более 70% резенов и хранится несколько веков без изменений. В технике смолы используют в качестве лаков, пластмасс и т.д. В медицине применяют наружно некоторые смолыбальзамы (пихтовый бальзам, живицу). При пероральном приёме смолы могут вызывать побочные явления: тошноту, боли в желудке или кишечнике, поэтому они как балластные вещества обычно подлежат удалению. Методы удаления -Смолы вместе с жироподобными веществами удаляют путём обработки растительного сырья перед экстракцией лекарственных веществ органическими растворителями. -Из вытяжки смолоподобные вещества, как и липиды, можно осадить при замене органического растворителя водой. В воду переводят соединения, которые необходимо выделить из данного сырья (например, алкалоиды, гликозиды), а смолы как побочный продукт отделяют на стадии очистки. 52. Белки. Методы их удаления. Белки — высокомолекулярные азотистые органические вещества, их молекулярная масса колеблется от нескольких тысяч до нескольких миллионов. В растительном организме белки участвуют в фотосинтезе различных веществ, белки-ферменты обусловливают направ¬ление и скорость химических превращений, гормоны обеспечивают регуляцию процессов жизнедеятельности клетки. Белки составляют основу растительных тканей (покровных и др.), входят в состав кле¬точных мембран, а также определяют защитные функции раститель¬ного организма. По химическому составу белки разделяют на простые (протеины) и сложные (протеиды). Простые белки (полипептиды) состоят только из аминокислот, соединённых между собой пептидными связями в одну или несколько полипептидных цепей. Каждая полипептидная цепь содержит на одном конце свободную аминогруппу, на другом — карбоксильную группу. Методы удаления белков 1.Тепловая денатурация. Типичный пример денатурации белка - его свёртывание (коагуляция) при воздействии повышенной темпе¬ратуры С ростом температуры тепловая энергия может стать больше энергии нековалентных связей в молекуле белка и вызвать их разрыв с возникновением новой конфигурации. 2.Отстаивание в прохладном месте. При понижении температуры белки выпадают в осадок. Этот метод широко применяют в произ¬водстве настоек и экстрактов. 3.Дегидратация. Осаждение белка из раствора можно вызвать действием органических растворителей (этанола, метанола, ацетона), которые должны смешиваться с водой. Растворители вызывают разрушение гидратной оболочки вокруг белковой молекулы (глобулы), способствующей устойчивости белковых растворов и препятствую- цей осаждению белка. Белковые молекулы содержат на своей поверх- юсти гидрофильные группы. Вокруг молекул ориентируются молекулы воды. Если отнять у белковых молекул связанные с ними молекулы воды и уменьшить их гидратацию, они начнут слипаться, образуя более крупные частицы белка, и начнут оседать из раствора в виде осадка. То есть возникает коагуляция белка. 4 Высаливание - осаждение белков из раствора при добавлении солей. 5.Осаждение солями тяжёлых металлов. В производстве очищенных (новогаленовых) препаратов для удаления белков из вытяжек применяют растворы тяжёлых металлов (уксусно-кислого свинца, гидроксид меди и др.), образующие с белками нерастворимые соединения. 6.Диализ. Для отделения лекарственных веществ от белков используют коллоидный характер их водных растворов (диаметр бел¬ковых частиц в растворе превышает 0,001 мкм). Белки не проникают через поры полупроницаемых мембран (например, пергаментные плёнки), что используют для разделения содержащихся в первичной вытяжке ионизированных и высокомолекулярных веществ с помощью диализа или для ускорения процесса методом электродиализа при производстве алкалоидов. 7. Создание изоэлектрической точки. Аминокислоты, входящие в состав белков, в связи с наличием карбоксильной и аминной групп обладают амфотерными свойствами. Изоэлектрическая точка — значение рН среды, при котором аминокислота нейтральна. В изоэлек¬рической точке белковые молекулы имеют, как правило, наименьшую растворимость и склонны к ассоциации. 53. Сиропы. Классификация. Технология простого сахарного сиропа и холосаса СИРОПЫ- это насыщенные, густые, прозрачные водные растворы сахара лекарственными препаратами или без них, предназначенные для внутреннего применения. В зависимости от состава сиропы имеют различные вкус, часто ароматный запах и относительно высокую плотность (1,28-1,37 г/смз). С медицинской точки зрения сиропы делятся на две группы - ВКУСОВЫЕ, которые применяются как корригирующие средства для исправления вкуса, запаха, а иногда и цвет лекарства, а также ЛЕКАРСТВЕННЫЕ, содержащие биологически активные вещества, придающие им определенную терапевтическую ценность (сиропы с витаминами, антибиотиками, антигистаминными и противорвотными препаратами, транквилизаторами, противокашлевыми средствами и др.). Вкусовые сиропы сами по себе лекарственными средствами не являются, но служат основной для приготовления лекарственных сиропов. В группу вкусовых сиропов относятся простой сахарный сироп и плодово-ягодные сиропы (вишневый, малиновый и др.), которые готовят растворением сахара в перебродивших ягодных соках, или смешением пищевых экстрактов высшего качества с сахарным сиропом. Производство плодово-ягодных сиропов в настоящее время передано пищевой промышленности. Лекарственные сиропы являются составными компонентами жидких лекарств для детей как отхаркивающие и смягчающие кашель средства при бронхите, коклюше (Пертусин, сироп алтейный, солодковый), как легко слабительное (сироп ревенный, солодковый), при анемии (сироп алоэ с железом), при гипо- и авитаминозах витамина С (Сироп шиповника). В соответствии с методом приготовления можно выделить сиропы, приготовленные путем добавления лекарственных веществ (настоек, экстрактов к сахарному сиропу) и сиропы, получаемые растворением сахара в водным растворе лекарственного вещества, растительных соков, вытяжках из свежего или высушенного растительного сырья). Оптимальная концентрация сока в простом сахарном сиропе составляет 60-64 % (процент по массе). Сироп с концентрацией сахара выше 66 % (при хранении при небольшом охлаждении засахаривается, образуя крупные трудно растворимые кристаллы сахарозы). Сироп с концентрацией сахара ниже 60 % подвергается брожению и скисанию. Хранят сиропы в сухих, наполненных доверху в хорошо закупоренных флаконах, в прохладном, защищенном от света месте. Сироп сахарный готовится в реакторах с паровой рубашкой и якорной мешалкой. На 64 кг сахара рафинированного с 99,9% сахарозы в перерасчете на сухое вещество берется 36 литров воды очищенной. Растворение проводят добавлением сахара частями к кипящей воде при постоянном перемешивании мешалкой. После полного растворения сахара сироп дважды доводят до кипения по 10 мин каждое. Образующуюся пену (продукт коагуляции слизи, белков и других примесей) удаляют. Общее время изготовления не должно превышать 1 часа, чтобы предотвратить инверсию и карамелизацию сахара. Фильтруют в горячем состоянии. Концентрация сахара должна быть по массе 60-64%. В таком растворе достаточно высокое осмотическое давление и микроорганизмы в нем быстро обезвоживаются. Сиропы с содержанием сахара ниже 60% не обладают бактериостатическим действием и подвергаются бродильным процессам. Концентрация более 64% вызывает кристаллизацию при охлаждении и хранении. Готовый продукт должен быть прозрачным и бесцветным, без запаха, густой консистенции, нейтральной реакции, с плотностью 1,301-1,313, показателем преломления 1,451-1,454. Проверяется цветность, отсутствие патоки, инвертных Сахаров, хлоридов, сульфатов, кальция и тяжелых металлов. Упаковывают сиропы в стерильные флаконы, наполненные доверху и плотно закупоривают пробками. Хранят в прохладном, защищенном от света месте. Для предотвращения инверсии предложен способ получения сиропа без нагревания методом перколирования. В этом случае сироп получают бесцветным и без инвертного сахара. Холосас.Измельченные плоды шиповника экстрагируют водой в батарее из 5 экстракторов. Экстракт фильтруют, подвергают ферментационному брожению, вновь фильтруют. Упаривают до определенной консистенции, в аппарат подают сахар, после его растворения, смесь вновь сгущают до густой консистенции, фильтруют в нагретом состоянии под давлением и расфасовывают. Получают жидкость сиропообразной консистенции, темно-коричневого цвета, кисло-сладкого вкуса, своеобразного запаха. Органических кислот в перерасчете на яблочную должно быть не менее 1,85%. Применяется внутрь при холецистите и гепатите. Кроме сахарозы, в отдельных случаях корригирующий эффе достигается 70% водным раствором сорбита, ксилита и других веществ, но в этом случае необходимо такой раствор загустить, добавляя натрия альгинат, МЦ и другие ВМС и использовать консерванты, например смесь нипагина и нипазола. 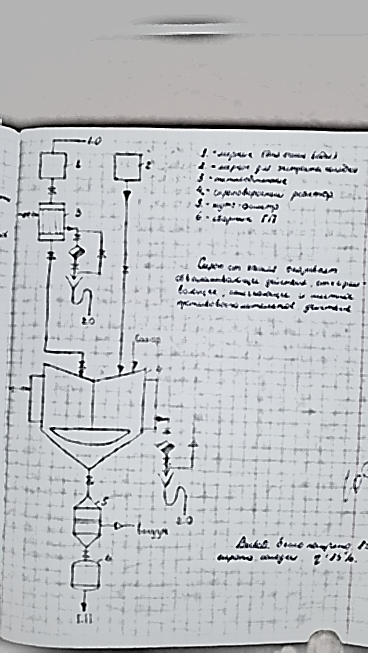 54. Физико-химические свойства алкалоидов. Основные свойства алкалоидов обусловлены наличием в их составе аминного азота, в соединениях подобного типа обычно трёхковалентного. В связи с тем, что у азота в образовании связей участвует три электрона на внешней орбите, в свободном состоянии остаётся пара электронов («неподелённая электронная пара»). Согласно теории американского учёного Г.Н. Льюиса, основание (В) — атом, молекула или ион, имеющий по крайней мере одну пару валентных электронов, ещё не принимающую участия в ковалентной связи, а кислота (А) - частица, в которой хотя бы один атом обладает вакантной орбиталью, способной принять пару электронов. Типичная кислотно-основная реакция: А + В: А:В. Соединение А: В можно назвать координационным соединением (координационная связь возникает за счёт пары электронов одного атома), или кислот¬но-основным комплексом. Частицы «А» называются кислотой Льюиса. Часто её называют акцептором, а основание — донором электронов. При обсуждении скоростей реакций, изучении их кинетики «А» называют электрофилом, а «В» — нуклеофилом. Алкалоиды могут иметь различную основность в зависимости от радикалов у атома азота и в общей структуре алкалоидов. Чем больше алифатических радикалов у атома азота, тем более сильными основаниями являются алкалоиды, а ароматические радикалы уменьшают основность алкалоидов. Например: NH2(C6H5) NH(C6H5)2 N(C6H5)3. Подобное влияние радикалов на основность алкалоидов связано с тем, что алифатические группировки электронодонорные и, следовательно, усиливают электроотрицательность азота и увеличивают у него плотность электронов, а ароматические, карбонильные, карбок¬сильные и другие — акцепторные, они оттягивают электроны и уменьшают основность. В воде алкалоиды находятся как в виде свободного основания, так и в виде гидрата, в той или иной степени диссоциированного в зависимости от основности соединения. R3N + НОН R3N+H + ОН" Растворитель (вода) обладает как кислотными, так и основными свойствами: Н20 + Н20 = Н30+ + ОН". Алкалоид, проявляя себя основанием в воде, взаимодействует с протоном по следующему уравнению: R3N + Н20 = R3NH+ + ОН". Приведённая реакция обратима, одновременно протекает следу¬ющий процесс: R3NH+ + Н20 = R3N + Н30+. Приведённые уравнения демонстрируют, что вода ведёт себя как кислота и как основание. В чистой воде и любом водном растворе (при постоянной температуре) произведение активностей (концентраций) ионов водорода и гидроксила постоянно и равно 1x10"14 (- lgKw = 14). Исходя из изложенного, силу основности соединений можно вы¬ражать константой кислотности сопряжённой кислоты, обратно про¬порциональной константе основности. С кислотами алкалоиды образуют соли. Механизм солеобразования — действие протона на неподелённую пару электронов азота с образованием координационной и ионной связей, т.е. возникнове-нием семиполярной (полуполярной) связи. Происходит полное при¬соединение молекулы кислоты с образованием соли и последующей диссоциацией на катион и анион. Н О R3N: + HCI —► R3N:+HCI_4=^ [R3NH]++ CI" Чем выше основность алкалоидов, тем легче они образуют соли. Слабые основания солей не образуют, например кофеин (К = 4,1х10"12). Различие основности алкалоидов часто используют в технологии для разделения их смеси путём дробного подщелачивания водного раст¬вора солей и избирательной экстракции оснований при различных значениях рН органическим растворителем, не смешивающимся с водой. Алкалоиды в растениях содержатся в виде солей органических кислот. Неорганические основания (NaOH, КОН, NH4OH), а также карбонаты и гидрокарбонаты натрия и калия переводят алкалоиды из солей в основания, что широко применяют в технологии выделения алкалоидов из водных извлечений. [AlkHJA + NaOH NaA + Alk + H20, 2[AlkH]A + Na2C03 -» 2NaA + 2А1к + С02 + Н20. С некоторыми солями тяжёлых металлов, органическими и неорганическими веществами кислотного характера алкалоиды образуют сложные комплексные соединения, плохо растворимые в воде, что используют для качественного и количественного анализа алкалоидов. ® Реактив Вагнера (раствор KJ и J2) в кислой среде образует с алкало¬идами, находящимися в растворах, соединения Alk(HJ)x(J2)y, выпа¬дающие в виде бурого осадка, в Реактив Майера (HgJ2 + 2KJ = K2HgJ4) образует с растворами алкалоидов жёлтый осадок. ® Реактив Драгендорфа (KBiJ4) позволяет получить с растворами ал¬калоидов оранжевый осадок, что часто используют при проявлении хроматограмм. »Алкалоиды образуют осадки с растворами фосфорно-вольфрамовой кислоты [(H3P04- 12W03 2Н20), реактив Щейблера], фосфорно- молибденовой кислоты [(Н3Р0412МО03-2Н20), реактив Зонненш- тейна]. Чувствительность реакций высока, например они позволяют выявить хинин в разведении 1:150 ООО. • Для обнаружения и идентификации алкалоидов широко используют растворы пикриновой кислоты (2,4,6-тринитрофенола), образующей характерные жёлтые кристаллические осадки. 55. Методы регенерации спирта из шрота. Ректификация спирта. Утилизация шрота. На практике спирто-водные растворы готовят исходя не из абсо¬лютного этилового спирта, а из спирта-ректификата, являющегося азеотропом (нераздельно кипящей смесью постоянного состава). Это максимальная концентрация спирта, получаемая при укреплении спирто-водных растворов на ректификационных колоннах. На спирт ректификованный (ректификат) действует ГОСТ Р 51652-2000. Абсолютный спирт получают из ректификата путём его обезвожи¬вания при добавлении металлического натрия или безводного каль¬ция хлорида с последующей перего Регенерация (рекуперация) спирта из отработанного растительного материала В процессе экстракции растительный материал набухает, по¬глощая от одной до трёх частей извлекателя. Частично извлекатель можно удалить из шрота методом прессования, однако в клетках ра-стительного материала остаётся много извлекателя. Регенерировать спирт также можно обработкой растительного материала водой. Водно-спиртовые извлечения, полученные путём промывания отжатого материала водой, после получения настоек на 70% спирте содержат 10-20% спирта и значительное количество балластных веществ. В этом случае получаются мутные растворы, обладающие запахом ле-тучих веществ растительного материала, портящиеся при хранении (вплоть до загнивания). Средний выход спирта при регенерации указанным методом составляет приблизительно 50% количества спирта, остающегося в шроте, 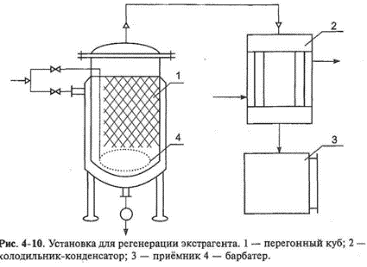 Наиболее часто регенерацию извлекателя производят методом отгонки путём пропускания через рубашку глухого пара, а затем — при обработке растительного материала острым паром. Для этого ис-пользуют установку (рис. 4-10), состоящую из перегонного куба (1),барбатера (4), конденсатора (2) и приёмника (3). Острый пар подают обычно через барбатер снизу. Отгон спирта, полученный при обработке растительного материала острым паром, представляет собой прозрачную жидкость со слабым запахом. Содержание спирта в нём составляет около 55-65%. Регенерируют таким методом около 90¬95 % спирта, остающегося в растительном материале. Кафедрой процессов и аппаратов СПХФА разработана и внедрена другая схема регенерации спирта из отходов растительного сырья В этой установке отходы растительного сырья также загружаются в аппарат (1), но «острый» пар подают сверху вниз без обогревания «глухим» паром. Смесь пара и жидкости из нижней части аппарата поступает в разделительный сосуд (2), откуда пар направляют в рек¬тификационную колонну (3) при высокой концентрации спирта в паре через вентиль (5), а при низкой концентрации — через другой 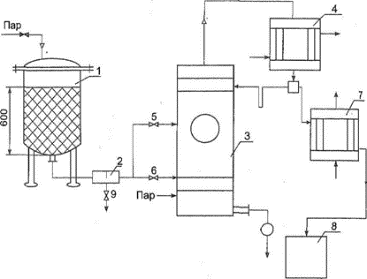 Установка для регенерации экстрагента, разработанная в СПХФА, 1 — перегонный куб; 2 — разделительное устройство; 3 — ректификацион¬ная колонна; 4 — дефлегматор; 5,6 — вентили; 7 — холодильник; 8 — сбор¬ник; 9 — вентиль. вентиль (6), укреплённый спирт конденсируется в дефлегматоре (4), холодильнике (7) и поступает в приёмник (8). ® Новая установка по мощности заменила два аппарата старой кон¬струкции. Жидкая фаза (отжим) из разделительного сосуда содержит лекарственные вещества, поэтому целесообразно отводить её через вентиль (9) в сборник для последующей обработки. ® При высоте слоя обрабатываемого растительного материала около 600 мм требуемое избыточное давление греющего пара должно составлять 0,1-0,15 атм. При этом процесс отгонки за счёт прессова¬ния растительного материала ускоряется в 2 раза и более (вместо 7 ч протекает в течение 3 ч), благодаря наличию ректификационной установки получают более концентрированный спирт. Выход его уве-личивается на 2-4 % (по сравнению с предыдущим методом). Уста¬новку можно использовать и без ректификационной колонны. Регенерацию ценных растворителей из отходов после экстракции можно производить в тех же экстракторах. Отгонка растворителя непосредственно из экстракторов имеет преимущества, поскольку перегрузка сырья связана с большими затратами труда, потерями растворителей вследствие их частичного испарения и загрязнени¬ем воздуха помещения парами растворителя, что исключено при регенерации спирта непосредственно из экстракторов. Однако вследствие большей высоты слоя растительного материала, его большего сопротивления и конденсации пара в слое (при отсутствии обогревательных рубашек) увеличивается длительность отгонки. ® При подаче острого водяного пара в подобные установки снизу вверх для уменьшения количества конденсата в слое отходов экстракторы снабжают греющими рубашками или применяют пар с темпера-турой 170-240 °С. « Отгонку извлекателей непосредственно из экстракторов можно про¬изводить и при подаче острого пара сверху на слой материала, но с использованием пара с избыточным давлением 0,4 атм. (Слой рас-тительного материала выдерживает указанное давление без изме¬нения структуры.) В этом случае можно применять экстракторы без рубашек, длительность отгонки будет приблизительно равна 10 ч. Экстракторы обычно не рассчитаны на работу под давлением, поэтому перед их переоборудованием для отгонки обязательны про¬верка расчётом требуемой толщины стенки и фланцев экстракто¬ра и (при необходимости) их усиление. Кроме того, на фланцевых соединениях следует установить устройства, предохраняющие от вырыва прокладок. Перед сдачей в эксплуатацию экстракторы дол¬жны быть подвергнуты гидравлическому испытанию. |
