1. Карбонильные соединения альдегиды и кетоны. Строение карбонильной группы. Номенклатура, изомерия. Способы получения карбонильных соединений. Способы получения карбонильных соединений
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
|
1. Карбонильные соединения- альдегиды и кетоны. Строение карбонильной группы. Номенклатура, изомерия. Способы получения карбонильных соединений. Способы получения карбонильных соединений. 1) Озонолиз алкенов – Л Озонолиз состоит из двух последовательных превращений.  Механизм реакции 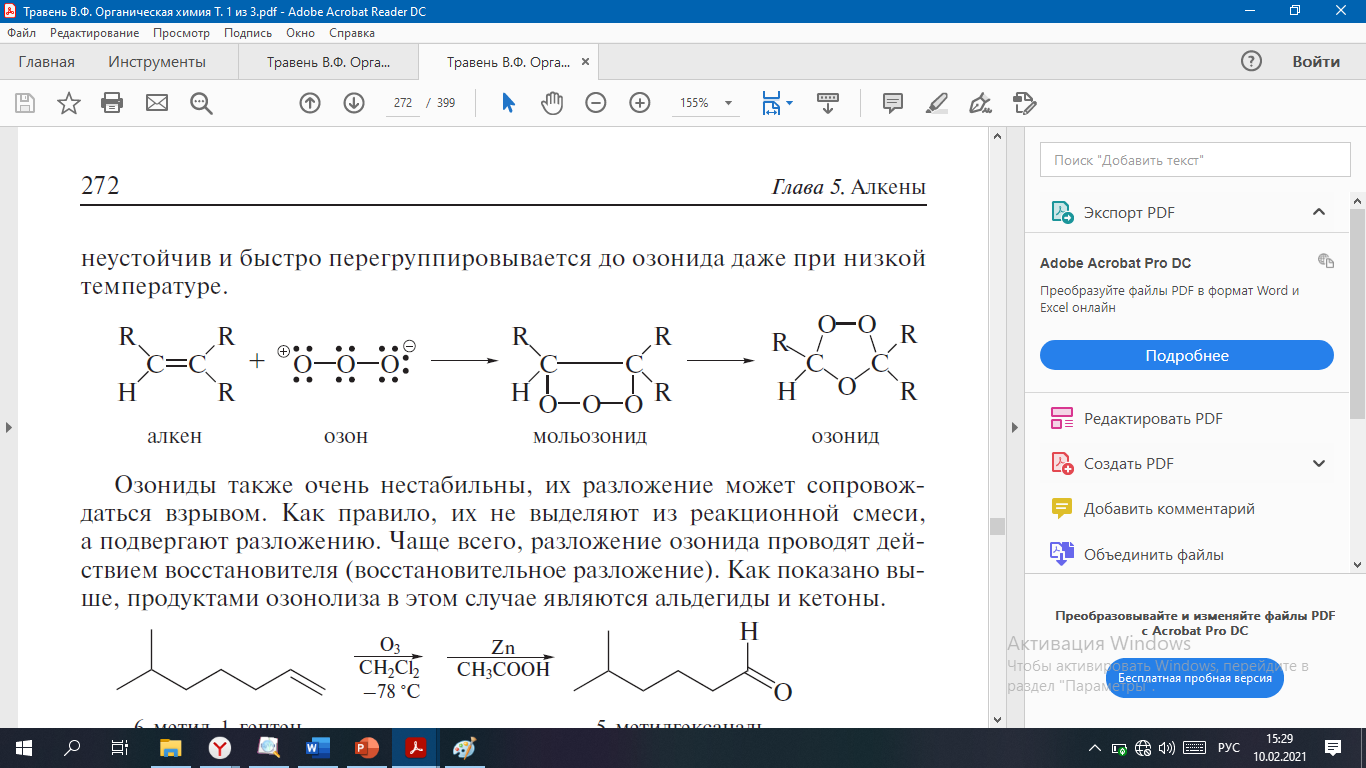 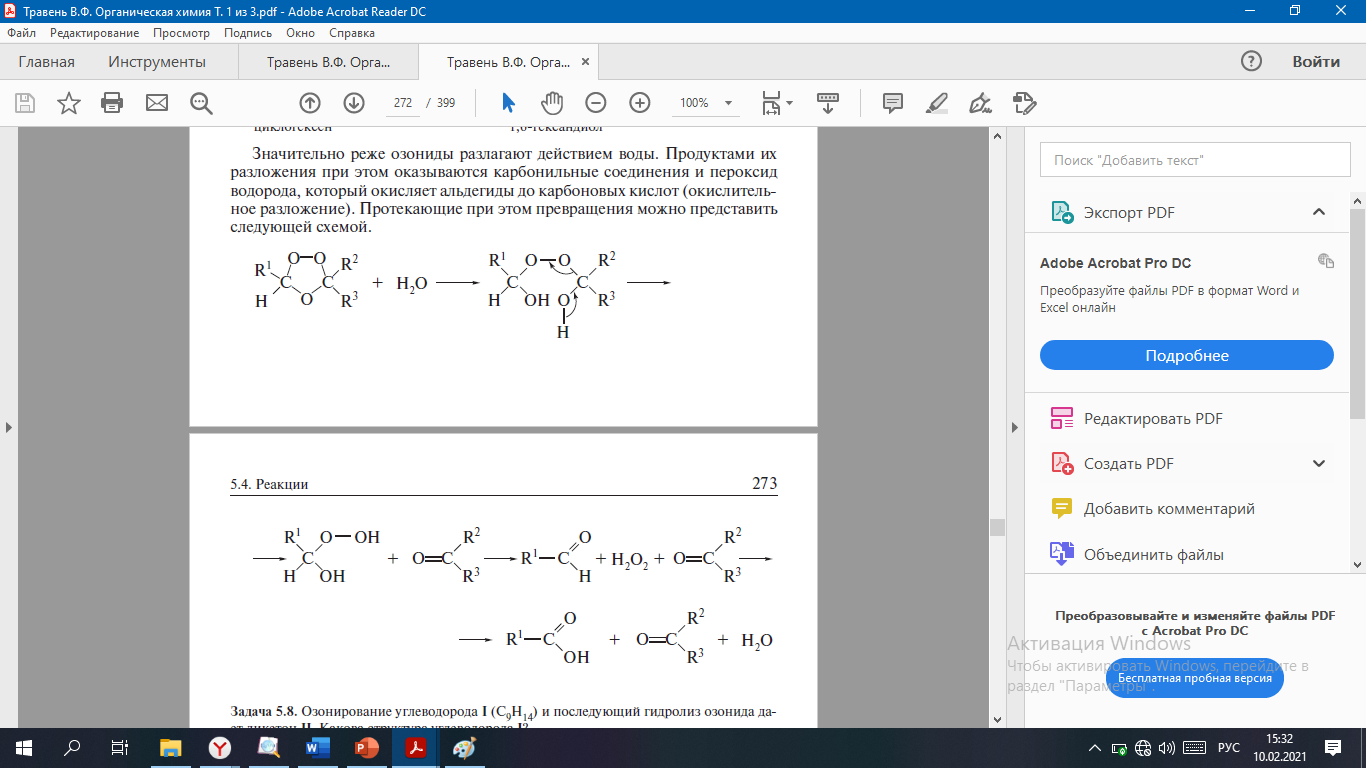 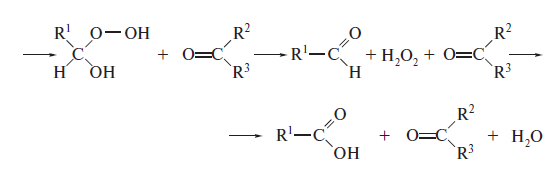 2) Окисление алкенов в присутствии солей палладия – П (Вакер-процесс) 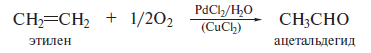 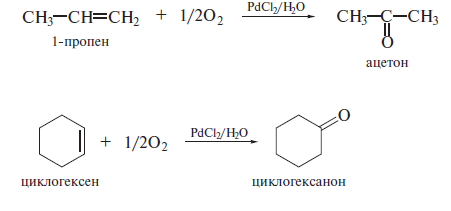 3) Гидроформилирование алкенов (оксо-синтез) 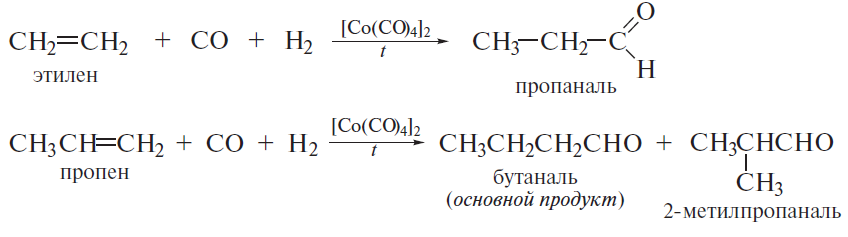 4) Гидратация алкинов (реакция Кучеров) 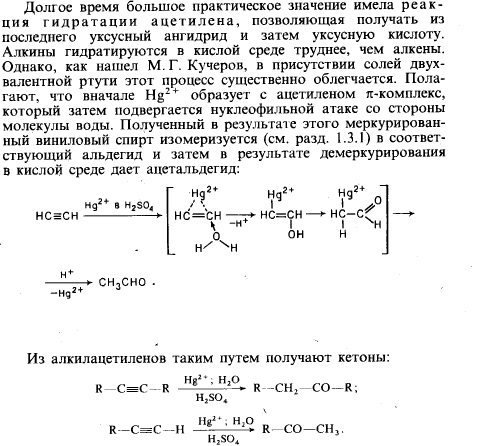 5) Окисление алкенилборанов 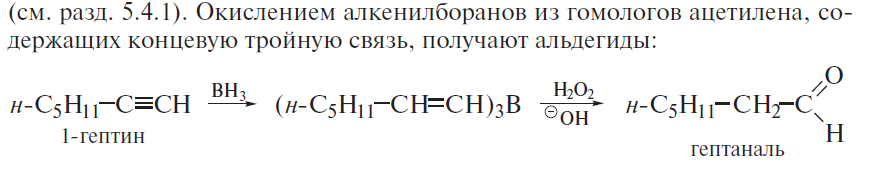 6) Окисление спиртов Дегидрирование первичных и вторичных спиртов с медно-серебряным катализатором (пропуская над медью) Применяют следующие окислители – смесь дихроматов натрия (смесь Килиани) или калия (смесь Бекмана) с серной кислотой, триоксид хрома, перманганат калия, диоксид марганца.  В промышленности первичные спирты окисляют кислородом в присутствии катализаторов  Вторичные спирты окисляются проще, тк кетоны устойчивее. 7) Присоединение реагентов Гриньяра к нитрилам 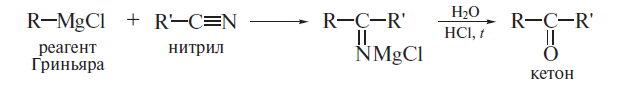 8) Реакции хлорангидридов карбоновых кислот с кадмийорганическими соединениям 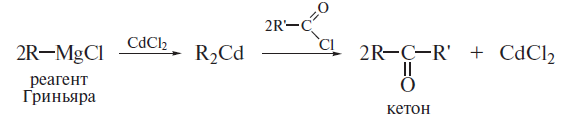 9) Восстановление хлорангидридов карбоновых кислот 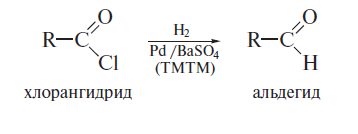 10) Оксиление метиларенов триоксидом хрома 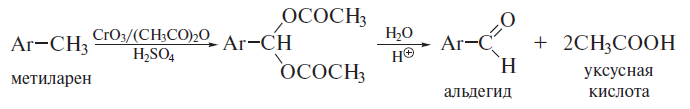 11) Гидролиз дигалогенметиларенов 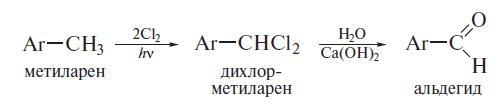 12) Реакция Фриделя-Крафтса 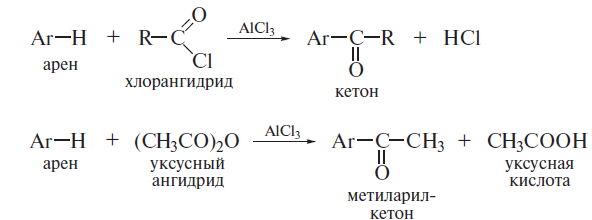 2. Реакции нуклеофильного присоединения к карбонильной группе альдегидов и кетонов (AdN) воды, спиртов, циановодорода, гидросульфита натрия. Ацетали и полуацетали, защита карбонильной группы. Устойчивость геминальных диолов. Карбонильная активность альдегидов выше, чем кетонов, т.к. карбонильный центр пространственно затруднен и несет меньший частичный положительный заряд, т.к. связан с двумя проявляющими индуктивный эффект радикалами, вместо одного. От карбонильной активности зависит легкость взаимодействия альдегидов или кетонов с нуклеофилами.
Реакции по С=О группе 1) вода: гем-диолы 2) Гидросульфит натрия 3) Циангидрины 4) Ацетали-полуацетали, ацетальная защита. Дитиановый метод. 5) Реакции с реактивами Гриньяра и ацетиленидами (спирт Фаворского) 6) Взаимодействие с N-нуклеофилами – (полуаминали, аминали, альдегидаммиак, основания Шиффа, енамины, гидразоны, азины, оксимы, (тио)семикарбазоны, гидробензамиды, имины, пергидротриазины и проч.). Синтез Штреккера. 7) Оксираны по Кори-Чайковскому 8) Реакции конденсации (Кнёвенагель, Виттиг, Хорнер-Вадсворт-Эммонс) Нуклеофильное замещение. Если нуклеофил достаточно сильный, чтобы атаковать электронодефицитный карбонильный атом углерода, то на первой стадии реакции происходит раскрытие двойной углерод-кислородной связи, карбонильный атом углерода переходит в sp3-гибридное состояние, а атом кислорода оказывается заряженным отрицательно: 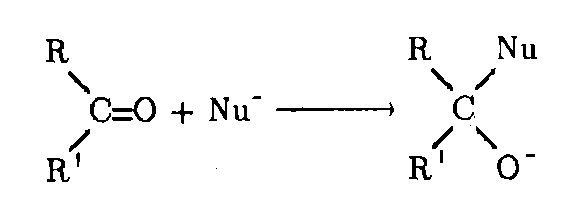 Пути стабилизации таких аддуктов зависят от условий реакции и применяемых реагентов. Пути стабилизации таких аддуктов зависят от условий реакции и применяемых реагентов. 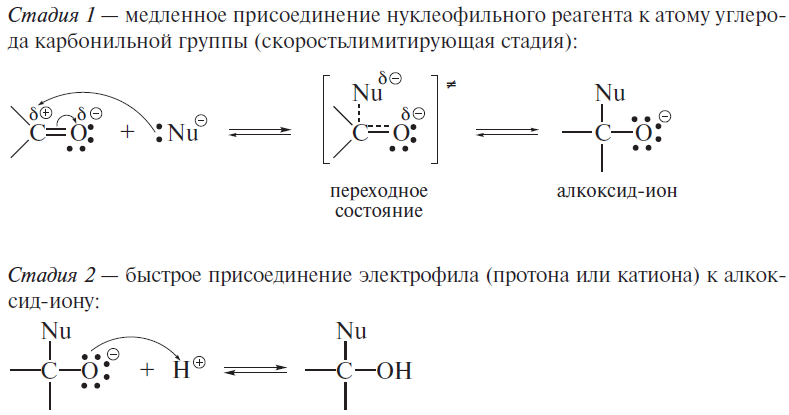 Реакции карбонильных соединений с сильными нуклеофилами самопроизвольно, часто при комнатной температуре. Реакции со слабыми нуклеофилами требуют катализаторов – кислот или оснований. 1) Гидратация. Правило Эльтекова-Эрленмейера (слабый) Продукты гидратации – гем-диолы. 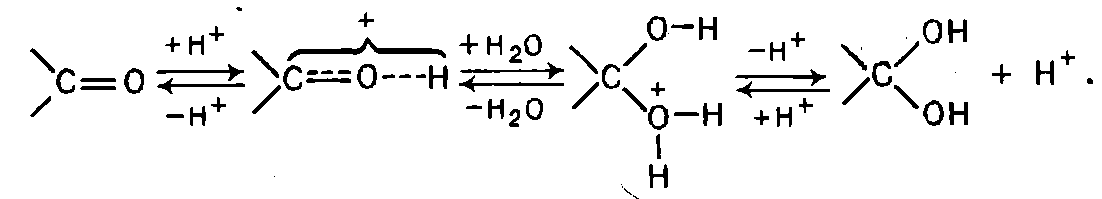 В этом случае на смещение равновесия существенно влияет pH среды: при кислых значения pH происходит протонирование одной из гидроксильных групп 1,1-диола, что заметно облегчает отщепление от него молекулы воды. Из правила Эльтекова-Эрленмейера следует, что 1,1-диолы неустойчивы сами по себе и с отщепление молекулы воды переходят в соответствующие карбонильные соединения. Присоединение слабых нуклеофилов к двойной углерод-кислородной связи карбонильной группы может осуществляться после увеличения электрофильности карбонильного атома углерода. Для этой цели можно координировать альдегид или кетон с электрофильным агентом (протоном) по кислороду карбонильноый группы или использовать альдегиды и кетоны, у которых с карбонильной группой связаны радикалы, обладающие существенно большей, чем обычный алкильные, электроноакцепторностью. 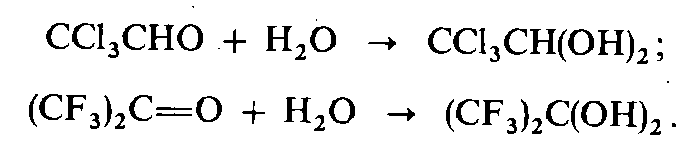 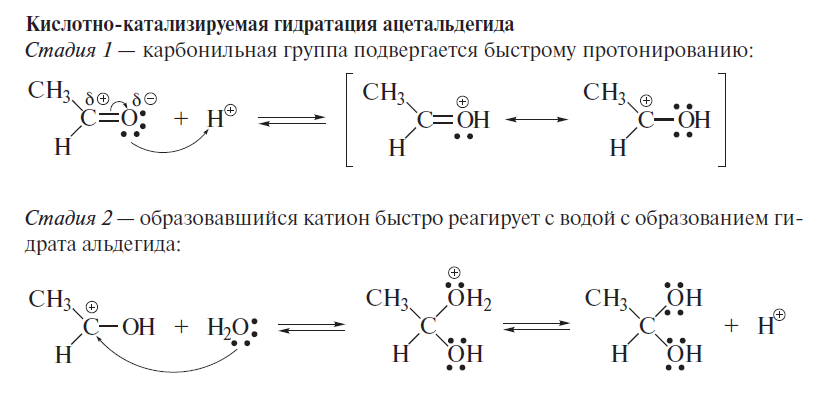 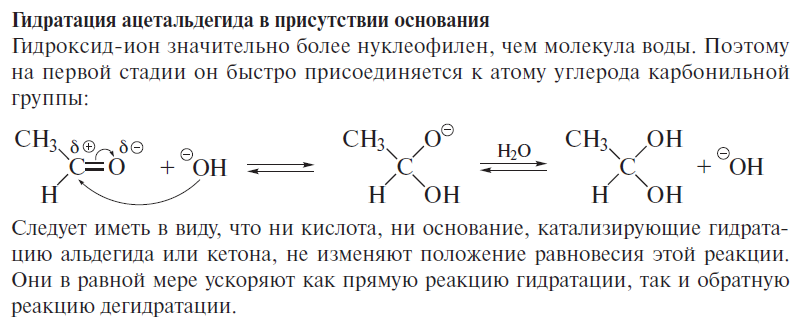 2) Гидросульфит натрия. (сильный) Позволяет отличать альдегиды от кетонов (впрочем, не всегда), позволяет производить очистку альдегидов. Метод количественного анализа альдегидов с использованием бисульфита основан на том, что гидроксисульфокислоты не окисляются йодом, в отличие от самого бисульфита. В реакцию вступают некоторые кетоны (метил кетоны – ацетон, МЭК, циклические кетоны - 2-тетралон, циклогексанон). Бисульфитные производные нерастворимы в конц. растворе бисульфита (в воде- вполне растворимы), и выпадают в осадок. 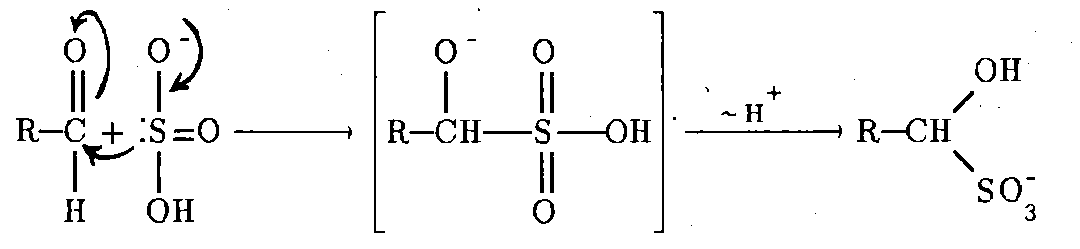 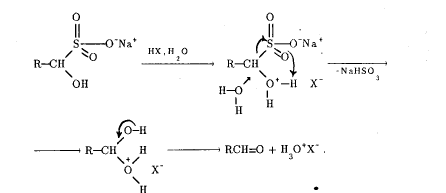 Этой реакцией пользуются для выделения альдегидов и кетонов из смесей, поскольку они затем могут быть легко регенерированы действием на дисульфитные производные разбавленных щелочей и кислот: Этой реакцией пользуются для выделения альдегидов и кетонов из смесей, поскольку они затем могут быть легко регенерированы действием на дисульфитные производные разбавленных щелочей и кислот: 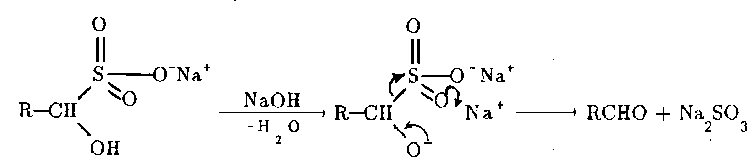 Решающую роль в реакция расщепления дисульфитных производных играет тот факт, что сульфогруппа является хорошей уходящей группой (отщепляется в виде сульфит или дисульфит- анион). Именно это обстоятельство используют при синтезе циангидринов через дисульфитные производные; его осуществляют как нуклеофильное замещение сульфогруппы на цианогруппу. 3) Образование циангидринов (сильный) Реакцию проводят в водных растворах цианида натрия/калия. Процесс обратим, и в щелочной среде образовавшийся циангирин расщепляется: 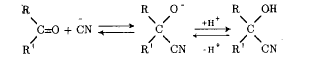 Нетрудно увидеть, что альдегид или кетон, связывая цианид водорода, увеличивают щелочность среды: 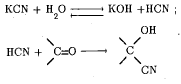 По этой причине на определенной стадии реакции скорость расщепления циангидрина становится равной скорости его образования и устанавливается равновесие. Чтобы сдвинуть его вправо, pH реакционной смеси поддерживают на определенном уровне. Реакция получения циангидринов становится необратимой, если вместо цианида щелочного металла использовать триметилцианосилан или смесь первого с триметилхлорсиланом.  В этом случае соответствующие производные образуются из любых альдегидов и кетонов. Необратимость реакции связана с устойчивостью связи кислород-кремний. 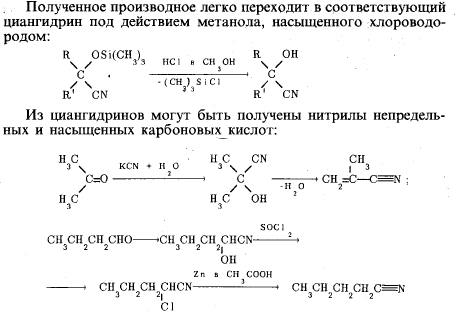 4) Полуацетали и ацетали Спирты не присоединяются к карбонильным группам альдегидов и кетонов в нейтральной среде. Однако при пропускании сухого хлороводорода через раствор альдегида (из кетонов только ацетон и циклогексанон) в избыточном количестве спирта соответствующий аддукт, называемый полуацеталем (ПА), образуется легко, но столь же легко претерпевает и дальнейшее замещение гидроксильной группы на алкоксильную с образованием ацеталя: 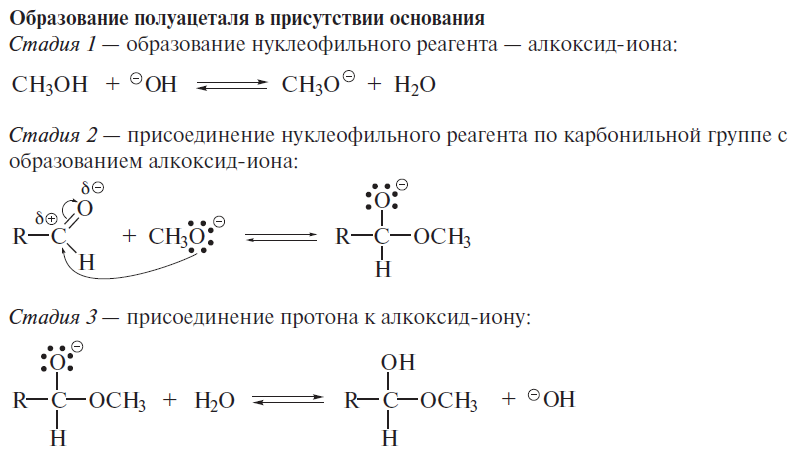 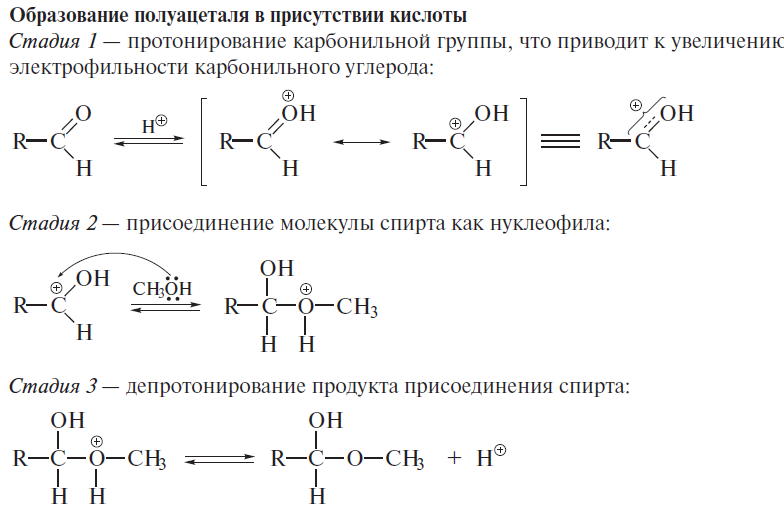  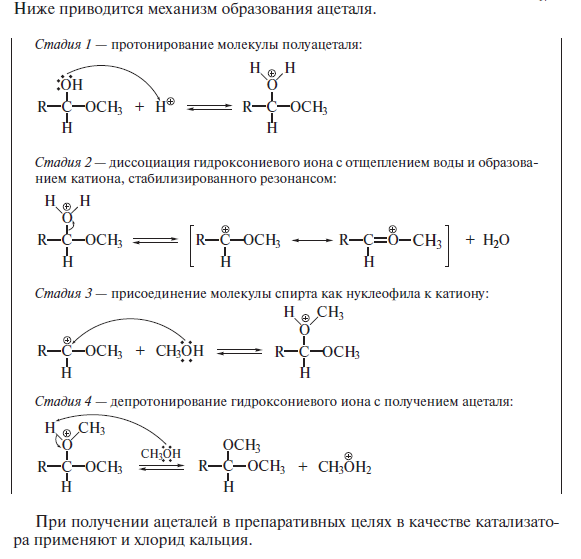 УСТОЙЧИВОСТЬ ГЕМИНАЛЬНЫХ ДИОЛОВ! |
