14 ВАРИАНТ. 1 Классы неорганических веществ 1
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
| 3p | ↑ | ↑ | |
| 3s | ↑↓ | | |
| 2p | ↑↓ | ↑↓ | ↑↓ |
| 2s | ↑↓ | | |
| 1s | ↑↓ | | |
Валентность II
3. Хлор в таблице менделеева занимает 17 место, в 3 периоде.
Атомный вес – 35,44600
Латинское название – Clorum
Возможные степени окисления: 6, 5, 4, 3, 2, 1, 0, -1, -2
Оксид хлора I
Имеет кислотные свойства. Реагирует с водой, щелочами:
Сl2O + H2O = 2HClO
Сl2O + NaOH = 2NaClO + H2O
Является сильным окислителем:
3Сl2O + 3H2O + 6AgNO3 = 2AgClO + AgCl + 6HNO3
При температуре выше 20ºС или на свету разлагается:
4Сl2O = 3Сl2 + 2ClO2
Оксид хлора (IV)
ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
2ClO2 + H2O = HClO2 + HClO3 (холодная вода)
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
2ClO2 + 2NaOH = NaClO2 + NaClO3
Разлагается в концентрированной хлороводородной кислоте:
2ClO2 + 8HСl(конц) = 5Cl2 + 4H2O
Проявляет окислительно-восстановительные свойства:
2ClO2 + Na2СO3 = NaClO2 + NaClO3 + CO2
2ClO2 + 10HI(конц) = 2HCl + I2↓ + 4H2O
Оксид хлора (VI)
В обычных условиях постепенно разлагается на ClO2 и О2:
4ClO3 = 2ClO2 + 4О2 + Сl2
ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
2ClO3 + H2O = HClO4 + HClO3
2ClO3 + 2NaOH = NaClO4 + NaClO3 + H2O
Оксид хлора VII
Проявляет кислотные свойства.
При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
Cl2O7 + H2O = HClO4
При взаимодействии Cl2О7 с щелочами образуются перхлораты:
Cl2O7 + 2NaOH = 2NaClO4 + H2O
При нагревании разлагается:
Cl2O7= 2Cl2 + 7О2
Взаиодействие хлора в водой даёт кислоты. Все кислоты Хлора проявляют кислотные свойства.
Изменение свойств в ряду кислородных кислот хлора можно выразить следующей схемой:
→
(усиление кислотных свойств, повышение устойчивости)
HClO; HClO2; HClO3; HClO4
3 Химическая связь
NI3 – ковалентная полярная связь, гибридизация sp2
SnCl2 – ионная связь, гибридизация sp
4 Химическая термодинамика
4HBr(г) + O2(г) 2Br2(г) + 2H2O
∆H0298 = 2∆H0f 298 (Br) + 2∆H2980(H2O) – (4∆H0298(HBr) + ∆H0298(O2))
= 2·30,91 + 2·(-241,81) – (4·(-36,38) + 0) = – 276,28 кДж/моль
При проведение реакции теплота выделяется, реакция экзотермическая.
∆S298 = 2∆S0f 298 (Br) + 2∆S2980(H2O) – (4∆S0298(HBr) + ∆S0298(O2))
= 2·245,37 + 2·188,72 – (4·198,58 + 205,04) = – 131,18 Дж/моль·К
Изменение энтропии в химической реакции определяет степень беспорядка в системе. В нашем примере ∆S возрастает, так как образуется большее число газообразных молекул (∆S > 0).
При низких температурах, т.е. при T→ 0, можно пренебречь величиной T∆S, тогда ∆G ∆H. В нашем примере ∆H < 0, следовательно, ∆G < 0 и протекание реакции в прямом направлении возможно.
∆G0298 = ∆H0298 – 298∆S2980 = – 276,28 – 298·0,13118 = – 315,3716 кДж
∆G0298 < 0 поэтому реакция в прямом направлении возможна
Изменение энергии Гиббса при температуре Т = 1273 К вычислим по уравнению Улиха.
∆G0Т = ∆H0298 – Т∆S298 = – 276,28 – 1273·0,13118 = –443,2721 кДж
∆G01273 < 0 поэтому реакция в прямом направлении возможна
Температура, при которой реакция меняет свое направление:
T = ∆H0298/∆S298 = – 276,28/– 131,18 = 2.106 K
Строим график зависимости ∆G0Т = f(T)
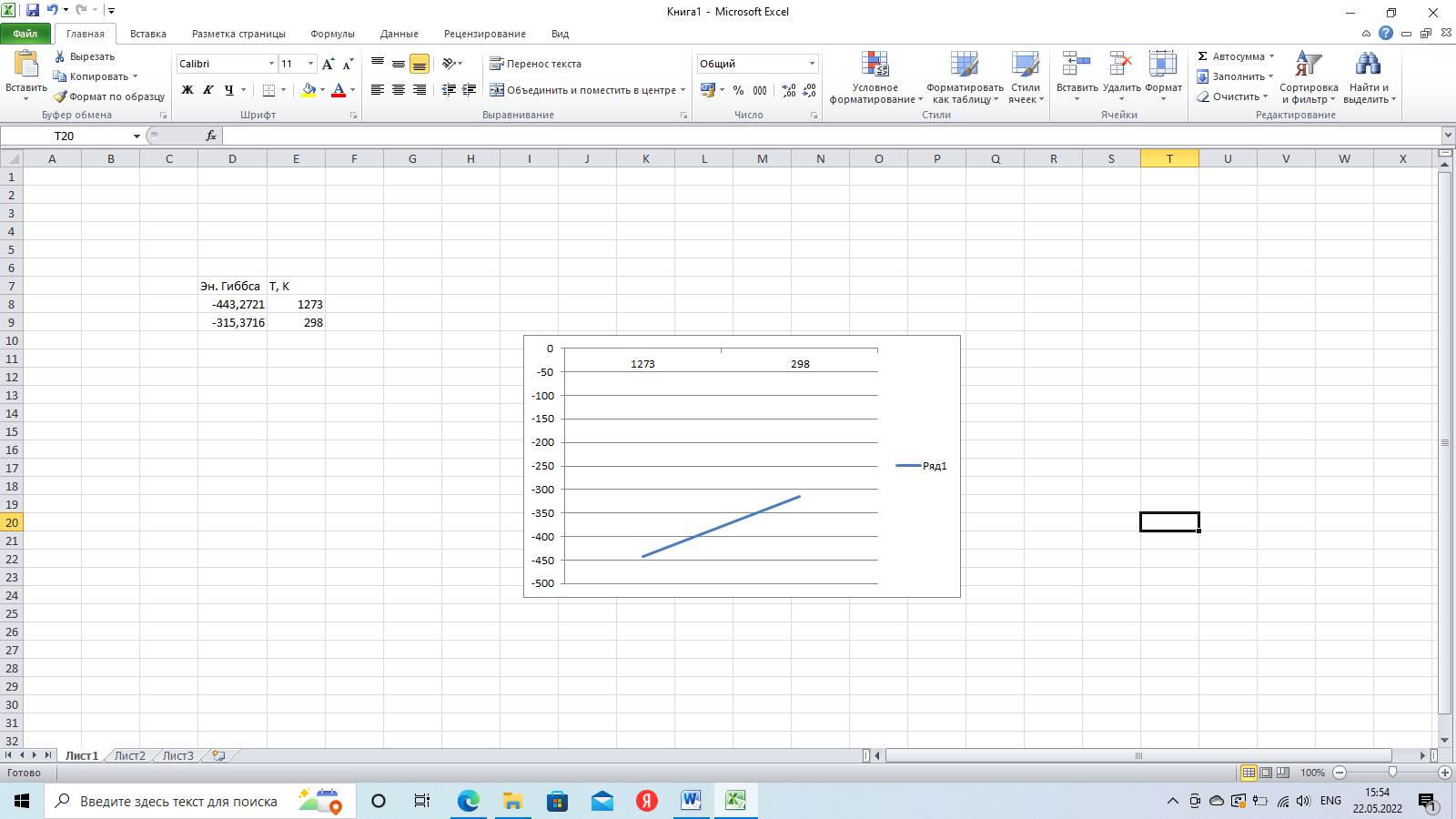
Исходя из графика реакции наблюдаем, что с уменьшением температуры увеличивается вероятность обратной реакции.
5 Кинетика и равновесие химических реакций
SO2Cl2 = SO2 + Cl2 – Q
v1 = k[SO2Cl2]
а) увеличение концентрации в 4 раза
v2 = k·4[SO2Cl2]
Скорость прямой реакции увеличится в 4 раза.
б) если объём исходных веществ увеличить в 2 раза
v2 = k·2[SO2Cl2]
Скорость прямой реакции увеличится в 2 раза.
6 Концентрация растворов
CM = n/V
n = m/M = 80/58,44 = 1,37 г/моль
V = m/p = (1000+80)/1,056·1000 = 1,023 л
CM = 1,37 / 1,023 = 1,33 моль/л
Молярная концентрация эквивалента:
Э = М/1 = 58,44 г/моль-экв
Сэ = m/(Э·V) = 80/(58,44·1,023) = 1.34 моль-экв/л
Моляльная концентрация
См= n/m1 = 1,37/1,023=1,339 моль/кг
Массовая доля растворенного вещества
w = m/m+m1 = 80/1000+80 = 0.074 или 7,4%
Молярная доля растворенного вещества
Х = n/(n+n2)
n2 = 1000/18 = 55,55 моль
Х = 1,37/(1,37+55,55) = 0,024
Титр раствора
Т = m/V = 80/1023 = 0,078 г/см3
7 Электролитическая диссоциация
7.1 HMnO4 H+ + MnO4-
Марганцовая кислота – сильная, нестабильная кислота.
Fe(OH)3 – малорастворимое в воде основание, слабый электролит
1 ст. Fe(OH)3 = Fe(OH)2+ + OH-

2 cт. Fe(OH)2+ = Fe(OH)2+ + OH-
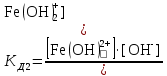
3 cт. Fe(OH)2+ = Fe3+ + OH-
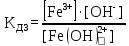
Na2HPO4 – слабый электролит
1 ст. Na2HPO4 = 2Na+ + HPO42-
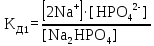
2ст.
HPO42- = H+ + PO43-
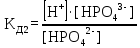
ZnOHCl – гидроксохлорид цинка, слабый электролит
1 ст. ZnOHCl = ZnOH+ + Cl-
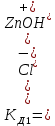
2 ст. ZnOH+ = Zn2+ + OH-
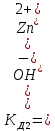
K2SO4 – сульфат калия, сильный электролит
K2SO4 = 2K+ + SO42-
7.2 Ca(OH)2 – сильное основание, малорастворимое в воде.
Сa(OH)2 = CaOH+ + OH-
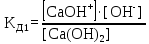
CaOH+ = Ca2+ + OH-
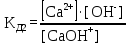
КД = 4,3
 102-
102-Степень диссоциации:
7,4 г/дм3 = 0,099 моль/дм3
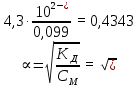
Поскольку концентрация Ca(OH)2 = 0,099 моль/дм3, то концентрация гидроксидов ионов равна 0,198 моль/дм3
pOH = -log0,198 = 0,703
pH = 14 – 0,703 = 13.297
8 Гидролиз солей
А. Cu(NO3)2 + H2O Cu(OH)NO3 + HNO3
Cu2+ + 2NO-3 + H2O CuOH+ + 2NO-3 + H+
Cu2+ + H2O CuOH+ + H+ гидролиз по катиону, среда кислая.
Б. Na2Se + H2O NaHSe + NaOH
2Na+ + Se2- + H2O Na+ + HSe- + Na+ + OH-
Na+ + Se2- + H2O HSe- + Na+ + OH-
NaHSe + H2O H2Se + NaOH
Na+ + HSe- + H2O H2Se + Na+ + OH-
HSe- + H2O H2Se + OH-
Гидролиз по аниону, он имеет щелочную среду.
9 Окислительно-восстановительные реакции
Cu2O + 6HNO3 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu1+ – 2e 2Cu2+ окисление
2N5+ + 2e 2N4+ восстановление
Cr(OH)3 + Br2 + KOH K2CrO4 + KBr + …
Cr(OH)3 + 2Br0 + K+ + OH- 2K+ + CrO42- + K+ + Br- + …
Cr(OH)3 + 5OH- – 3e CrO42- + 4H2O 2 окисление
2Br0 + 2e 2Br- 3 восстановление
Расставим коэффициенты:
2Cr(OH)3 + 3Br2 + 10KOH 2K2CrO4 + 6KBr + 8H2O
E0 = φокисл – φвост = 1,09 – (-0,13) = 1,22 В
Константа равновесия:
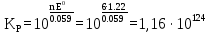
10 Гальванический элемент
Zn + 2AgNО3 = Zn(NО3)2 + 2Ag
схема гальванического элемента:
Zn | Zn(NО3)2 || AgNО3 | Ag.
Эта же схема может быть изображена в ионной форме:
Zn | Zn2+ || Ag+ | Ag.
Реакции протекающие на элементах:
Zn0 – 2e Zn2+
Ag+1 + 1e Ag0
Рассчитаем потенциалы:
ΦAg+/Ag =
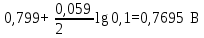
ФZn2/Zn =
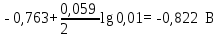
ЭДС = ЕAg – ЕZn = 0,7695 – (–0,822) = 1,5915 В
11 Электролиз
Уравнение диссоциации:
Cr2(SO4)3 2Cr3+ + 3SO42-
Анод и катод, представленные платиной и графитом, являются инертными электродами. Молекулы сульфат-иона не способны окисляться в водных растворах.
2H2O – 4e O2 + 4H+
2Сr3+ + 6e 2Cr0
2Cr2(SO4)3 + 6H2O 4Cr + 3O2 + 6H2SO4
Массы веществ, выделившихся на электродах:
На электродах выделяется только кислород.
ЭО2 = 32/2 = 16
mO2 = (16·1·5400)/96500 = 0,895 г
12 Взаимодействие металлов с кислотами
А) 3Mg + 4H2SO3 = 3MgSO4 + 4H2
3Mg0 – 6e 2Mg2+
2H+ +2e H20
Молярная концентрация серной кислоты:
СМ = С/М = 6,00/98 = 0,061 моль/дм3
Концентрация ионов в растворе кислоты:
[H+] = 2αCM = 0,122 моль/дм3
pH раствора и кислоты:
pH = – lg[H+] = –lg0,122 = 0,91
Учитывая парциальное давление водорода PH2 = 5·10-7 атм, рассчитаем потенциал окислителя по уравнению.
Ф2Н+/Н2 = – 0,059pH – lg0,02951lgPH2 = – 0,059·0,91 – 0,0295·lg(5·10-7) =
= – 0,286 B
Рассчитаем ЭДС:
Е = – 0,286 – (–2,363) = 2,077
∆G = –nFE = –2·96500·2,077 = – 400 861 Дж
Отрицательное значение энергии Гиббса показывает, что реакция возможна.
Б) Mg + 2HNO3 Mg(NO3)2 + H2
2H1+ + 2e 2H0
Mg0 – 2e Mg2+
13 Коррозия металлов
Металлы Mn – Cd
Стандартный потенциал марганца - –1,180, кадмия - –0,403. В данной паре марганец – более активный металл, поэтому он будет подвергаться коррозии.
Коррозия как самопроизвольный процесс, протекает в том случае если энергия Гиббса меньше 0.
Потенциал для окислителя при кислородной деполяризации:
ФO2+4H+/2H2O = 1,23 + 0,01471lgPO2 – 0,059pH = 1,23 + 0,0147·lg0,21 – 0,059·7 =
= 1,102 B
Потенциал восстановителя:
ФMn2+/Mn = – 1,180 +(0,059·lg0,001)/2 = – 1,2685
E = 1,102 – (– 1,2685) = 0,1665 B
Величина потенциала выше нуля, а энергия Гиббса меньше нуля. Следовательно реакция возможна.
Реакции на электродах:
Mn0 – 2e Mn2+
O2 + 2H2O +4e 4OH-

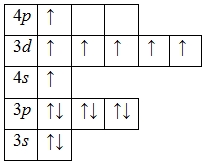 Валентность VII
Валентность VII