Микробиология мпф 2015-2016 экз. 1. Микробиология предмет изучения, цели и задачи. Исторические этапы развития медицинской мб
 Скачать 1.74 Mb. Скачать 1.74 Mb.
|
|
132. Реакции лизиса. РСК. Компоненты, механизм, способы постановки, учетные признаки. Практическое применение Механизм. РСК проводят в две фазы: 1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент; 2-я фаза (индикаторная) — выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет; реакция положительная. Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — ан-тиэритроцитарное антитело, вызывая гемолиз; реакция отрицательная. Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана). 1) испытуемую и контрольную сыворотки предварительно инактивируют нагреванием при 56гр 30 мин 2) АГ соединяется с сывороткой и комплементом при 37 гр 30 мин. При постановке РСК на холоде эту фазу проводят при 0-4гр 18-20 часов 3) После добавления в каждую пробирку по 0.4мл гемолитической системы пробирки встряхивают и выдерживают 20-30мин при 37гр 4) Результаты опыта оценивают, отмечая наличие или отсутствие гемолиза в пробирках. Степень задержки гемолиза оценивают в зависимости от интенсивности окраски жидкости и величины осадка эритроцитов на дне. В качестве контроля (2 и 3 пробирки) учитывают реакции с заведомо положительной и отрицательной сывороткой 4 и 5 пробирки служат для проверки антикомплементарных свойств сыворотки и АГ в 6 и 7 пробирках контролируется качество комплемента и гемолитической системы 133. Реакция нейтрализации. Компоненты, механизм, способы постановки, учетные признаки. Практическое применение. Реакция флокуляции 1) готовят последовательное двукратное разведение сыворотки крови больного в ИХН от 1\4 до 1\64, оставляют на 1ч при комнатной температуре. 2) Добавляют в пробирки взвесь клеток в питательной среде 199, вазелиновое масло (для создания анаэробных условий) 3) Инкубируют в термостате при 37гр 7-9 дней Учет: Среда 199 имеет красный цвет. Если вирус присутствует в организме, он убивает взвесь клеток и среда свой цвет не меняет Если вируса нет, клетки размножаются и среда меняет свой цвет на желтый Учитываются только красный и желтый цвета! Р. флокуляции: В основе этой реакции лежит способность специфической антитоксической сыворотки нейтрализовать экзотоксин. Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией. Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело. Для проведения реакции исследуемый материал, в котором предполагается наличие экзотоксина, смешивают с антитоксической сывороткой, выдерживают в термостате и вводят животным (морским свинкам, мышам). Контрольным животным вводят фильтрат исследуемого материала, не обработанный сывороткой. В том случае, если произойдет нейтрализация экзотоксина антитоксической сывороткой, животные опытной группы останутся живыми. Контрольные животные погибнут в результате действия экзотоксина. 134. Реакции иммунитета при вирусных инфекциях: РН, РТГА. Компоненты, механизм, способы постановки, учетные признаки. Практическое применение Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови. Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты. РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных. Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток. 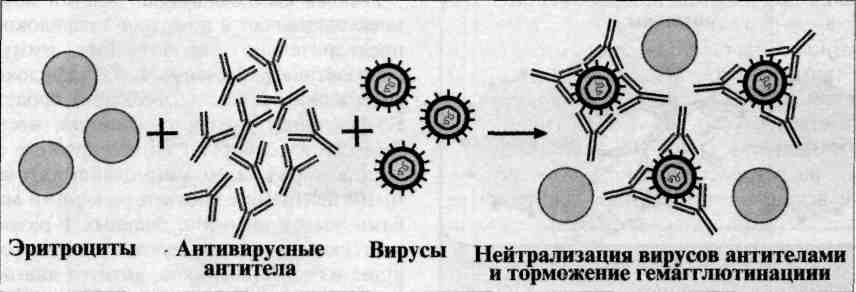 135. Ифа, иммуноблоттинг. Компоненты, механизм, способы постановки, учетные признаки. Практическое применение Метод основан на использовании в качестве метки антител ферментов, способных разлагать субстрат и приводить к образованию окрашенного продукта (хромогена). Конъюгированные с ферментом Ат сохраняют способность соединяться с гомологичным АГ. Интенсивность окраски соответствует количеству комплексов АГ-АТ-фермент. Определение неизвестных АТ: 1) фиксация известного АГ 2) внесение неизвестной сыворотки 3) внесение конъюгата (АТ + фермент) 4) инкубация с хромогенным субстратом Определение неизвестных АГ: 1) фиксация известного АТ 2) внесение АГ-содержащего материала 3) внесение двух АТ той же специфичности (зачем — не знаю, в таблице этого не было) 4) внесение конъюгата (антиглобулин + фермент) 5) инкубация с хромогенным субстратом Положительная реакция (связывание) — коричневый Отрицательная — желтый В основе метода — твердофазный вариант ИФА для обнаружения неизвестных АТ. 1. Препарат известного АГ разделяют на фракции при помощи электрофореза на агарном геле 2. Гельнакладывают на фильтр, плотно прижимают и создают электрическое поле, в результате чего происходит перенос фракций на бумагу (блоттинг) 3. Добавляют сыворотку крови больного 4. Добавляют меченную сыворотку против Yg человека. Она соединяется с образовавшимися комплексами АГ-АТ. 5. Добавляют субстрат (хромоген), который вызывает окрашивание комплексов АГ-АТ-меченная сыворотка. 136. Методы иммунофлюоресценции. Компоненты, механизм, способы постановки, учетные признаки. Практическое применение Прямой метод: метод Кунса Специфические флюоресцирующие АТ, связываясь с микробными АГ, образуют комплексы, которые светятся при люминесцентном микроскопировании. Недостаток: необходимость приготовления широкого набора флюоресцирующих специфических сывороток против каждого изучаемого АГ Непрямой метод: Материал: АГ АТ (в диагностической сыворотке) люминесцирующая сыворотка Метод предусматривает использование одной универсальной флюоресцирующей сыворотки — антиглобулиновой (содержит АТ только против крольичьих глобулинов) 1) Диагностическая сыворотка (содержит крольичьи глобулины) реагирует с флюоресцирующей сывороткой, как антиген 2) Комплекс диагностическая-флюоресцирующая сыворотка реагирует с исследуемым антигеном, как антитело. 3) На образовавшемся комплексе формируются флюоресцирующие антиглобулиновые антитела. Ход работы: 1) На предметном стекле готовят мазок из испражнений больного колиэнтеритом, фиксируют на пламени и обрабатывают иммунной сывороткой, содержащей АТ против возбудителей колиэнтерита. 2) Препарат помещают во влажную средуи инкубируют при 37гр 15мин, после чего промывают ИХН 3) На препарат наносят флюоресцирующую антиглобулиновую сыворотку, выдерживают при 37гр 15 мин и тщательно промывают ИХН. 137. ПЦР. Компоненты, механизм. Определение продуктов ПЦР. Практическое применение Применяется для определения специфических последовательностей ДНК. Метод заключается в многократном увиличении амплификации количества ДНК диагносцируемого препарата. 1. Денатурация ДНК в исследуемом растворе (60с, 95гр) 2. Отжиг — присоединение затравок праймеров, несущих метку 3. Удлинение праймеров, образование меченных двунитчатых молекул ДНК Через 25 циклов получают определенную цветную реакцию за счет меченных праймеров Полимеразная цепная реакция позволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру. Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций. 138. Вакцины из живых и инакивированных микробов: примеры, принципы получения. Применение инактивированных вакцин. Требования, предъявляемые к живым вакцинам Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Аттенуация (ослабление) возможна путём воздействия на штамм химических (мутагены) и физических (температура) факторов или посредством длительных пассажей через невосприимчивый организм. Так же в качестве живых вакцин используются дивергентные штаммы (непатогенные для человека), имеющие общие протективные антигены с патогенными для человека микробами. Примером такой вакцины является БЦЖ и вакцина против натуральной оспы. Возможно получение живых вакцин генно-инженерным способом. Принцип получения таких вакцин сводится к созданию непатогенных для человека рекмбинантных штаммов, несущих протективные антигены патогенных микробов и способных при введении в орг. человека размножаться и создавать иммунитет. Такие вакцины называют векторными. Вне зависимости от того, какие штаммы включены в вакцины, бактерии получают путём выращивания на искусственных питательных средах, культурах клеток или куриных эмбрионах. В живую вакцину, как правило, добавляют стабилизатор, после чего подвергают лиофильному высушиванию. В связи с тем, что живые вакцины способны вызывать вакцинную инфекцию (живые аттенуированные микробы размножаются в организме, вызывая воспалительный процесс проходящий без клинических проявлений), они всегда вызывают перестройку иммунобиологического статуса организма и образование специфических антител. Это так же может являться недостатком, т. к. живые вакцины чаще вызывают аллергические реакции. Вакцины данного типа, как правило, вводятся однократно. Примеры: сибиреязвенная вакцина, чумная вакцина, бруцеллёзная вакцина, БЦЖ вакцина, оспенная дермальная вакцина. Инактивированные (убитые, корпускулярные или молекулярные) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). Для выделения из бактерий и вирусов антигенных комплексов (гликопротеинов, ЛПС, белков) применяют трихлоруксусную кислоту, фенол, ферменты, изоэлектрическое осаждение. Их получают путем выращивания патогенных бактерий и вирусов на искусственных питательных средах, инактивируют, выделяют антигенные комплексы, очищают, конструируют в виде жидкого или лиофильного препарата. Преимуществом данного типа вакцин является относительная простота получения (не требуется длительного изучения и выделения штаммов). К недостаткам же относятся низкая иммуногенность, потребность в трехкратном применении и высокая реактогенность формализированных вакцин. Так же, по сравнению с живыми вакцинами, иммунитет, вызываемый ими, непродолжителен. В настоящее время применяются следующие убитые вакцины: брюшнотифозная, обогащенная Vi антигеном; холерная вакцина, коклюшная вакцина Действующим началом этого типа препаратов являются протективные антигены бактерий, полученные путем воздействия ультразвука на бактериальные клетки. Главным преимуществом данного типа вакцин является их низкая реактогеннность. Адьюванты применяются для усиления иммуногенности вакцин. В качестве адъювантов используют минеральные сорбенты (гели гидрата окиси и фосфата аммония), полимеры, и др. хим. соединения, бактерии и компоненты бактерий, липиды, вещества, вызывающие воспалительную реакцию. Они действуют на антиген и организм в целом. Действие на антиген сводится к укрупнению молекул антигена, т. е. превращению растворимых антигенов в корпускулярные, в результате чего антиген лучше захватывается иммунокомпетентными клетками. При воздействии на организм в месте инъекции адьюванты вызывают воспалительный процесс образование фиброзной капсулы, что способствует более длительному сохранению антигена в «депо» и суммации антигенных раздражений. Адьюванты так же непосредственно активируют пролиферацию В, Т и А систем иммунитета. Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. В процессе культивирования природных патогенных микробов можно получить протективный антиген, синтезируемый этими бактериями токсин затем превращается в анатоксин, сохраняющий специфическую антигенность и иммуногенность. Анатоксины являются одним из видов молекулярных вакцин. 139. Химические вакцины (субъдиничные). Примеры, получение 140. Анатоксины: примеры, получение при введении в организм человека анатоксинов происходит развитие гуморального и клеточного иммунитета. Анатоксины применяются для профилактики инфекционных болезней Получение анатоксинов: из экзотоксинов, которые обезвреживают формалином, действием высоких температур. При этом утрачиваются ядовитые свойства бактериальных клеток, но сохраняются антигенные функции (это и есть анатоксин) Анатоксины – препараты, полученные из бактериальных экзотоксинов, полностью лишенные своих токсических свойств, но сохранившие антигенные и иммуногенные свойства. Получение: токсигенные бактерии выращивают на жидких средах, фильтруют с помощью бактериальных фильтров для удаления микробных тел, к фильтрату добавляют 0,4% формалина и выдерживают в термостате при 30-40t на 4 недели до полного исчезновения токсических свойств, проверяют на стерильность, токсигенность и иммуногенность. Эти препараты называются нативными анатоксинам, в настоящее время почти не используются, т. к. содержат большое количество балластных веществ, неблагоприятно влияющих на организм. Анатоксины подвергаю физической и химической очистке, адсорбируют на адъювантах. Такие препараты называются адсорбированными высокоочищенными концентрированными анатоксинами. Титрование анатоксинов в реакции флокуляции производят по стандартной флокулирующей атитоксической сыворотке, в которой известно количество антитоксических единиц. 1 антигенная единица анатоксина обозначается Lf, это то количество анатоксина, которое вступает в реакцию флокуляции с 1 единицей дифтерийного анатоксина. Анатоксины применяются для профилактики и реже, для лечения токсинемических инфекций (дифтерия, газовая гангрена, ботулизм, столбняк). Так же анатоксины применяются для получения антитоксических сывороток путем гипериммунизации животных. Примеры препаратов: АКДС, АДС, адсорбированный стафилококковый анатоксин, ботулинистический анатоксин, анатоксины из экзотоксинов возбудителей газовых инфекций. 141. ассоциированные, комбинированные вакцины — примеры. Принципы создания современных вакцин: рекомбинантные, сплит-вакцины. Примеры Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов и позволяющие проводить иммунизацию против нескольких инфекций одновременно. Если в препарат входят однородные антигены, то такую ассоциированную вакцину называют поливакциной. Если же ассоциированный препарат состоит из разнородных антигенов, то его целесообразно называть комбинированной вакциной. Возможна так же комбинированная иммунизация, когда одновременно вводят несколько вакцин в различные участки тела, например, против оспы(накожно) и чумы(подкожно) Примером поливакцины можно считать живую полиомиелитную поливакцину, содержащую аттенуированные штаммы вируса полиомиелита I, II, III типов. Примером комбинированной вакцины является АКДС, куда входят инактивированная корпускулярная коклюшная вакцина, дифтерийный и столбнячный анатоксин. Комбинированные вакцины применяются в сложной противоэпидемической обстановке. В основе их действия лежит способность иммунной системы отвечать на несколько антигенов одновременно Генно-инженерные вакцины – это препараты, полученные с помощью биотехнологии, которая по сути сводиться к генетической рекомбинации . Для начала получают ген, который должен быть встроен в геном реципиента. Небольшие гены могут быть получены методом химического синтеза. Для этого расшифровывается число и последовательность аминокислот в белковой молекуле вещества, затем по этим данным узнают очерёдность нуклеотидов в гене, далее следует синтез гена химическим путем. Крупные структуры, которые довольно сложно синтезировать получаются путем выделения(клонирования), прицельного выщепления этих генетических образований с помощью рестриктаз. Полученный одним из способов целевой ген с помощью ферментов сшивается с другим геном, который используется в качестве вектора для встраивания гибридного гена в клетку. Вектором могут служить плазмиды, бактериофаги, вирусы человека и животных. Экспрессируемый ген встраивается в бактериальную или животную клетку, которая начинает синтезировать несвойственное ей ранее вещество, кодируемое эксперссируемым геном. В качестве реципиентов экспрессируемого гена чаще всего используется E. coli, B. subtilis, псевдомонады, дрожжи, вирусы. некоторые штаммы способны переключаться на синтез чужеродного вещества до 50% своих синтетических возможностей – эти штамм называются суперпродуцентами. Иногда к генно-инженерным вакцинам добавляется адъювант. Примерами таких вакцин служат вакцина против гепатита В (энджерикс), сифилиса, холеры, бруцеллёза, гриппа, бешенства. Есть определённые сложности в разработке и применении: - длительное время к генно-инженерным препаратам относились настороженно. - на разработку технологии для получения вакцины затрачиваются значительные средства - при получении препаратов данным способом возникает вопрос об идентичности полученного материала природному веществу. |
