Биохимия. бх итоговая 28. 1. Общая схема распада нуклеиновых кислот пищи, ферменты, субстраты, продукты
 Скачать 3.06 Mb. Скачать 3.06 Mb.
|
|
1. Общая схема распада нуклеиновых кислот пищи, ферменты, субстраты, продукты. В желудке под влиянием НСl отщепляются белки(протамины и гистоны), которые денатурируют →переваривание белков. В 12-перстной кишке ДНК-азы и РНК-азы поджелудочной железы расщепляют нуклеиновые кислоты на олигонуклеотиды. • В тонком кишечнике: фосфодиэстеразы завершают расщепление до мононуклеотидов, фосфатазы отщепляют фосфорную кислоту отнуклеотидов, а нуклеозидазы расщепляют нуклеозиды на азотистоеоснование и пентозу  Практически все продукты переваривания и всасывания нуклеотидов не используются организмом, а подвергаются катаболизму и выводятся. 2. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия. 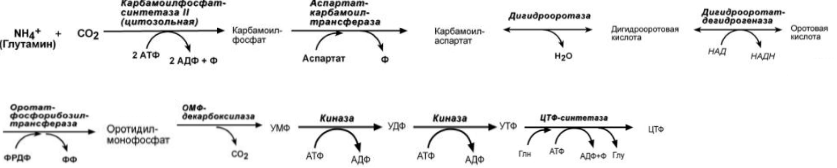 Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует глутамин, СО2 , аспартат, затрачивается 2 молекулы АТФ. Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует глутамин, СО2 , аспартат, затрачивается 2 молекулы АТФ.Распад 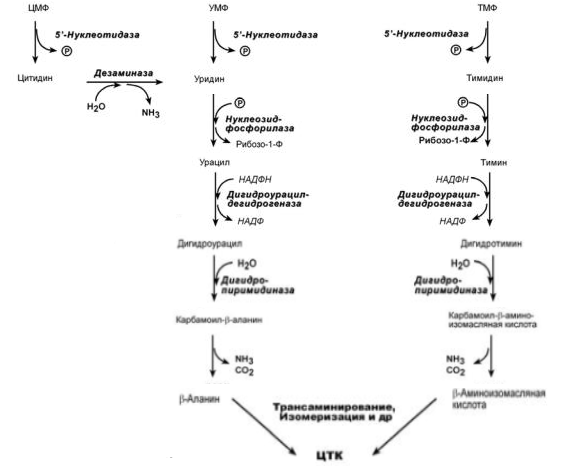 Регуляция синтеза 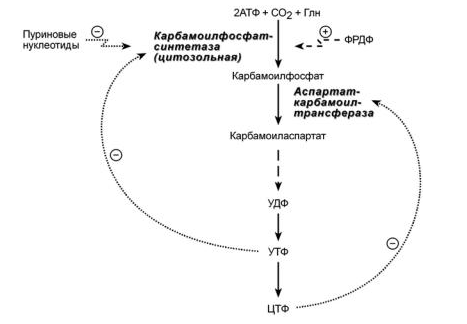 Синтез пиримидинов отрицательно регулируется также пуриновыми нуклеотидами АМФ и ГМФ. Лекарственная регуляция Фторурацил – противоопухолевое (цитостатическое) средство. Основной компонент 5-FdУМФ – конкурентный ингибитор фермента тимидилатсинтазы , что ведет к блокированию синтеза ДНК. Метотрексат, аминоптерин , триметоприм являются ингибиторами дигидрофолатредуктазы , что препятствует ресинтезу ТГФК и лишает реакцию кофермента. Оротатацидурия (или оранжевая кристаллоурия) может быть наследственной и приобретенной. Наследственная форма Наследственная форма оротатацидурии весьма редка и связана с одновременным дефектом оротатфосфорибозилтрансферазы и оротидилдекарбоксилазы. Заболевание проявляется на втором полугодии жизни гипохромной мегалобластической анемией, лейкопенией, отставанием умственного и физического развития. Диагноз ставится при обнаружении в охлажденной моче оранжевых игольчатых кристаллов оротовой кислоты. Болезнь осложняется тем, что при недостатке УТФ и ЦТФ активируются первые реакции синтеза оротовой кислоты. При отсутствии лечения гибель наступает в первые годы жизни. Однако, так как первопричиной заболевания является пиримидиновый голод", его можно достаточно успешно корректировать с помощью приема уридина, при этом серьезно не опасаясь передозировки. Приобретенная форма Эта более частая форма оротатацидурии может наблюдаться: при дефекте каких-либо ферментов синтеза мочевины, кроме карбамоилфосфатсинтетазы. При этом карбамоилфосфат митохондрий выходит из них и используется для избыточного синтеза оротовой кислоты. Заболевание обычно сопровождается гипераммониемией. при лечении подагры аллопуринолом, который превращается в оксипуринолмононуклеотид, являющийся ингибитором оротатдекарбоксилазы, что опять же ведет к накоплению оротата. 3. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра. Синтез пуриновых оснований происходит во всех клетках организма, главным образом в печени. Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.  Синтез инозинмонофосфата (ИМФ). 5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид – инозинмонофосфорная кислота (ИМФ). В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные ТГФК. В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ. 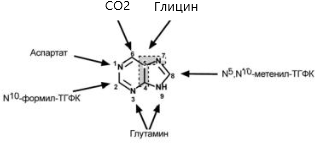 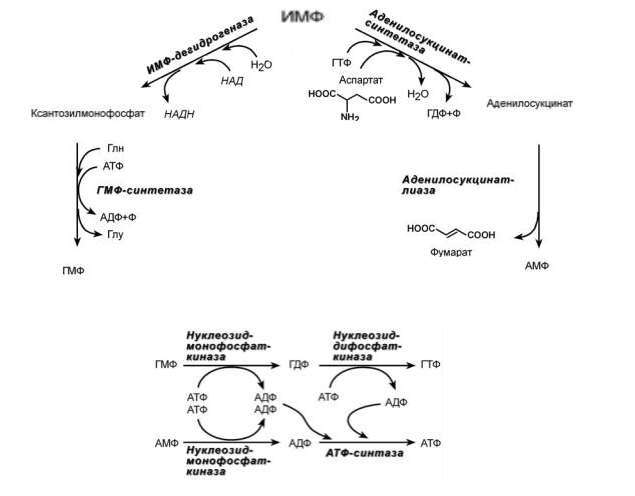 Наиболее активно катаболизм пуринов идет в печени, тонком кишечнике (пищевые пурины) и почках. 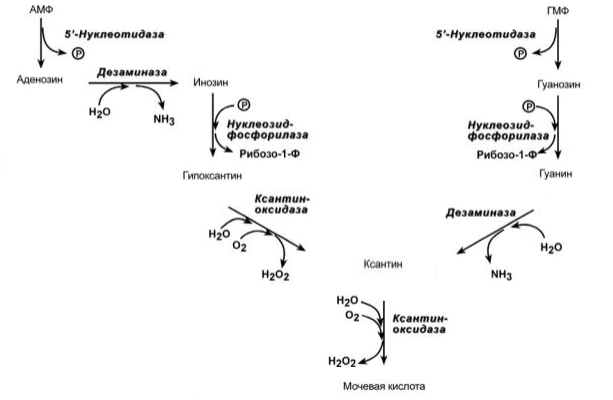 Регуляция 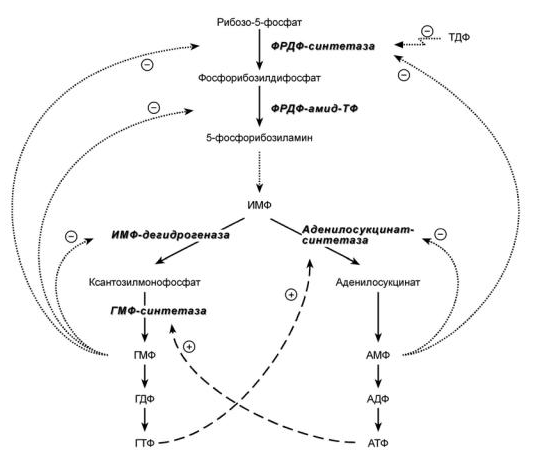 Лекарственная регуляция При разработке новых противоопухолевых средств были предложены ингибиторы таких ферментов как ФРДФ-амидтрансфераза (азосерин , диазонорлейцин ), ИМФ-дегидрогеназа ( микофеноловая кислота , 6-меркаптопурин ), аденилосукцинатлиаза ( 6-меркаптопурин ). Когда гиперурикемия принимает хронический характер, говорят о развитии подагры. В крови мочевая кислота находится в форме ее солей – уратов натрия. Растворимость уратов в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой, образуя тофусы. Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции – развивается подагрический артрит . В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног. Длительное время подагру считали "болезнью гурманов", однако затем внимание исследователей переместилось к наследственному изменению активности ферментов метаболизма пуринов: o увеличение активности ФРДФ-синтетазы – приводит к избыточному синтезу пуринов, o уменьшение активности гипоксантин-гуанин-фосфорибозил-трансферазы Оба ферментативных нарушения рецессивны и сцеплены с X-хромосомой. Подагрой страдает 0,3-1,7% взрослого населения земного шара, соотношение заболевших мужчин и женщин составляет 20 : 1. 4. Синтез дезоксирибонуклеотидов. Регуляция. Особенностью обмена пуринов и пиримидинов является то, что они могут образовывать не только рибонуклеотиды, но и дезоксирибонуклеотиды. Дезоксирибонуклеотидтрифосфаты необходимы клетке для синтеза ДНК. 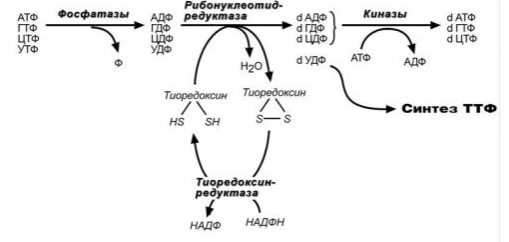 Три дезоксинуклеотида – dАТФ, dГТФ, dЦТФ сразу после синтеза используются для синтеза ДНК. Однако известно, что в составе ДНК нет уридиловых нуклеотидов, поэтому dУДФ не превращается в dУТФ, а идет на образование тимидилового нуклеотида. 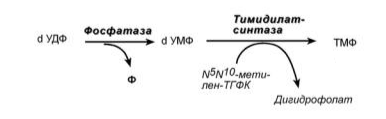 Регуляция синтеза дезоксирибонуклеотидов осуществляется на генетическом уровне путем индукции и репрессиии генов рибонуклеотидредуктазы, тимидилатсинтазы и тимидинкиназы. Кроме того, дАТФ является ингибитором восстановления всех остальных рибонуклеотиддифосфатов. 5. Первичная структура нуклеиновых кислот. ДНК и РНК – черты сходства и различия состава, локализации в клетке, функции. П  редставляет собой последовательность дезоксирибонуклеотидов, соединенных междусобой 3 ',5'-фосфодиэфирными связями. Свободный 3 '-конец содержит свободную гидроксильную группу и называется ОН-концом, 5 '-конец содержит фосфатную группу и называется Р-концом. Направление цепи в первичной структуре 5' →3'. Первичная структура определяет уникальность структуры и функциональную индивидуальность ДНК. редставляет собой последовательность дезоксирибонуклеотидов, соединенных междусобой 3 ',5'-фосфодиэфирными связями. Свободный 3 '-конец содержит свободную гидроксильную группу и называется ОН-концом, 5 '-конец содержит фосфатную группу и называется Р-концом. Направление цепи в первичной структуре 5' →3'. Первичная структура определяет уникальность структуры и функциональную индивидуальность ДНК. Сахарофосфатный остов в ДНК заряжен отрицательно благодаря заряду фосфатных групп. В то же время пуриновые и пиримидиновые основания гидрофобны. Цепи ДНК обладают направленностью, т.е. имеют 3'-конец и 5'-конец, цепи антипараллельны, т.е. направлены в разные стороны. Имеется комплементарность азотистых оснований: аденин комплементарен тимину (А=Т), гуанин комплементарен цитозину (Г≡ Ц).  6. Вторичная структура ДНК (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру ДНК. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность С 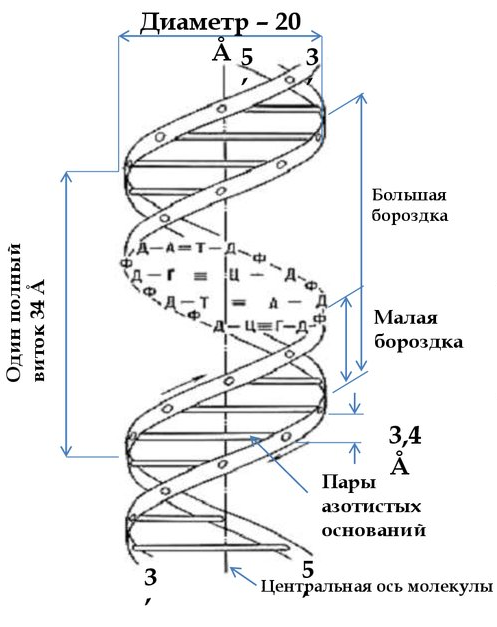 огласно модели Уотсона и Крика молекула ДНК состоит из двух комплементарных полинуклеотидных цепей. Каждая цепь ДНК представляет полинуклеотид, состоящий из нескольких десятков тысяч нуклеотидов. В ней соседние нуклеотиды образуют регулярный пентозо-фосфатный остов за счет соединения остатка фосфорной кислоты и дезоксирибозы прочной ковалентной связью. Азотистые основания одной полинуклеотидной цепи при этом располагаются в строго определенном порядке против азотистых оснований другой. Чередование азотистых оснований в полинуклеотидной цепи нерегулярно. огласно модели Уотсона и Крика молекула ДНК состоит из двух комплементарных полинуклеотидных цепей. Каждая цепь ДНК представляет полинуклеотид, состоящий из нескольких десятков тысяч нуклеотидов. В ней соседние нуклеотиды образуют регулярный пентозо-фосфатный остов за счет соединения остатка фосфорной кислоты и дезоксирибозы прочной ковалентной связью. Азотистые основания одной полинуклеотидной цепи при этом располагаются в строго определенном порядке против азотистых оснований другой. Чередование азотистых оснований в полинуклеотидной цепи нерегулярно.Расположение азотистых оснований в цепи ДНК является комплементарным (от греч. "комплемент" - дополнение), т.е. против аденина (А) всегда оказывается тимин (Т), а против гуанина (Г) - только цитозин (Ц). Это объясняется тем, что А и Т, а также Г и Ц строго соответствуют друг другу, т.е. дополняют друг другу. Такое соответствие задается химической структурой оснований, позволяющей образовать водородные связи в паре пурина и пиримидина. Между А и Т возникают две связи, между Г и Ц - три. Кроме того, установлено, что азотистые основания, имеющие ароматическую структуру, в водном растворе располагаются один над другим, формируя как бы стопку монет. Такой процесс формирования стопок из органических молекул называется стекинг. Водородные связи между комплементарными основаниями (по горизонтали) и стекинг-взаимодействие между плоскостями оснований в полинуклеотидной цепи за счет ван-дер-ваальсовых сил (по вертикали) обеспечивает молекуле ДНК дополнительную стабилизацию в пространстве. Сахарофосфатные остовы обеих цепей обращены наружу, а основания внутрь, навстречу друг другу. Направление цепей в ДНК антипараллельно (одна из них имеет направление 5'->3', другая - 3'->5', т.е. 3'-конец одной цепи расположен напротив 5'-конца другой.). Цепи образуют правые спирали с общей осью. Один виток спирали составляет 10 нуклеотидов, размер витка 3,4 нм, высота каждого нуклеотида 0,34 нм, диаметр спирали – 2,0 нм. В результате вращения одной цепи вокруг другой, образуется большая борозда (диаметром около 20 Å ) и малая борозда (около 12 Å) двойной спирали ДНК. Такая форма двойной спирали Уотсона-Крика в дальнейшем получила название В-формы. В клетках ДНК обычно существует в В-форме, которая является самой стабильной. Цепи ДНК и РНК обладают полярностью , каждая цепь имеет 5’и -3’-концы. Последовательность нуклеотидов в одиночной цепи ДНК и РНК записывается в направлении от 5’-конца к 3’-концу. Правила Чаргаффа сумма пуриновых нуклеотидов равна сумме пиримидиновых нуклеотидов, т. е. А+Г / Ц+Т = 1 содержание аденина равно содержанию тимина (А = Т, или А/Т=1); содержание гуанина равно содержанию цитозина (Г = Ц, или Г/Ц = 1); количество 6-аминогрупп равно количеству 6-кетогрупп оснований, содержащихся в ДНК: Г + Т = А + Ц; изменчива только сумма А + Т и Г + Ц. Если А+Т > Г-Ц, то это АТ-тип ДНК; если Г+Ц > А+Т, то это ГЦ-тип ДНК. 7. Гибридизация нуклеиновых кислот. Денатурация и ренативация ДНК. Гибридизация (ДНК-ДНК, ДНК-РНК). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот. Реакцию гибридизации используют в генетической инженерии для создания гибридных молекул ДНК, а также как эффективный метод для выявления определенных последовательностей в ДНК и РНК. Если водный раствор ДНК нагреть до температуры 96-100 °С и сильно защелочить (pH > 13,0), то ДНК диссоциирует на отдельные цепи. Этот процесс денатурации ДНК обратим, поскольку если две изолированные цепи ДНК выдерживать определенное время при 65 °С, то они вновь спариваются, образуя двойную спираль, что и называют ренатурацией, или гибридизацией (отжигом). Гибридизация может идти между одинарными цепями ДНК и/или РНК (конечно, если они имеют комплементарные последовательности нуклеотидов), что приводит к образованию двойных цепей (дуплексов) разного состава: ДНК : ДНК; РНК : РНК; ДНК : РНК. Полимеразная цепная реакция (ПЦР) - это метод амплификации (от лат. ampliticatio - распространение, увеличение) фрагментов нуклеиновых кислот in vitro. С его помощью можно достаточно быстро получить миллионы копий сегментов ДНК или РНК, даже когда они присутствуют в препарате в виде единственной молекулы. Вся полимеразная цепная реакция осуществляется in vitro с использованием ДНК-полимеразы и олигонуклеотидных праймеров, комплементарных двум З'-концам участков, ограничивающих амплифицируемый дуплексный сегмент. Для осуществления реакции необходимо знать нуклеотидную последовательность того участка, который желательно амплифицировать, чтобы можно было синтезировать соответствующие олигонуклеотидные праймеры. 8. Третичная структура ДНК. Роль гистоновых и негистоновых белков в компактизации ДНК. Организация хроматина. Ковалентная модификация гистонов и ее роль в регуляции структуры и активности хроматина. Третичная структура ДНК — это пространственная форма, которую принимает молекула ДНК по мере своего сворачивания и компактизации. Уровни структурной организации храмотина эукариот представлены ниже 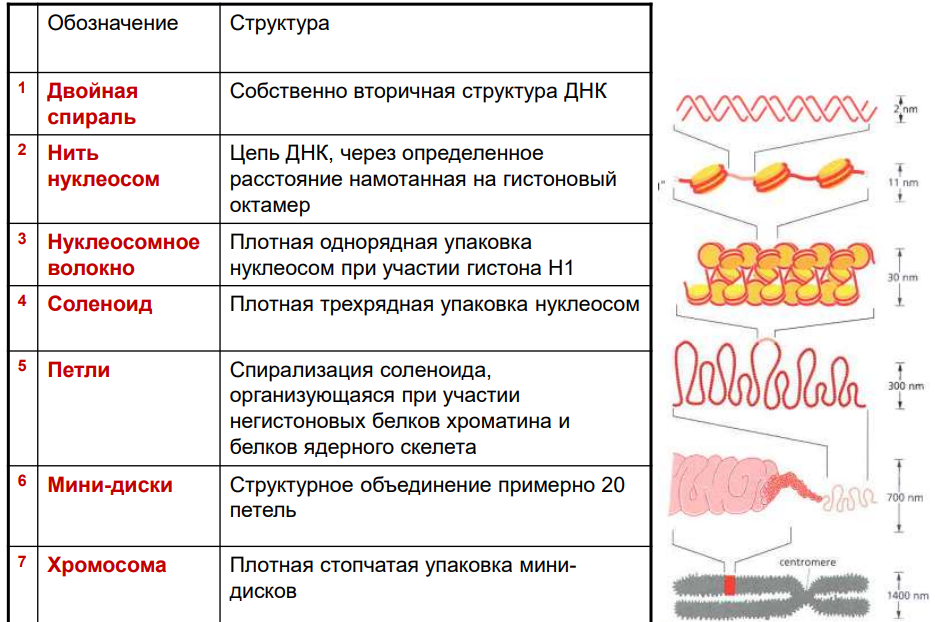 Все связывающиеся с ДНК эукариотов белки можно разделить на 2 группы: гисгоновые и негистоновые белки. Комплекс белков с ядерной ДНК клеток называют хроматином. Гистоны - белки содержащие много остатков аргинина и лизина, содержат структурный мотив α-спираль-поворот-α-спираль. Благодаря положительному заряду гистоны образуют ионные связи с отрицательно заряженными фосфатными группами, расположенными на внешней стороне двойной спирали ДНК. Существует 5 типов гистонов. Четыре гистона Н2А, Н2В, НЗ и Н4 образуют октамерный белковый комплекс (Н2А, Н2В, НЗ, Н4)2, который называют "нуклеосомный кор". Молекула ДНК "накручивается" на поверхность гистонового октамера, её называют "нуклеосома". Молекулы гистона H1 связываются с ДНК в межнуклеосомных участках и защищают эти участки от действия нуклеаз. Негистоновые белки хроматина. В ядре эукариотической клетки присутствуют сотни самых разнообразных ДНК-связывающих негистоновых белков. К этой группе относят семейство сайт-специфических белков типа "цинковые пальцы". К негистоновым белкам принадлежат также ферменты репликации, транскрипции и репарации. Хроматин представляет собой массу генетического вещества, состоящего из ДНК и белков. Хроматин в ядре содержится в виде эухроматина или гетерохроматина. Большая часть хроматина находится в менее компактной форме, эухроматин. Небольшой процент хроматина существует как гетерохроматин во время интерфазы. Этот хроматин плотно упакован, что не позволяет проводить транскрипцию гена. Гетерохроматин окрашивается красителями в более темный цвет, чем эухроматин. Аминокислотные остатки лизина, аргинина и концевые аминогруппы гистонов могут модифицироваться: ацетилироваться, фосфорилироваться, метилироваться или взаимодействовать с белком убиквитином (неги-стоновый белок). 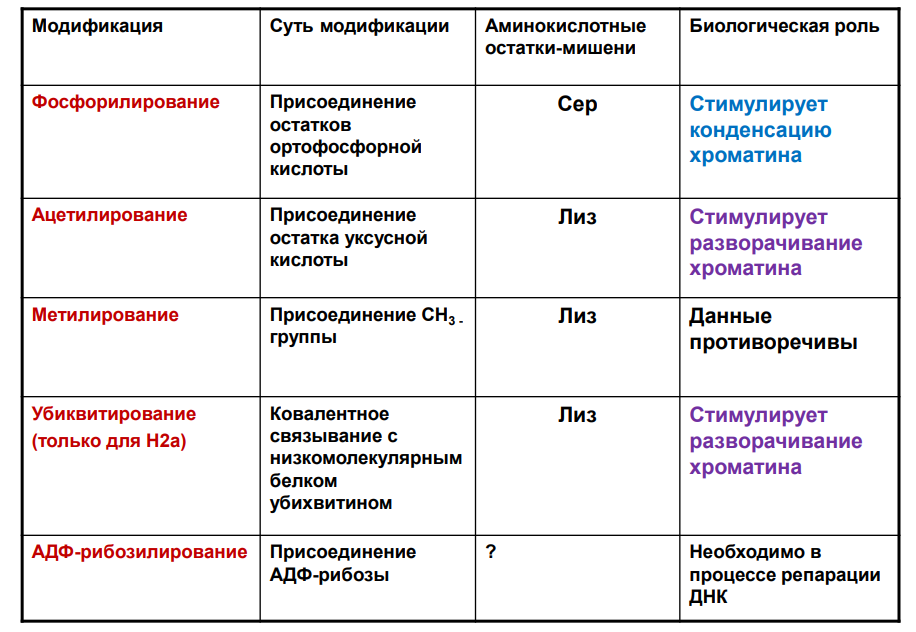 9. Репликация. Принципы репликации ДНК. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки Репликация ДНК процесс образования идентичных копий ДНК, осуществляемый комплексом ферментов и белков В ходе процесса репликации образуются две двойные спираль ДНК. Они абсолютно идентичны, так как каждая дочерняя клетка получает точно такие же молекулы, какие имела материнская. Сам процесс репликации осуществляется с помощью нескольких принципов. Принцип комплементарности. В каждой цепи молекулы ДНК содержится определенная последовательность нуклеотидов, которая точно комплементарна последовательности нуклеотидов на другой цепи. Азотистые основания (аденин, гуанин, тимин, цитозин) должны соединиться строго со Принцип антипараллельности. Каждая цепь ДНК имеет определенную ориентацию. Один из концов цепи несет гидроксильную группу (OH) у третьего атома углерода в молекуле дезоксирибозы, такой конец называется 3’ концом, а к другому концу цепи присоединен остаток фосфорной кислоты к пятому атому углерода в молекуле дезоксирибозы, это – 5’ конец. Две цепи молекулы ДНК расположены в противоположных друг от друга направлениях, то есть антипараллельно. Принцип полуконсервативности. После образования двух новых ДНК каждая из дочерних молекул «консервирует» одну цепь от материнской ДНК и одну дочернюю. униполярность - Синтез каждой дочерней цепи ДНК происходит комплементарно иантипараллельно матричной цепи и всегда в направлении 5' →3 Двунаправленность - в каждой точке начала репликации формируются 2 репликационные вилки, которые движутся в противоположных направлениях. Принцип согласованности репликации и клеточного деления. Каждый репликон должен реплицироваться один – и только один - раз за клеточный цикл. Стадии репликации. Инициация - Формирование репликативной вилки и Синтез праймера Элонгация - Асимметричный синтез ДНК Терминация - Вырезание праймеров и Сшивание отдельных фрагментов цепи ДНК Иницциация 1. Перед процессом репликации молекула ДНК должна быть раскручена (Фермент: ДНК-топоизомеразы). 2. Две нити должны быть разделены (как две стороны молнии), путем разрыва слабых водородных связей между нуклеотидами(Фермент : хеликаза). 3. После того, как нити ДНК были разделены, они должны бытьстабилизированы (SSB- белки). 4. Образование праймера (Фермент: праймаза). Синтез новой цепи ДНК требует затравки в виде небольшого фрагмента РНК, т.к.ведущий его фермент (ДНК-полимераза ) нуждается в свободной3'OH группе. Белки: Топоизомераза I разрывает только одну из двух цепей двойной спирали ДНК, расщепляя фосфодиэфирные связи. Топоизомераза II ковалентно связывается с обеими цепями двойной спирали ДНК и вносит в нее на время двухцепочечный разрыв. ДНК-геликазы осуществляют деспирализацию и денатурацию участка ДНК с использованием энергии гидролиза АТФ и образование репликационной вилки. Белки, связывающиеся с одноцепочечной ДНК (SSB – белки), это факторы, стабилизирующие одноцепочечную ДНК в области денатурации и препятствующие комплементарному спариванию двух цепей Праймаза – фермент, который инициирует синтез ДНК за счет синтеза небольшого фрагмента, состоящего из 11-12 рибонуклеотидов, - праймера или затравки (РНКпраймер). 10. Элонгация и терминация. Ферменты. Асимметричный синтез ДНК. Фрагменты Оказаки. Роль ДНК-лигазы в формировании непрерывной отстающей цепи. Элонгация характеризуется удлинением вновь синтезируемых цепей, которое осуществляется ДНК-полимеразой, входящей в состав реплисомы, во время ее продвижения по матрице: непрерывный рост лидирующей цепи; прерывистый синтез фрагментов Оказаки на отстающейцепи; контроль ошибок спаривания оснований во время репликации и их исправление при помощи 3'→5' экзонуклеазы из состава ДНК-полимеразы. Необходимо подчеркнуть что: - считывание информации с матрицы осуществляетсятолько в направлении 3'→5' - синтез новой цепи осуществляется только в направлении5'→3'. Репликационная вилка асимметрична. Из двух синтезированных дочерних цепей ДНК: - одна цепь синтезируется непрерывно в направлении5'→3' и называется ведущей (лидирующей) цепью. Она считывается в направлении 3'→5' с матричной цепи 3'→5'; - другая цепь синтезируется с матричной цепи 5'→3'. Считывание происходит также в направлении 3'→5', а новую цепь называют отстающей цепью. Она синтезируется прерывисто, с образованием фрагментов Оказаки. Длина фрагментов Оказаки у прокариот составляет - 1000-2000, а уэукариот – 100-200 нуклеотидов. Терминация включает следующие процессы: удаление РНК-праймеров 5'→3' экзонуклеазой, представляющей собой субъединицу ДНК-полимеразы; заполнение недостающих участков ДНК-полимеразой; связывание фрагментов вновь синтезированной ДНК спомощью лигаз При встрече двух репликационных вилок процесс репликации останавливается, фермент ДНК-лигаза связывает все фрагменты, предварительно удаляются праймеры и заполняются недостающие фрагменты. 11. Теломерная ДНК. Синтез теломерной ДНК. На каждом конце хромосомы присутствует специфическая нуклеотидная последовательность. Она представлена повторами олигонуклеотидов -GGGTTA-, называемых теломерной ДНК. Н  аличие теломер необходимо для завершения репликации концевых информативных последовательностей хромосом, т.е. для сохранения генетической информации. аличие теломер необходимо для завершения репликации концевых информативных последовательностей хромосом, т.е. для сохранения генетической информации. После завершения репликации хромосомы 5'-концы дочерних цепей ДНК недостроены, так как после удаления праймеров эти фрагменты оказываются недореплицированными. Это происходит потому, что ДНК-полимераза в, отвечающая за заполнение бреши, образованной после удаления праймера, не может вести синтез цепи ДНК от 3'- к 5'-концу. Таким образом, в ходе каждого цикла репликации 5'-концы синтезированных цепей укорачиваются. Но такие потери не представляют опасности для генетической информации хромосом, потому что укорочение ДНК идёт за счёт теломер. Во время следующего цикла репликации 5'-концы цепей ДНК опять остаются недостроенными. Таким образом, с каждым клеточным делением ДНК хромосом будут последовательно укорачиваться. Укорочение теломер в большинстве клеток по мере их старения - важный фактор, определяющий продолжительность жизни организма. В эукариотических клетках имеется фермент (нуклео-тидилтрансфераза), обеспечивающий восстановление недореплицированных 5'-концов. К особенностям этого фермента относят присутствие в качестве простетической группы РНК. Фрагмент РНК в активном центре теломеразы служит матрицей при синтезе теломерных повторов хромосом. С помощью РНК фермент комплементарно прикрепляется к 3'-концу недостроенной дочерней цепи ДНК. Теломераза по принципу комплементарности последовательно удлиняет 3'-конец цепи ДНК на один гексануклеотид -GGGTTA-. Синтез всегда идёт от 5'- к 3'-концу. Затем теломераза смещается по цепи ДНК на один теломер и начинает синтез нового фрагмента -GGGTTA-. В большинстве соматических клеток теломераза неактивна, так как соматическая клетка имеет длину теломерной ДНК, достаточную для времени жизни клетки и её потомства. Однако небольшую активность теломеразы обнаруживают в клетках с высокой скоростью обновления, таких как лимфоциты, стволовые клетки костного мозга, клетки эпителия, эпидермиса кожи и др. 12. Повреждения и репарация ДНК. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни. Репарация. Репарация генетических повреждений – свойство живыхорганизмов восстанавливать повреждения, возникающие в ДНК спонтанно или в результате воздействия разнообразных повреждающих факторов. От того, как клетки справляются с повреждениями, зависят такие кардинальные процессы, как появление наследственных болезней ираковых опухолей, старение. Виды повреждений •Репарируемые удаляются собственными системами клеток •Нерепарируемые возникают редко •Спонтанные возникают без каких либо направленных воздействий Апуринизация – гидролитическое отщепление азотистых оснований Дезаминирование - гидролитическое отщепление аминогруппы отазотистого основания Метилирование – перенос метильной группы метилирующего агента наопределенные азотистые основания Окисление азотистых оснований вызывается различными активнымиформами кислорода •Индуцированные возникают под действием физических, химических или биологических факторов Образование пиримидиновых димеров (УФ-облучение) Размыкание пуринового кольца (окисление свободными радикалами) Однонитевые и двунитевые разрывы в ДНК (ионизирующая радиацияи др.) Сшивки между цепями ДНК (химические агенты) Репарации бывают: 1. На этапе репликации. Выполняют ДНК-полимеразы • Первичный отбор нуклеотидов идет по принципу комплементарности. Способностью к этому виду отбора обладают ДНК-полимеразы благодаря полимеразной 5'→3'активности. • Редактирующий отбор. Проводят полимеразы, обладающие экзонуклеазной 3‘-5‘ активностью 2. Исправление ошибок в уже синтезированной ДНК(репарация). Ферменты репарации |
