Биохимия. бх итоговая 28. 1. Общая схема распада нуклеиновых кислот пищи, ферменты, субстраты, продукты
 Скачать 3.06 Mb. Скачать 3.06 Mb.
|
|
Прямая репарация - прямое восстановление исходной структуры ДНК или удаление повреждений 1. Фотореактивация (прямая репарация димеров). Фермент фотолиаза расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. 2. Репарация АП-сайтов за счет прямой вставки нуклеотидов. Ферменты инсертазы могут вставлять в брешь такое же основание, которое было до поражения и соединять его с дезоксирибозой.Структура ДНК приобретает исходный неповрежденный вид. Эксцизионная репарация происходит в несколько этапов, сопровождается вырезанием большого фрагмента цепи ДНК Основные этапы Узнавание повреждения(ДНК эндонуклеаза) Разрез цепи ДНК ферментом по обе стороны от повреждения Эксцизия (вырезание и удаление участка ДНК) Восстановление структуры ДНК (ДНК –полимераза) Сшивание концов ДНК(лигаза) Дефекты репарационных систем инаследственные болезни Изменения сосудов конъюнктивыпри синдроме Луи-Бара. Пигментная ксеродермия (пятна, короста,рак кожи) – нарушение репарации УФ –повреждений Синдром блума (глубокие поражениякапилляров на лице)– мутация ДНКлигазы 13. Транскрипция у прокариот. Характеристика компонентов системы синтеза РНК. Структура ДНК-зависимой РНК-полимеразы: роль субъединиц ( a 2 ВВ ′ d ). Инициация процесса. Транскрипция - это синтез всех видов РНК (мРНК, рРНК, tРНК) на матрице ДНК, осуществляемый ферментом ДНК-зависимойРНК-полимеразой. Как в любом матричном биосинтезе в транскрипции выделяют 5 необходимых элементов: матрица – одна из цепей ДНК, растущая цепь – РНК, субстрат для синтеза – рибонуклеотиды (УТФ, ГТФ, ЦТФ, АТФ), источник энергии – УТФ, ГТФ, ЦТФ, АТФ. ф 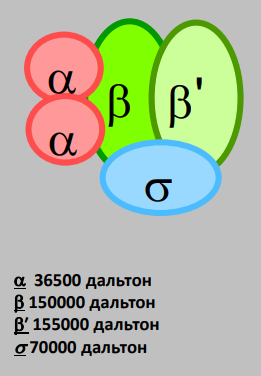 ерменты РНК-полимеразы и белковые факторы транскрипции. ерменты РНК-полимеразы и белковые факторы транскрипции.У прокариот синтез всех видов РНК. Субъединичный состав РНК-полимеразы Е.coli (2a)bb′ - holo-фермент (полный фермент). Без сигма-фактора это core-фермент (2a)bb′. Две a субъединицы - каркас РНК-полимеразы. К ним крепятся остальные субъединицы. b′ - субъединица отвечает за прочное связывание с ДНК за счет кластера положительно заряженных аминокислот. В b - субъединице находятся два каталитических центра. Один отвечает за инициацию, а другой - за элонгацию. Один центр работает в holo-, а другой - в core- ферменте. сигма - фактор - сменный фактор специфичности. • У сигма- фактора низкое сродство к ДНК по сравнению сдругими субьединицами РНК-полимеразы, однако онпридает holo-ферменту такую конформацию, которая обладает повышенным сродством к промотору. •Стадии узнавания и связывания, а также инициацииосуществляются holo-ферментом. •Элонгация и терминация осуществляются core-ферментом. Инициация Узнавание и прочное связывание. Как только произошло узнавание (позиция 1), РНК-полимераза перемещается в позицию 2. В каталитическом центре инициации транскрипции, находящемся в b -субъединице, оказывается +1-ый нуклеотид оперона. Переход из позиции 1 в позицию 2 возможен, если на операторе нет белка-репрессора. Первый нуклеотид в РНК всегда пурин в форме трифосфата Инициация заключается в образовании первойфосфодиэфирной связи между пурин-трифосфатом (АТФ или ГТФ) и следующим нуклеотидом. После инициации сигма- фактор покидает фермент. 14. Элонгация, терминация транскрипции (ρ-независимая, ρ-зависимая терминация) Элонгация - последовательное наращивание цепи РНК(или продолжение транскрипции). Скорость элонгации 40-50 нукл./сек Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы вдоль ДНК и расплетают молекулу ДНК на протяжении примерно 17 нуклеотидных пар. РНК-полимераза продвигается со скоростью 40-50 нуклеотидов в секунду в направлении 5'→3'. Фермент использует АТФ, ГТФ, ЦТФ, УТФ одновременно в качестве субстрата и в качестве источника энергии. Терминация. Специфическая терминация бывает ρ- независимой и ρ-зависимой. ρ- независимая. В терминаторе присутствует палиндром, поэтому в синтезируемой РНК формируется шпилька. Шпилька меняет конформацию РНК-полимеразы и фермент теряет сродство к ДНК. 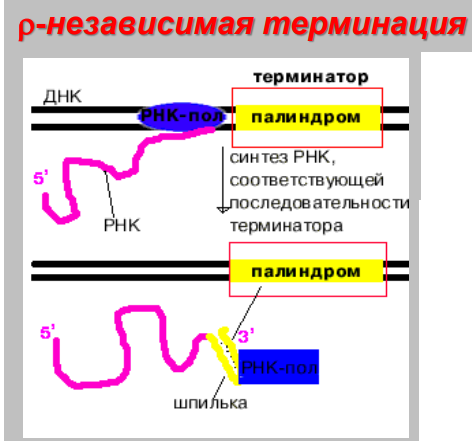 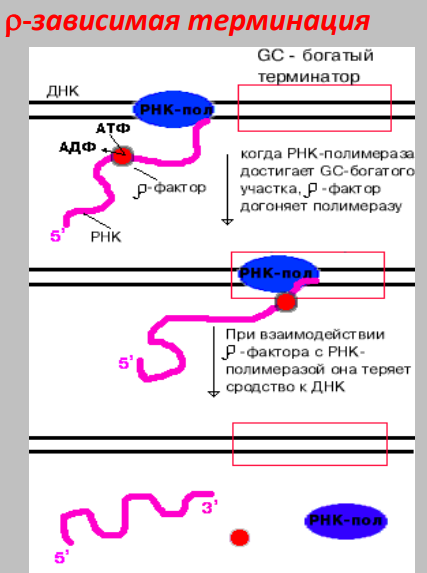 ρ- зависимая.ρ- фактор - это имеющийчетвертичную структуру белок,обладающий АТФ-азной активностью. ρ- фактор способен узнавать 5`-конец синтезируемой РНК длиной приблизительно 50 нуклеотидов, садиться на него и двигаться по РНК с такой же скоростью, скоторой РНК-полимераза движетсяпо ДНК. В терминаторе много Г-Ц пар (с тремя водородными связями), РНК-полимераза замедляет ход, ρ-фактор ее догоняет, изменяет конформацию фермента - и синтез РНК прекращается. 15. Особенности транскрипции у эукариот. Структура белков, регулирующих процесс транскипции. Особенности транскрипции эукариот Существуют специализированные ядерные РНК-полимеразы: РНК-полимераза I - синтезирует пре -rРНК (кроме 5S rРНК). РНК-полимераза II - синтезирует пре-mРНК и мяРНК. РНК-полимераза III - синтезирует пре-tРНК, и 5SrРНК. Кроме ядерных РНК-полимераз у эукариот есть еще РНК-полимеразы хлоропластов и митохондрий. Кодируются в ядре. Единицей транскрипции у эукариот является отдельный ген, а не оперон, как у прокариот. Оператор, как таковой, отсутствует. Промотор есть, но он организован иначе. На расстоянии -25 п.н. от +1 нукл. находится ТАТА-бокс. Его позиция определяет точку инициации транскрипции. На расстоянии -60-80 п.н. находится ЦААТ-бокс, который не является абсолютно необходимым, но присутствует перед большинством генов. Расстояние между ЦААТ и ТАТА большое и РНК-полимераза не способна накрыть всю эту область. ЦААТ опознается своим белком, а ТАТА - своим. Помимо этих есть еще несколько белков, называемых базальными факторами транскрипции Базальные факторы транскрипции - белки, необходимые для инициации транскрипции. Базальные факторы транскрипции необходимы дляинициации транскрипции всеми тремя ядерными РНК-полимеразами. TFIID – основной фактор транскрипции D для РНК полимеразы II TF2F - привлечение РНК-полимеразы 2 на промотор Для любого гена, кодирующего белок, есть энхансеры • 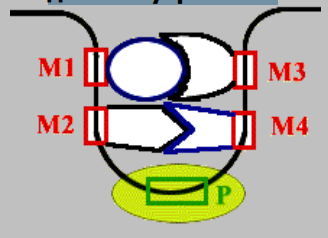 Определение: энхансеры - последовательности ДНК, усиливающие транскрипцию при взаимодействии со специфическими белками. Определение: энхансеры - последовательности ДНК, усиливающие транскрипцию при взаимодействии со специфическими белками. Энхансеры - это не непрерывные последовательностинуклеотидов. Существуют так называемые модули - это отдельные части энхансеров. Одинаковые модули могут встречаться в разных энхансерах. Для каждого энхансера набор модулей уникален. Модули - это короткие последовательности, не более 2-хвитков спирали (20 п.н.), которые могут находиться перед, за и даже внутри гена. Таким образом, М1+М2+М3+М4 - один энхансер, но он состоит из 4-х модулей. Все 4 модуля узнаются своими белками, а они, сидя на ДНК, взаимодействуют друг с другом. Если в клетке присутствуют все соответствующие белки, то участку ДНК придается определенная конформация и начинается синтез mРНК. Определение: сайленсеры - последовательности ДНК, ослабляющие транскрипцию при взаимодействии с белками. 16. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль. Процессинг РНК – стуктурное и химическое созревание вновь синтезированных молекул  Сразу после синтеза первичные транскрипты РНК по разным причинам еще не имеют активности, являются "незрелыми" и в дальнейшем претерпевают ряд изменений, которые называются процессинг . При транскрипции участков ДНК, несущих информацию о белках, образуются гетерогенные ядерные РНК, по размеру намного превосходящие мРНК. Дело в том, что из-за мозаичной структуры генов эти гетерогенные РНК включают в себя информативные (экзоны ) и неинформативные ( интроны ) участки. 1. Кэпирование (англ. cap – шапка) – происходит еще во время транскрипции. Процесс состоит в присоединении к 5'-трифосфату концевого нуклеотида пре-мРНК 5'-углерода N 7 -метил-гуанозина. "Кэп" необходим для защиты молекулы РНК от экзонуклеаз, работающих с 5'-конца, а также для связывания мРНК с рибосомой и для начала трансляции. защищает транскрипт от деградации 5’-экзонуклеазами (благодаря 5’-5’ связи) требуется для экспорта из ядра стимулирует полиаденилирование стимулирует сплайсинг обеспечивает связывание мРНК срибосомой в цитоплазме 2. Полиаденилирование – при помощи полиаденилат-полимеразы с использованием молекул АТФ происходит присоединение к 3'-концу РНК от 100 до 200 адениловых нуклеотидов, формирующих полиадениловый фрагмент – поли(А)-хвост. Поли(А)-хвост необходим для защиты молекулы РНК от экзонуклеаз, работающих с 3'-конца. Облегчает выход мРНК из ядра Замедляет ее гидролиз в цитоплазме(определяет время жизни мРНК) 3.. Сплайсинг (англ. splice – склеивать встык) – особый процесс, в котором при участии малых ядерных РНК происходит удаление интронов и сохранение экзонов. Сплайсинг проходит в специальной внутриядерноймногокомпонентной структуре – сплайсосоме (десятки белков и 6 типов малых ядерных РНК,обеспечивающие сплайсинг), которая распознает интроны по определенным последовательностям. В ее состав входит мя-РНК. Самам по себе представляет из себя комплекс из малых ядерных РНК и белков. 17. Регуляция транскрипции у прокариот. Теория оперона, регуляция по типу индукции и репрессии (примеры). Регуляция биосинтеза белка у прокариот осуществляется на уровне изменения скорости синтеза мРНК. В настоящее время принята теория оперона , сформулированная Франсуа Жакобом и Жаком Моно. В основе теории лежат следующие понятия: оперон – группа тесно связанных между собой генов, которые программируют образование структурных белков и ферментов в клетке, конституитивные гены – это гены, обеспечивающие основные жизненные функции клетки, "гены домашнего хозяйства". Эти гены работают в клетке всегда, независимо от ее активности и условий, индуцибельные гены – это гены, которые активируются при необходимости, ген-регулятор – ген, регулирующий работу оперона, но не входящий в его состав. Он синтезирует белок-регулятор (чаще называемый белок- репрессор ), который может быть в активной или неактивной форме, ген-оператор – участок ДНК, способный связываться с белком-регулятором , и "решающий" нужно работать РНК-полимеразе или нет.  Предложены две схемы регуляции скорости транскрипции: по механизму индукции (лактозный оперон) и по механизму репресии (триптофановый оперон). Индукция Лактозный оперон в целом отвечает за катаболизм лактозы. При изучении E.coli было замечено, что в клетке может быть две взаимоисключающие ситуации: активность одного из ферментов катаболизма лактозы низка, если в среде имеется много глюкозы. активность этого же фермента резко повышается в обратной ситуации, т.е. при отсутствии глюкозы и при наличии лактозы. На основании наблюдений была предложена схема регуляции оперона по механизму индукции : 1. При отсутствии лактозы активный белок-репрессор связывается с оператором и блокирует синтез мРНК, кодирующей ферменты катаболизма лактозы. В результате эти ферменты не образуются. 2. Если глюкозы нет, а лактоза есть, то последняя связывается с белком-репрессором и ингибирует его, не давая ему связаться с геном-оператором и препятствовать работе РНК-полимеразы. Это позволяет РНК-полимеразе считывать информацию, отвечающую за синтез ферментов катаболизма лактозы, и синтезировать мРНК. Репрессия Триптофановый оперон в целом отвечает за синтез триптофана. Функционирование триптофанового оперона в некотором смысле противоположно лактозному. Регуляция осуществляется по механизму репрессии . 1. В отличие от лактозного оперона, белок-репрессор синтезируется в неактивном состоянии и не может заблокировать транскрипцию генов, кодирующих ферменты синтеза триптофана. Синтез этой аминокислоты будет в клетке продолжаться до тех пор, пока в питательной среде не появится триптофан. 2. Триптофан соединяется с белком-репрессором и активирует его. Далее такой активный комплекс присоединяется к гену-оператору и блокирует транскрипцию. Таким образом, при наличии триптофана в среде прекращается его внутриклеточный синтез, экономятся ресурсы и энергия бактериальной клетки. В этом случае триптофан является репрессором транскрипции. 18. Механизмы регуляции экспрессии генов у эукариот. Многоклеточные эукариоты состоят из различных типов клеток, разнообразие которых обусловлено дифференциальной экспрессией генов, определяющих синтез тканеспецифических белков. У эукариот продукты регуляторных генов могут как подавлять, так и активировать экспрессию регулируемых генов. При этом у них преобладает позитивный контроль транскрипции. У эукариот каждый ген регулируется самостоятельно. Репрессоры иактиваторы, регулирующие транскрипцию, могут связываться или с промотором или другими регуляторными последовательностями, расположенными в пределах или по обе стороны от промотора. Для присоединения РНК-полимеразы II к промотору необходимо формирование транскрипционного комплекса. В его образовании принимают участие регуляторные белки – факторы транскрипции. При условии образования устойчивого транскрипционного комплекса происходит экспрессия определённого гена. В регуляции активности эукариотических генов принимают участие также энхансеры и сайленсеры. Энхансеры (англ. to enhance – усиливать) – это участки ДНК в 10-20 пар оснований, способные значительно усиливать экспрессию генов той же ДНК. В отличие от промоторов они значительно удалены от транскрипционного участка и могут располагаться от него в любом направлении (к 5'-концу или к 3'-концу). Сами энхансеры не кодируют какие-либо белки, но способны связываться с регуляторными белками (подавляющими транскрипцию). Сайленсеры (англ. silence – молчание) – участки ДНК, в принципе схожие с энхансерами, но они способны замедлять транскрипцию генов, связываясь с регуляторными белками (которые ее активируют). В регуляции генной активности у эукариот играют значительную гистоновые белки хромосом. Условием для транскрипции у эукариот является ослабление связи ДНК с гистоновыми белками на определённом участке хроматина. Перестройка генов. К подобным процессам относится кроссинговер – обмен участками гомологичных хромосом, и более сложный процесс – сайт-специфичная рекомбинация, которая изменяет положение и порядок нуклеотидных последовательностей в геноме. Лекарственная регуляция транскрипции Ингибирование 1. Гетероциклические соединения доксорубицин, дауномицин и актиномицин D обладают способностью интеркалировать (встраиваться между нитей молекулы ДНК) между двумя соседними парами оснований Г-Ц. В результате возникает препятствие для движения РНК-полимеразы ("заедание молнии") и остановка транскрипции. 2. Рифампицин связывается с β-субъединицей РНК-полимеразы прокариот и ингибирует ее. Благодаря такой избирательности действия рифампицин действует только на бактерии и является препаратом для лечения туберкулеза. 3. α-Аманитин, октапептид бледной поганки (Amanita phalloides) блокирует РНК-полимеразу II эукариот и предотвращает продукцию мРНК. Активация Активация транскрипции используется в клинике намного реже и заключается в применении аналогов стероидных гормонов для достижения анаболического эффекта в органе-мишени. 19. Постранскрипционная регуляция у эукариот, обеспечивающая разнообразие белков: альтернативный сплайсинг. Редактирование РНК. Посттранскрипционная регуляция осуществляется на уровне мРНК в период после окончания их синтеза и до начала трансляции. Этот этап можно разделить на несколько подэтапов или разновидностей: - модификации предшественников зрелой мРНК (альтернативный сплайсинг, кэпирование, присоедиение поли-А-конца); - транспорт и депонирование зрелой мРНК; - РНК-сайленсинг; - деградация мРНК. Альтернативный сплайсинг- это образование разных мРНК из одной и той же пре-мРНК, синтезированной с одного гена. Это достигается благодаря комбинированию порядка и количества экзонов. С одного и того же гена синтезируются разные белки. Это явление тканеспецифично и зависит от стадии клеточного цикла. Тропомиозин, белок, участвующий в мышечном сокращении. В разных клетках с гена тропомиозина синтезируются разные белки (изоформы) Регуляция экспрессии генов путем альтернативного сплайсинга Один ген обеспечивает образование изоформ белка, специфичных для различных конкретных тканей Экономичное использование одного РНК предшественника Редактирование РНК (editing) добавление нуклеотидов: - достройка ССА-конца тРНК; - вставка U внутрь мРНК химическая модификация оснований: - аденозин → инозин - цитозин → урацил. 20. Биосинтез белков (трансляция). Основные компоненты белоксинтезирующей системы: аминокислоты, т-РНК, рибосомы, источники энергии, белковые факторы, ферменты. Трансляция - циклический энергозависимый многоступенчатый процесс, в котором свободные аминокислоты полимеризуются в генетически запрограмированную последовательность собразованием полипептидов Основные компоненты белоксинтезирующей системы
Примечания: elF (eukaryotic initiation factors) — факторы инициации; eEF (eukaryotic elongation factors) — факторы элонгации; eRF (eukaryotic releasing factors) — факторы терминации. 21. Строение и функции рибосом. Связывающие и каталитическик центры рибосом. Рибосомы представляют собой рибонуклео- протеиновые образования — своеобразные «фабрики», на которых идёт сборка аминокислот в белки. Эукариотические рибосомы имеют константу седиментации 80S и состоят из 40S (малой) и 60S (большой) субъединиц. Каждая субъединица включает рРНК и белки. В 40S субъединицу входит рРНК с константой седиментации 18S и около 30 — 40 белков. В 60S субъединице обнаружено 3 вида рРНК: 5S, 5,8S и 28S и около 50 различных белков. Белки входят в состав субъединиц рибосомы в количестве одной копии и выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой или пептидом. В присутствии мРНК 40S и 60S субъединицы объединяются с образованием полной рибосомы, масса которой примерно в 650 раз больше массы молекулы гемоглобина. Каталитические центры рибосом • 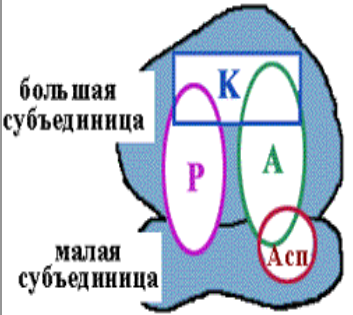 Р-центр - пептидильный. При инициации в нем находится (формил) метионин, при элонгации растущая цепь пептида. Р-центр - пептидильный. При инициации в нем находится (формил) метионин, при элонгации растущая цепь пептида.• А-центр - аминоацильный. На этапе элонгации в нем находится новая аминокислота или растущая цепь пептида • Асп - участок специфического узнавания. Здесь происходит взаимодействие кодон-антикодон • К-центр - каталитический (фермент пептидилтрансфераза). Обеспечивает формирование пептидной связив растущей цепи пептида У эукариотов различают рибосомы 2 типов: «свободные», обнаруживаемые в цитоплазме клеток, и связанные с эндоплазматическим ретикулумом (ЭР). Рибосомы, ассоциированные с ЭР, ответственны за синтез белков «на экспорт», которые выходят в плазму крови и участвуют в обновлении белков ЭР, мембраны аппарата Гольджи, митохондрий или лизосом. Митохондрии содержат свой набор рибосом. Митохондриальные рибосомы мельче, чем рибосомы эукариотов, прокариотов и имеют константу седиментации 55S. Они также состоят из двух субъединиц, но отличаются от эукариотических рибосом количеством и составом рРНК и белков. 22. Активация аминокислот. Аминоацил-т-РНК синтетазы, субстратная специфичность. В цитозоле клеток 20 различных аминокислот присоединяются α-карбоксильной группой к 3'-гидроксильному акцепторному концу соответствующих тРНК с образованием сложноэфирной связи. Эти реакции катализирует семейство ферментов, носящее название аминоацил-тРНК синтетаз (аа-тРНК-синтетаз). Каждый член этого семейства узнаёт только одну определённую аминокислоту и те тРНК, которые способны связываться с этой аминокислотой. Из этого следует, что в группу тРНК синтетаз входит 20 различных ферментов. Они осуществляют активацию аминокислот в 2 стадии: на первой стадии аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения — аминоацил- АМФ. На второй стадии аминоацильный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой, соответствующей тРНК с образованием аминоацил- тРНК 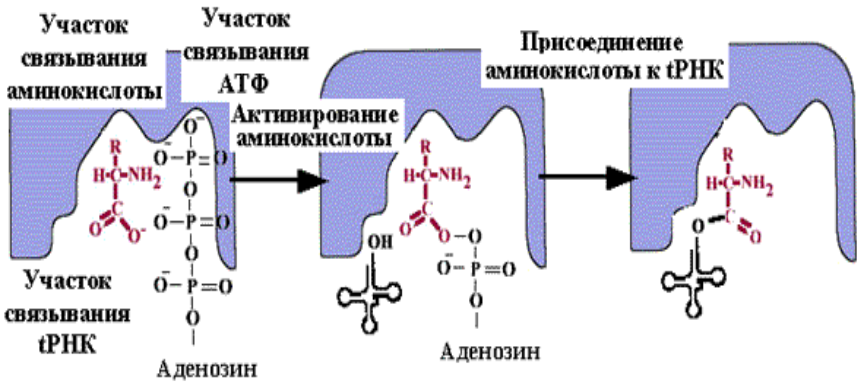 Суммарную реакцию, катализируемую аминоацил-тРНК синтетазами в присутствии ионов Мg 2+ , можно представить следующим образом: Аминокислота +тРНК + АТФ —> аминоацил- тРНК + АМФ + РРi. Аминокислоты присоединяются к 3'- или 2'-ОН группам рибозы на 3'-конце тРНК, где все тРНК имеют общую нуклеотидную последовательность -ССА. Чрезвычайно высокая специфичность аа- тРНК синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. В активном центре этих ферментов есть 4 специфических участка для узнавания: аминокислоты, тРНК, АТФ и четвёртый — для присоединения молекулы Н2O, которая участвует в гидролизе неправильных аминоациладенилатов. За счёт существования в активном центре этих ферментов корректирующего механизма, обеспечивающего немедленное удаление ошибочно присоединённого аминокислотного остатка, достигается поразительно высокая точность работы: на 1300 связанных с тРНК аминокислот встречается только одна ошибка. 23. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса у прокариот. Особенности стадии инициации у эукариот. 1 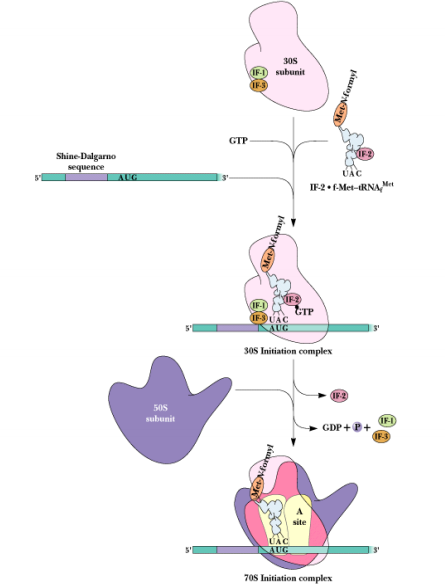 . мРНК связывается с малой субъединицей рибосомы, инициирующий кодон устанавливается в Р-центре . мРНК связывается с малой субъединицей рибосомы, инициирующий кодон устанавливается в Р-центре2. Инициирующая тРНК (несущая формилметионин) связывается с инициирующим кодоном 3. Большая субъединица соединяется с малой субъединицей – образуется инициаторный комплекс IF-3–препятствует преждевременному связыванию субъединиц рибосом IF-2+ГТФ-участвуют в связыванииинициирующей тРНК IF-1-способствует новой «зарядке» еIF2 (присоединяя к нему очередную молекулу ГТФ иинициирующую тРНК) Последовательность Шайна — Дальгарно — сайт связывания рибосом на молекуле мРНК прокариот, обычно на расстоянии около 10 нуклеотидов до стартового кодона AUG. Правильное установление инициирующего кодона AUG в Р-центремалой субъединицы рибосомы обеспечивается за счет комплементарного взаимодействия 3'-концевого участка 16S rРНК и последовательности Шайна-Дальгарно • У прокариот перед каждым геном и соответственно в mРНК перед копией каждого гена имеется лидерная последовательность. • Она может быть разного размера(до 160 нукл.) и разной первичнойструктуры, но обязательно содержит полипуриновую последовательность Шайна-Дальгарно, которая комплементарна 3'-концевомуучастку 16S rРНК. Комплементарными могут быть 3-9 нуклеотидов. Эукариоты. . Для инициации трансляции необходимо также наличие определённых нуклеотидных последовательностей в районе стартового кодона (последовательность Шайна — Дальгарно у прокариот и последовательность Козак у эукариот). Процесс инициации обеспечивается специальными белками — факторами инициации (англ. initiation factors, IF; инициаторные факторы эукариот обозначают eIF, от англ. eukaryotes). Механизмы инициации трансляции у про- и эукариот существенно отличаются: прокариотические рибосомы потенциально способны находить стартовый AUG и инициировать синтез на любых участках мРНК, в то время как эукариотические рибосомы обычно присоединяются к мРНК в области кэпа и сканируют её в поисках стартового кодона. Кэп-зависимый механизм. В отличие от прокариот, инициация трансляции у которых обеспечивается лишь тремя белковыми факторами, трансляция подавляющего большинства мРНК эукариот, содержащих 5'-кэп [m7G(5')ppp(5')N] и 3' поли(А)-хвост, требует участия, по крайней мере, 13 общих эукариотических факторов инициации (eIF), представленных 31 полипептидом. Инициация трансляции включает события между диссоциацией рибосомы во время терминации в предыдущем цикле трансляции и сборкой рибосомы, готовой к элонгации, на старт-кодоне мРНК. 24. Элонгация: образование пептидной связи (р-ция транспептидации). Транслокация. Терминация. Роль белковых факторов на каждой из стадий трансляции. 2. Элонгация Аминоацильный конец формилметиониновой tРНК находится в Р-центре. Второй кодон гена оказывается в Асп-участке Соответствующая ему аминоацил-tРНК устанавливается таким образом, что ее аминоацильный конец попадает в А-центр. Пептидилтрансфераза отрывает формилметионин в Рцентре и переносит его в А-центр. Образуется пептидная связь между формилметионином иаминоацил-tРНК. 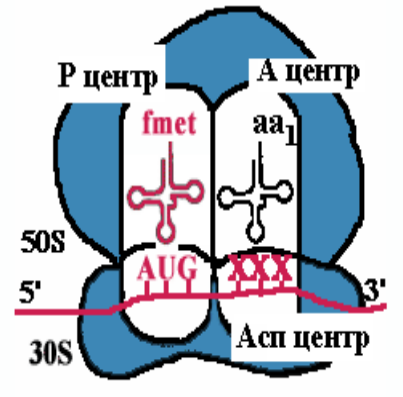 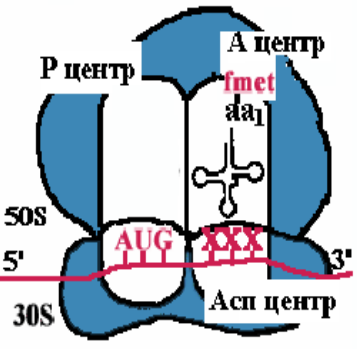 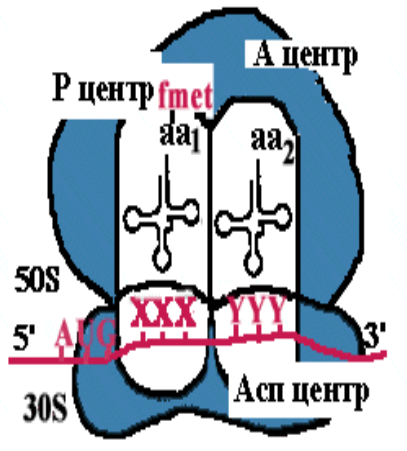 Рибосома претерпевает конформационные изменения и сдвигается на один кодон(транслокация). Формилметиониновая tРНКпокидает рибосому. Второйкодон оказывается напротив Р-центра. Сюда же переходит tРНК, несущая на хвосте дипептид. В Асп-центр попадает третий кодон, а в А-центр очередная аминоацил-tРНК. Элонгация продолжается до тех пор, пока в Асп-центр не приходит терминирующий кодон. Терминация Белковые факторы (RF1-RF3 ), присоединяясь к терминирующим кодонам (UAAи UAG, UGA) инициируют изменение специфической пептидилтрансферазной активности на гидролитическую, вызывая гидролиз и распад трансляционного комплекса RF1 узнает UAA и UAG, RF2 - UAA и UGA; RF3 не имеет кодоновой специфичности и взаимодействует с RF1 и RF2, делая процесс терминации более эффективным 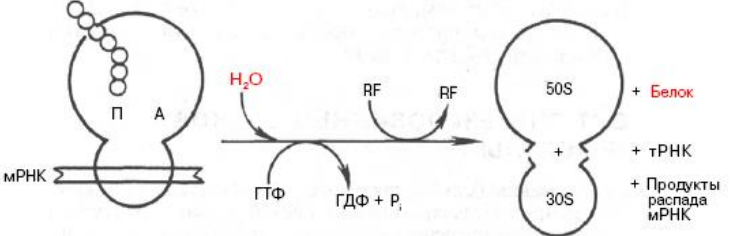 Пептидилтрансфераза катализирует перенос молекулы пептида не на очередную аминокислоту, а на молекулу воды, вызывая гидролиз и распад трансляционного комплекса 25. Регуляция биосинтеза белков на уровне трансляции. Изменение скорости трансляции. Хотя изменение скорости образования белков на уровне трансляции не относят к числу основных способов регуляции количества и разнообразия белков, некоторые случаи такой регуляции известны. Наиболее изученный пример — синтез белков в ретикулоцитах. Известно, что на этом уровне дифференцировки кроветворные клетки лишены ядра, а, следовательно, и ДНК. Регуляция синтеза белка-глобина осуществляется только на уровне трансляции и зависит от содержания гема в клетке. Если внутриклеточная концентрация гема высока, то глобин синтезируется; когда содержание гема снижается, то ингибируется и образование глобина. Остановка синтеза белка осуществляется за счёт фосфорилирования фактора инициации еIF2, который в фосфорилированной форме неактивен. Гем предотвращает фосфорилирование еIF2, связываясь со специфической протеинки- назой, которая получила название гемкиназы. Некоторые мРНК содержат элементы вторичной структуры на 5'- или 3'-концах нетранслируемого участка мРНК, к которым могут присоединяться белки и ингибировать трансляцию. Например, синтез ферритина — белка, обеспечивающего хранение ионов железа в клетке, усиливается при повышении внутриклеточной концентрации железа. Обнаружено, что мРНК ферритина на 5'-конце имеет петли, к которым при низкой концентрации железа присоединяется регуляторный белок. Когда этот белок связан с мРНК, то трансляция не идёт. Если концентрация ионов железа в клетке повышается, то Fе 3+ взаимодействует с белком, изменяет его конформацию и сродство к мРНК. мРНК освобождается от регуляторного белка, и на ней начинается синтез ферритина. 26. Процессинг первичных полипептидных цепей после трансляции: частичный протеолиз, образование ковалентных связей, присоединение простетических групп, ковалентная модификация аминокислотных остатков (гликозилирование, метилирование, фосфорилирование, ацетилирование). Полипептидные цепи могут подвергаться структурным модификациям, либо будучи ещё связанными с рибосомами, либо после завершения синтеза. Эти конформационные и структурные изменения полипептидных цепей получили название посттрансляционных изменений. Они включают удаление части полипептидной цепи, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации. Многие модификации осуществляются в ЭР. Здесь происходят фолдинг полипептидных цепей и формирование уникальной третичной или четвертичной структуры белков. Причём для поддержания нативной конформации молекул огромное значение имеет правильное формирование дисульфидных связей. Частичный протеолиз Многие белки, секретируемые из клеток, первоначально синтезируются в виде молекул-предшественников, функционально неактивных. Удаление части полипептидной цепи специфическими эндопротеазами приводит к образованию активных молекул. Некоторые белки-предшественники расщепляются в ЭР или аппарате Гольджи, другие — после секреции. Так, неактивные предшественники секретируемых ферментов — зимогены — образуют активный фермент после расщепления по определённым участкам молекулы: зимоген панкреатической железы трипсиноген превращается в активный трипсин после секреции в тонкий кишечник. Наглядным примером последовательного двухстадийного протеолиза служит образование активных форм пептидных гормонов (например, инсулина или глюкагона) из препрогормонов. Первоначально N-концевой сигнальный пептид молекулы-предшественника удаляется в ЭР в процессе синтеза белка и образуется неактивный прогормон. Затем прогормон в секреторных гранулах, формирующихся в аппарате Гольджи, подвергается действию эндо- и/или экзопротеаз и превращается в активный гормон. Ковалентные модификации Структурные белки и ферменты могут активироваться или инактивироваться в результате присоединения различных химических групп: фосфатных, ацильных, метильных, олигосахаридных и некоторых других. Фосфорилирование белков осуществляется по гидроксильным группам серина, треонина и, реже, тирозина ферментами из группы протеинкиназ, тогда как дефосфорилирование катализируют гидролитические ферменты фосфопротеинфосфатазы (протеинкиназа) Гликозилирование. Белки, входящие в состав плазматических мембран или, секретирую- щиеся из клеток, подвергаются гликозили- рованию. Углеводные цепи присоединяются по гидроксильным группам серина или треонина (О-гликозилирование) либо аспарагина (N-гликозилирование). Последовательное наращивание углеводного фрагмента происходит в ЭР и аппарате Гольджи (группы крови) Метилирование - образование метилированных белков-гистонов (присоединение к ним метильных групп) Ацетилирование - пример, аналогичный метилированию с образованием гистонов, но за счет присодинения ацетильной группы. 27. Фолдинг белков. Ферменты. Роль шаперонов в фолдинге белка. Фолдинг белковой молекулы с помощью шаперониновой системы. Болезни, связанные с нарушением фолдинга белка. Фолдинг – сворачивание пептидной цепи в правильную трехмернуюструктуру Возможная последовательность фолдинга белка 1. случайный клубок - нети ни вторичной, ни третичной структуры, пептидная цепь развернута 2. состояние-предшественник расплавленной глобулы - вторичная структура сформирована не доконца, третичная структура отсутствует, цепьчастично развернута 3. расплавленная глобула - вторичная структура сформирована, цепьполностью свернута в компактную глобулу, ножесткая третичная структураотсутствует 4. нативный белок - цепь свернута в компактную глобулу, котораяимеет определенную третичную структуру Факторы фолдинга 1. Протеинсульфоизомераза 2. Пептидилпролилизомераза 3. Молекулярные шапероны, участвующие в пространственной укладке белков - Большая группа неродственных белковых семейств Протеиндисульфидизомераза (PDI) (способствует сворачиванию секретируемых клетками белков, содержащих дисульфидные мостики (инсулин, рибонуклеаза, иммуноглобулины) Катализирует изомеризацию дисульфидных связей в формирующемся белке, дает ему возможность найти (путем случайного перебора) такую комбинацию этих связей, которая соответствует энергетически наиболее оптимальнойпространственной структуре. Пептидил-пролил-цис/транс-изомераза (PPI) Катализирует переход радикалов в области пептидной связи Pro изт ранс-конфигурации в цис-конфигурацию и обратно. Обеспечивает возможность пептидной связи делать в областинахождения аминокислоты пролина, такие изгибы, которые приводят к наиболее оптимальной пространственной структуре Пространственная сборка белков in vivoо существляется с помощью шаперонов Молекулярные шапероны – большая группа неродственных белковых семейств, которые – участвуют в стабилизации развернутых или частично свернутых белков; – способствуют корректному фолдингу белков и сборке белковых комплексов Шапероны, относящиеся к различным семействам образуют шаперониновые системы GroEL (L=Large). Состоит из двухсемичленных колец, лежащих одно поддругим, 14 идентичных субъединиц (57kD); GroES (S=Small). Состоит из одногосемичленного кольца, 7 идентичных субъединиц (10kD) Субъединица GroEL cостоит из трех доменов: • Экваториальный домен - образует контактs с аналогичным доменом на втором кольце; - связывает АТФ; • Промежуточный домен- является гибким шарниром, обеспечивает связывание АТФ и GroES • Апикальный домен – cвязывает полипептид; сайт связывания содержит в основном крупные гидрофобные ак, – cвязывает GroES. При связывании АТФ и GroES: • увеличивает объем внутренней полости примерно в 2 раза; • меняет расположение гидрофобных остатков апикального домена, и внутренняя поверхность полости становится гидрофильной Схема фолдинга белковой молекулы при помощи шаперониновой системы GroEL/ GroES 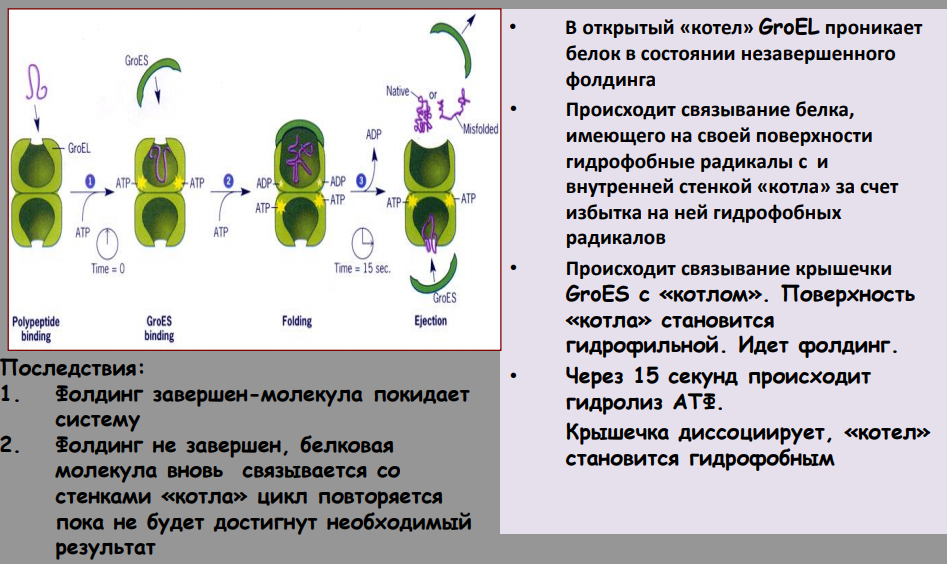 Прионные белки. Прионы как антишапероны Основной компонент прионов - аномальная изоформа прионного белка (одного из белков ЦНС ). Проникновение прионов в клетку приводит к нарушению конформации синтезируемого клеткой прионного белка, нарушению функции клетки идальнейшему накоплению прионов. Причины появления прионов: 1. Ошибки фолдинга (редко) 2. Мутации гена, кодирующего прионный белок 3. Употребление в пищу тканей животных, в которых содержаться прионы Прионы вызывают некоторые дегенеративные заболевания ЦНС - болезнь Крейтцфельдта-Якоба , куру(туземцы Новой гвинеи) Предполагают также участие прионов в передаче человеку губчатой энцефалопатии крупного рогатого скота(коровьего бешенства) 28. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина). особенности синтеза и процессинга секретируемых белков. Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с ЭР. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи. После окончания синтеза препроинсулина сигнальный пептид, включающий 24 аминокислотных остатка, отщепляется. Проинсулин поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина и С-пептида.в эквимолярных количествах они включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Разрушение инсулина происходит под действием фермента инсулиназы в печени и в почках. Глюкоза - главный регулятор секреции инсулина. регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, что сопровождается активацией транскрипции мРНК инсулина. Синтез полипептидных цепей коллагена. Полипептидные цепи коллагена синтезируются на полирибосомах, связанных с мембранами ЭР, в виде более длинных, чем зрелые цепи, предшественников - препро-б-цепей. У этих предшественников имеется гидрофобный "сигнальный" пептид на N-конце, содержащий около 100 аминокислот. Основная функция сигнального пептида - ориентация синтеза пептидных цепей в полость ЭР. После выполнения этой функции сигнальный пептид сразу же отщепляется. Синтезированная молекула проколлагена содержит дополнительные участки - N- и С-концевые пропептиды. В состав пропептидов входят остатки цистеина, которые образуют внутри- и межцепочечные S-S-связи. Концевые пропептиды не образуют тройную спираль, а формируют глобулярные домены. Отсутствие N- и С-концевых пептидов в структуре проколлагена нарушает правильное формирование тройной спирали. 29. Различия в продолжительности жизни белков. Убиквитинзависимая система протеолиза. Различия в продолжительности жизни молекул белка После того как белки синтезированы, время их жизни регулируется протеазами. Разные белки имеют разные t1/2: от нескольких часов до нескольких месяцев, а иногда и лет. В каждой клетке скорость расщепления белков варьирует в широких пределах. Некоторые белки расщепляются лизосомными ферментами. В процессе аутофагии содержимое клетки, включая органеллы, окружается мембраной, сливается с л изосомой другой клетки и подвергается действию лизосомных ферментов. Для других белков показано расщепление в цитоплазме протеазами. Так, подлежащие разрушению белки первоначально отмечаются клеткой путём присоединения белка под названием убиквитин. Этот небольшой белок, состоящий из 76 аминокислотных остатков, обнаружен у многих организмов. |
