Ответы по химии. 1. Основные понятия и законы химии. Химия
 Скачать 237.79 Kb. Скачать 237.79 Kb.
|
|
34.Реакции окисления восстановления. Окислительно-восстановительные реакции - реакции, в ходе которых меняется степень окисления атомов, входящих в молекулу. Для органических реакций этого типа применимы те же законы, что и для неорганических. Отличием является то, что в органической химии окислительно-восстановительные процессы рассматриваются прежде всего по отношению к органическому веществу и связываются с изменением степени окисления углерода, являющегося реакционным центром молекулы. Эти реакции могут проходить по типу реакций присоединения, отщепления, замещения и т.п. Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе. Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода. Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]: Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]: Степень окисления углерода в его соединениях изменяется в диапазоне от -4 (например, в метане CH4) до +4 (в CO2). В органических соединениях атомы углерода в одной и той же молекуле могут иметь разные степени окисления: -3CH3--1CH2-OH 35,36.Методы составления уравнений реакций окисл-восстанов. Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов. Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса. Напишем уравнение реакции между алюминием и кислородом: Al + O2 = Al2O3 Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача – разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции. Итак, в чем заключается метод электронного баланса? Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона: 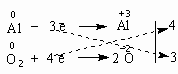 Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху. Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено: 4Al + 3O2 = 2Al2O3 Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем "марганцовка" – марганцевокислый калий KMnO4 – является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl– отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
Составим схему электронного баланса: 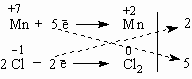 Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2 5 = 10 перед KСl), а перед KMnO4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел. 2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде. Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор. 37.Уравнение нернста. УравнениеНернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, истандартными электродными потенциалами окислительно-восстановительных пар. Вывод уравнения Нернста где Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим 38.Гальванические элементы. Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДСгальванического элемента зависит от материала электродов и состава электролита. Типы гальванических элементов. Гальванические элементы, применяемые на практике для получения электрической энергии, делятся на первичные и вторичные. Первичные элементы не могут быть возвращены в рабочее состояние после того, как их наполнитель (активное вещество) был уже однажды израсходован. В этом случае говорят, что элемент истощен. У таких элементов нельзя или по меньшей мере неэкономично обращать электродный процесс, пропуская ток в обратном направлении. Этот тип обычно называют просто элементом. Вторичные элементы или аккумуляторы можно регенерировать после истощения, если пропустить через них ток в обратном направлении (зарядить), потому что процессы генерации тока, происходящие на их электродах, с хорошим приближением электрохимически обращаемы. Принципиального же различия между первичными и вторичными элементами нет. Основными требованиями к гальваническим элементам являются следующие: большой срок службы, высокие плотность тока и напряжение на клеммах. Желательно также, чтобы они обладали высоким КПД, использовали дешевые активные вещества, имели малые размеры и вес, были просты по устройству и долговечны. 39.Электролиз расплавов и растворов. Электролиз - это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор. Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отливчаются друг от друга. Отличие - в наличии растворителя. При электрролизе растворов кроме ионов самого вещества в процессе учавствуют ионы растворителя. При электролизе расплавов - только ионы самого вещества. Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита. Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости. Электрод, заряженный положительно - анод. Электрод, заряженный отрицательно - катод. При электролизе происходт окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину. В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка. 40.Законы фарадея. Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах. Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорционально эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество. Законы Фарадея можно записать в виде следующей формулы: где: m — масса осаждённого на электроде вещества в граммах Q — полный электрический заряд, прошедший через вещество F = 96,487 C mol−1 — постоянная Фарадея M — молярная масса вещества z — валентное число ионов вещества (число электронов на один ион). Заметим, что M/z — это эквивалентная масса осаждённого вещества. 41.Химические источники тока. Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию. Классификация По возможности или невозможности повторного использования химические источники тока делятся на: гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить; электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить; топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно. Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка. По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные(например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор). 42.Коррозия металлов. Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево илиполимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 6Н2О + ЗО2 = 4Fe(OH)3. Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной. Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. [2] Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов. 43.Факторы влияющие на скорость коррозии. Факторы влияющие на скорость коррозии металлов. Влияние рН раствора. Пассивация металла чаще всего связана с образованием на го поверхности малорастворимых пленок оксидов и гидроксидов. Реакция среды, т.е. рН раствора, влияет на характер растворимости этих пленок. В том случае если оксиды обладают основными свойствами, защитное действие их в большей степени будет проявляться в щелочных средах, где растворимость этих пленок меньше. Если оксидные (гидроксидные) пленки металлов обладают кислотными свойствами, коррозийная устойчивость в кислых средах. Состав среды. Скорость коррозии в водных растворах зависит от природы растворенных в воде веществ, что связано со следующими факторами:1) растворенные соли гидролизируются, изменяя рН растворов. 2) растворенное в воде вещество может давать с металлом или продуктами его коррозии пленку малорастворимых соединений. 3) некоторые анионы, чаще галогены адсорбируясь на поверхности металла, разрушают оксидную пленку. Большие неприятности связаны с хлоридом натрия! 4) Наличие веществ  , , и др. и др.44. Методы защиты: 1)Обработка среды в которой протекает коррозия. К подобным методам относят процессы нейтрализации среды, обескислороживание, введение ингибиторов.2)Метод деаэрации. Удаление из раствора кислорода. 3)Легирование металла. Для сталей, работающих в агрессивных газовых и жидких средах. Так же существуют защитные покрытия неметаллические покрытия (лаки, краски, резины, эмали и др.) и химические (спец. создаваемые на поверхности металла химически стойкие соединения: оксиды, фосфаты, сульфаты и др.). 45. Металлические защитные покрытия делятся на 4 типа: 1)Покрытия оксидный слой которых делает металлы пассивным (Al, Zn, Sn, Cr, Pb, Ni). 2)Стойкие химические покрытия (Au, Ag, Cu). 3)Анодные покрытия. Если нанести покрытие другого более электроотрицательного металла, то в случае возникновения условий электрохимической коррозии разрушаться будет покрытие, а не металл. 4) Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. 46. Электрохимическая защита: 1) Протекторная (Защищаемое от коррозии изделие соединяют с металлическим пластиной из более электроотрицательного металла (протектора). Это равносильно созданию гальвнического элемента, в котором протектор является анодом и будет разрушаться.2) Катодная защита (отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (например, подпочвенная вода), присоединяется к катоду внешнего источника тока В ту же среду помещают металлолом, который соединяют с анодом внешнего источника тока. Металлолом, являясь анодом, подвергается разрушению, предохраняя от разрушения защищаемую конструкцию. На защищаемую конструкцию от выпрямителя подается отрицательный потенциал и, следовательно, на ней возможны процессы только восстановления.3) Анодная защита (используется только для тех металлов, которые при анодной нагрузке способны образовать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте. Защищаема конструкция присоединяется к положительному полюсу внешнего источника тока. В ту же среду помещают металлолом с отрицательным полюсом внешнего источника тока. |
