Ответы по химии. 1. Основные понятия и законы химии. Химия
 Скачать 237.79 Kb. Скачать 237.79 Kb.
|
Растворы электролитов и неэлектролитовЭлектролиты - вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы. Неэлектролиты - вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов). Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи. 25.Свойства растворов электролитов. Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах: 1. Электролиты в растворах распадаются на ионы – диссоциируют; 2. Диссоциация является обратимым равновесным процессом; 3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными). Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N: 26.Способы выражения концентрации. Концентрацию веществ в растворах можно выразить разными способами. На этой страничке вы с ними познакомитесь. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию. Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m : w(B)= m(B) / m Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г. Пример Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора? Решение m(Na2SO4) = w(Na2SO4) / 100 = (5 · 300) / 100 = 15 г где w(Na2SO4)) – массовая доля в %, m - масса раствора в г m(H2O) = 300 г - 15 г = 285 г. Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4)
27.Сильные и слабые электролиты.степень и константа диссоциации. Классификация Исходя из степени диссоциации все электролиты делятся на две группы Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3). Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов. Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого. Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации. 28.Электролитическая диссоциация воды. Вода представляет собой слабый амфотерный электролит: Н2О или, более точно: 2Н2О Константа диссоциации воды при 25оС равна: Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л (плотность воды 1000 г/л, масса 1 л 1000 г, количество вещества воды 1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л =55,55 моль/л). Тогда Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW: Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13. В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой: [H+] = [OH-] = 10-7 моль/л Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными. Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10-7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10-14. Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H+] = 10-3 моль/л, то [OH-] = KW/[H+] = 10-14/10-3 = 10-11 моль/л, или, если [OH-] = 10-2 моль/л, то [H+] = KW/[OH-] = 10-14/10-2 = 10-12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды. На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями. Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода: рН = - lg[H+] Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила: рОН = - lg[OH-] Легко показать, прологарифмировав ионное произведение воды, что рН + рОН = 14 Если рН среды равен 7 - среда нейтральная, если меньше 7 - кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила. 29.Электролитическая диссациация кислот и оснований. Все вещества по их поведению в растворах принято условно делить на две группы: а) электролиты и б) неэлектролиты. Электролитами называют сложные вещества, растворы и расплавы которых способны проводить электрический ток. Неэлектролиты, наоборот, электрический ток не проводят. К электролитам относят большинство неорганических кислот, щелочей и солей. Электролиты — хлороводородная (соляная) кислота НС1, хлорид натрия NaCl, гидроксид калия КОН. К неэлектролитам относят многие органические соединения, например спирты, углеводы (сахара), а также газообразные вещества и оксиды. В химии диссоциацией принято называть распад кристаллов и молекул на ионы, который приводит к электрической проводимости растворов. Следовательно, причиной электрической проводимости растворов и расплавов некоторых веществ является образование носителей электричества — свободных заряженных частиц, называемых ионами. Диссоциация происходит под действием молекул растворителя (чаще воды) или температуры. При этом химические связи между частицами в кристаллической решетке разрушаются. Типичными видами связи для электролитов являются ионная или ковалентная полярная. Таким образом, под электролитической диссоциацией понимают процесс распада электролитов на ионы под действием молекул воды или при расплавлении. Рассмотрим электролитическую диссоциацию хлорида натрия (NaCl). При расплавлении энергия, подводимая к кристаллам, усиливает колебания ионов в узлах кристаллической решетки, в результате чего связи между ионами разрушаются и появляются свободные ионы. Аналогичный эффект достигается при растворении хлорида натрия в воде. Только роль разрушающего фактора выполняют молекулы воды, которые как бы растягивают кристалл на отдельные частицы. Но при этом ионы оказываются окруженными («гидратированными») молекулами воды. Уравнение диссоциации: Диссоциация веществ с ковалентной полярной связью происходит несколько сложнее, например диссоциация хлороводорода в воде. Сначала происходит взаимодействие молекул воды с молекулами НС1, находящимися в узлах кристаллической решетки, и их отщепление от нее, а затем происходит «растягивание» полярной молекулы НС1 на гидра- тированные ионы а) Кислоты диссоциируют на катионы водорода (упрощенно) и анионы кислотных остатков: 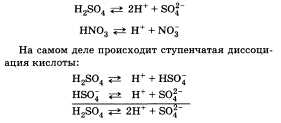  30.Условия растворения и осождения веществ. Это соотношение позволяет использовать значение ПР для подбора условий растворения и осаждения веществ. Важно учитывать, что условие ПР = [Аz+]k[Вz-]l = const может выполняться при разл. значениях каждой из концентраций [Аz+] и [Вz-]. Для осаждения соли АkВl из ненасыщ. раствора обычно добавляют в раствор соль, имеющую с АkВl общий катион или анион, например AD или СВ. При этом концентрация ионов Аz+ (или Вz-) в растворе возрастает, произведение концентраций [Az+]k[Bz-]l превышает ПР и начинается выпадение в осадок АkВl. Наоборот, полный переход АkВl в раствор достигается связыванием одного из ионов (Аz+ или Bz-) в недиссоциируемый комплекс в растворе, что приводит к снижению концентрации этого иона и выполнению условия [Az+]k[Bz-]l< ПР. Третий способ регулирования растворимости - изменение ионной силы раствора (т. наз. солевой эффект), когда к раствору добавляется электролит CD, не имеющий общих ионов с АkВl Это приводит к росту ионной силы, уменьшению g и, следовательно, увеличению растворимости. 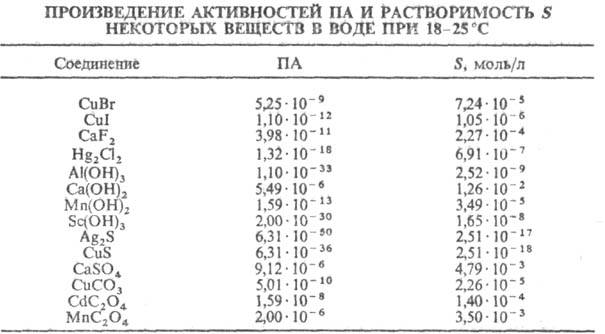 31.Обменные реакции. Необходимым условием протекания обменных реакций в растворах электролитов является удаление из раствора тех или иных ионов вследствие образования малодиссоциирующих (слабые электролиты и комплексные ионы) или малорастворимых веществ (осадки и газы).Реакции обмена в растворах электролитов записывают в виде трех уравнений: молекулярного, полного ионно-молекулярного и сокращенного ионно-молекулярного. Для составления этих уравнений необходимо знать характер электролитической диссоциации участников реакции. Малодиссоциирующие и малорастворимые вещества в ионно-молекулярных уравнениях записываются в молекулярном виде. Реакции, в которых слабые электролиты или малорастворимые вещества входят в состав только продуктов реакции, протекают, как правило, необратимо, т.е. до конца. Реакции, в которых слабые электролиты или малорастворимые вещества входят в состав как продуктов, так и исходных веществ, протекают, как правило, не до конца, т.е. являются обратимыми. Равновесие обратимого процесса в этих случаях смещено в сторону образования наименее диссоциированных или наименее растворимых частиц. 32.Гидролиз.
33.Комплексные соединения. В молекуле комплексного соединения один из атомов обычно положительно заряжен, занимает центральное место и называется комплексообразователем. По близости к нему расположены противоположно заряженные ионы или нейтральные атомы. Их называют лиманды. Комплексообразователь и лиманды составляют внутреннюю сферу комплексного соединения. За пределами внутренней сферы находится внешняя сфера, содержащая отрицательно или положительно заряженные ионы, в зависимости от заряда внутренней сферы. Если внутренняя сфера не заряжена – внешняя сфера отсутствует. Ионы находящиеся во внешней сфере связанными с комплексным ионом связями электростатического взаимодействия и в растворах легко диссоциируются на ионы подобны сильным электролитам. Лиманды связаны с комплексообразователем ковалентными связями. И диссоциация комплексного иона в растворе в не законченной стадии. |
