1. Периодический закон Д. И. Менделеева, его современная формулировка. Структура периодической системы с точки зрения строения атома.
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
Второй закон Рауля можно в наиболее общем виде сформулировать следующим образом: понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества. Криометрия-совокупность методов определения молекулярной массы неэлектролитов, степени диссоциации слабых электролитов и осмотического давления, основанных на измерении разности температур замерзания чистого растворителя и растворов исследуемых веществ; используется, напр., для анализа биологических жидкостей. Эбулиометрия-метод измерения повышения температуры кипения р-ов. Метод криометрии имеет широкое применение при исследовании растворов, представляющих собой по меньшей мере двухкомпо-нентную систему и образующих три фазы: пар, жидкость, твердое вещество. Метод криометрии используют для определения эффективной концентрации биологических, агрономических и лекарственных сред ( кровь, молоко, клеточный сок, растворы для инъекций, почвенные растворы). Экспериментальная задача криометрии заключается в том, чтобы сначала определить температуру замерзания чистого растворителя - воды, затем ту же величину для двух растворов мочевины различной концентрации. Из полученных данных необходимо вычислить молекулярный вес мочевины. 8.Осмос, осмотическое давление. Закон Вант-Гоффа для разбавленных растворов электролитов и неэлектролитов. Изотонический коэффициент. Поведение живой клетки в гипо-, гипер-, изотонических растворах. Роль осмоса и осмотического давления в биологических системах. Осмотическое давление крови, онкотическое давление крови. Осмос-это система стремления к равенству концентраций растворённого в-ва. Осмотическое давление разбавленного р-ра равно такому газовому давлению, которая имела бы растворённое вещ-во, если бы при той же температуре находилась в газообразном состоянии и занимала бы объём равный объёму р-ля. Осмотическое давление-это внешнее давление на раствор, при котором устанавливается осмотическое равновесие(через полупроницаемую мембрану) между р-ом и чистым растворителям. Закон Вант-Гоффа для разбавленных растворов электролитов и неэлектролитов. Изотонический коэффициент. Закон Ван-Гоффа: осмотическое давление, разбавленных р-ов неэлектролитов прямо пропорционально молярной концентрации и абсолютной температуре р-ра и не зависит о его природы. п(пи)=с*К*Т, К-универсальная газовая постоянная 8, 31. Изотонический коэффициент-этоотношение между экспериментальным и теоритическим значением. і=(дельта)t^э/(дельта)t^т Поведение живой клетки в гипо-, гипер-, изотонических растворах. Плазмолиз, гемолиз. Гипертонические-р-ры с более высоким осмотическим давлением. Гипотанические-р-ры с меньшим осмотическим давлением. Гемолиз - это нарушение эритроцитов ( красных кровяных телец ). В норме эритроциты живут 120 суток, при гемолизе их жизнь снижается до 100...Обычно такая картина наблюдается у пожилых людей. Свертывание крови- ферментативный процесс, в его участии принимает комплекс белков, находящихся в плазме. Плазмолиз — сжатие протоплазмы растительной клетки и отделение ее пристеночного слоя от целлюлозной клеточной оболочки. Плазмолиз происходит при погружении растительной клетки в гипертоническую среду, осмотическое давление которой выше, чем у вакуолярного сока клетки. В этом случае клетка теряет воду и её цитоплазма отделяется от стенок. Некоторые авторы полагают, что аналогичные явления имеют место и в клетках животных, где роль полупроницаемой оболочки выполняет клеточная мембрана. Роль осмоса и осмотического давления в биологических системах.Осмотическое давление крови, онкотическое давление. Роль осмотических явлений в различных физиологических про-цессах чрезвычайно велика. Постоянство осмотического давления (изоосмия) тех или иных физиологических сред (плазма, внутри-клеточная жидкость, моча и др.) представляет собой фундамен-тальное физико-химическое требование гомеостаза. Осмотическое давление плазмы крови человека составляет около 8 атмосфер. Столь высокие значения осмотического давления достигаются за счет суммарного эффекта раство-ренных в биосредах низкомолекулярных веществ и ионов. В плаз-ме, в частности, наиболее значимым компонентом является хлорис-тый натрий. На долю высокомолекулярных компонентов - белков - прихо-дится незначительная часть от общего давления, называемая онкотическим давлением..Величина онкотического давления кро-ви, вызываемого альбуминами и глобулинами, составляет только 0.03-0.04 атм. Стенка капилляров проницаема для воды и низкомолекулярных веществ, но не для белков. На артериальном конце капилляра соле-вой раствор вместе с питательными веществами переходит в меж-клеточное пространство. На венозном конце капилляра процесс идет в обратном направлении, так как венозное давление ниже онкотического давления. В результате в кровь переходят вещества, отдаваемые клетками. На клеточное осмотическое давление влияет обмен веществ. При распаде больших молекул осмолярность повышается; при син-тезе - снижается. Осмотические взаимоотношения ответственны за распределение воды в жидкостных пространствах организма. 9.Растворы электролитов. Электролиты в организме человека. Растворы слабых электролитов, теория Аррениуса. Понятия о константе диссоциации и степени диссоциации. Закон разбавления Оствальда. Теории кислот и оснований Аррениуса, Бренстеда –Лоури, Льюиса. Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов. К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. Электролиты в нашем организме это соли и минералы, которые фактически присутствуют во всех жидкостях – крови, поту, моче, и слезах. В нашем теле они могут носить как отрицательный, так и положительный заряды. Все они жизненно важны для нормального функционирования нервной системы, кровеносной системы, мышечной системы, кровяного давления, для восстановления и пищеварения. Также они помогают контролировать количество воды в организме. Если Ваша диета состоит в основном из хлебов и мяса, то у Вас будет наблюдаться недостаток электролитов. Нужно много пить воды. Важными электролитами являются:Натрий,Калий,Хлорид,Кальций,Магнезий,Сульфаты,Бикарбонаты. Растворы слабых электролитов, теория Аррениуса. Понятия о константе диссоциации и степени диссоциации. Закон разбавления Оствальда. Теория Аррениуса: процесс растворения или плавления электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток. Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Электролитическая диссоциация-это распад вещ-ва на ионы под действием молекул растворителя. L=n/N*100%. Степень и константа диссоциации слабых электронов L: L=h(дис.)/h(общ.)*100%. В-ва с ионной связью-сильные электролиты, а с ковалентной связью-слабые электролиты. Закон разбавления Оствальда: при разбовление слабых электролитов их диссоциация увеличивается. Активность. Ионная сила растворов сильных электролитов. Активность-эфективная концентрация. Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Теории кислот и оснований Аррениуса, Бренстеда –Лоури, Льюиса.  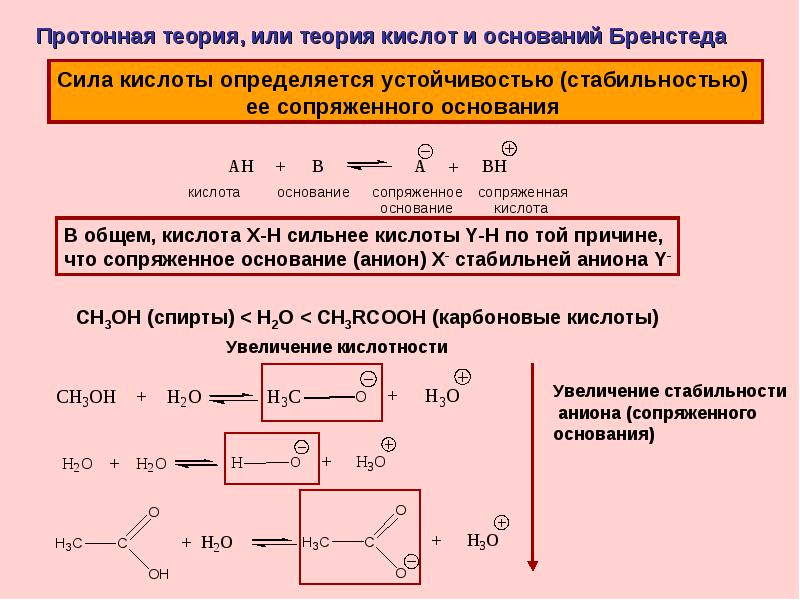  10.Диссоциация воды, ионное произведение воды. рН растворов. Водно-электролитный баланс в организме человека. рН биологических жидкостей. Вода как слабый электролит. Чистая вода очень плохо проводит электрический ток, но все-таки имеет измеримую электропроводимость, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксила: Н2О = Н+ + ОН- Действительно, при 22оС ее степень электролитической диссоциации равняется ( 1,8 *10-9, то есть диссоциирует лишь одна из 555 000 000 молекул воды. Одной из причин такой незначительной диссоциации воды является то, что диссоциация подавляется действием водородных связей, которые являются типичными для воды. Диссоциацию воды можно записать в две стадии: Н2О = Н+ +ОН- (эндотермический процесс) Н+ +Н2О = Н3О+ (экзотермический процесс) Или 2Н2О = Ы Н3О+ + ОН-) Последняя запись реакции - это запись реакции автопротолиза. Одна молекула воды играет роль кислоты (отщепляет протон), а вторая - основания (присоединяет протон). Гидратированный протон Н3О+, как мы уже знаем называется ионом гидроксония образования при диссоциации воды катионов Н3О+ и анионов ОН- свидетельствует про амфотерную ее природу и называют такие электролиты - амфолитом. По величине электропроводимости чистой воды можно вычислить концентрацию ионов водорода и ионов гидроксила в воде. При 25оС их концентрация равняется 10-7 моль/л. Применив закон действующих масс к реакции диссоциации воды будем иметь: Для воды и разбавленных водных растворов при постоянной температуре произведение концентраций ионов водорода и гидроксила есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Численное значение ее можно выразитьтак: К(н2о)= 10-7 *10-7 = 10-14 Величина КН2О является постоянной величиной при определенной температуре. Поскольку диссоциация воды - эндотермический процесс, то нагревание воды смещает равновесие в сторону образования ионов воды (гидроксония и гидроксила), которая вызывает увеличение величины ионного произведения воды или константы воды и наоборот. Водно-электролитный баланс в организме человека. рН биологических жидкостей. Водно-солевой обмен — совокупность процессов поступления воды и солей (электролитов) в организм, их всасывания, распределения во внутренних средах и выделения. Суточное потребление человеком воды составляет около 2,5 л, из них около 1 л он получает с пищей. В организме человека 2/3 общего количества воды приходится на внутриклеточную жидкость и 1/3 — на внеклеточную. Часть внеклеточной воды находится в сосудистом русле (около 5% от массы тела), большая же часть внеклеточной воды находится вне сосудистого русла, это межуточная (интерстициальная), или тканевая, жидкость (около 15% от массы тела). Кроме того, различают свободную воду, воду, удерживаемую коллоидами в виде так называемой воды набухания, т.е. связанную воду, и конституционную (внутримолекулярную) воду, входящую в состав молекул белков, жиров и углеводов и освобождающуюся при их окислении. Разные ткани характеризуются различным соотношением свободной, связанной и конституционной воды. За сутки почками выводится 1—1,4 л воды, кишечником — около 0,2 л; с потом и испарением через кожу человек теряет около 0,5 л, с выдыхаемым воздухом — около 0,4 л. 11.Буферные растворы, классификация буферных растворов. Механизм буферного действия. рН буферных растворов. Уравнение Хендериксона-Хоссельбаха для буферных растворов кислотного и основного типов. Буферными называют ра-ры, обладающие св-ом сохранять постоянство рН(кислотного показателя полезности воды) приразбавлении и противодействовать изменению РН при добавлении умеренных кол-в сильной к-ты или щёлочи. По химическому составу буферные р-ры делят на такие группы: а)Кислотные буферные р-ры(состоят из слабых электролитов и соли этой слабой кислоты и сильного основания), например, ацетатный буферный р-р(CH3COOH+CH3COONa). б)Основные буферные р-ры(состоят из слабого осн-я и соли этого слабого осн-я и сильной к-ты), например, аммиачный буферный р-р (NH3*H2O+NH4Cl). в)Белковые амфолитные буферные р-ры. Механизм буферного действия. Способность некоторых растворов сохранять неизменной концентрацию ионов водорода получила название буферного действия, которое является основным механизмом протолитического гомеостаза. Буферные растворы - это смеси слабого основания или слабой кислоты и их соли. В буферных растворах главными «действующими» компонентами являются донор и акцептор протонов, согласно теории Брёнстеда, или донор и акцептор электронной пары, согласно теории Льюиса, представляющие собой кислотно-основную пару. рН буферных растворов. Уравнение Хендериксона-Хоссельбаха для буферных растворов кислотного и основного типов. Водородный показатель, pH — это мера активности(в случае разбавленных растворов совпадает с концентрацией) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр: Зависимость громадного коли-чества химических, биохимических, природ-ных, технологических и многих других про-цессов от величины рН стимулирует разви-тие теории и техники измерения этого по-казателя. Уравнение Хендериксона-Хоссельбаха: pH=pK+lg(Cсоли/Cкислоты); pH=pK-lg(Cсоли/Cкислоты). 12.Буферные растворы. Буферная емкость. Буферные системы в организме человека, их роль в поддержании гомеостаза рН. Буферные системы крови. Буферная ёмкость. Буферной ёмкостью (В) называют кол-во молей эквивалента сильной к-ты или сильного осн-я, которое необходимо добавить к 1-му литру буферного р-ра, чтобы изменить значение его рН на единицу. Вк-буферная ёмкост в ммоль/л. Вк=С(1/Z к-ты)*V(к-ты)/V(буферного р-ра) дельта рН. Буферные системы в организме человека, их роль в поддержании гомеостаза рН. Буферные системы крови. Для обеспечения стационарного состояния у всех организмов – от морфологически самых простых до наиболее сложных – выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных называется гомеостазом. Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. При метаболизме в клетках образуются различные кислоты. Большинство из них затем выделяется клетками в виде углекислого газа, который при помощи фермента карбоангидразы связывается в эритроцитах с гемоглобином и переносится в лёгкие. В лёгких углекислый газ замещается кислородом и удаляется при дыхании в окружающую среду. В обычных условиях в организме существует постоянный баланс между образующимся и выдыхаемым углекислым газом, и поэтому накопления кислот в тканях не происходит. В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток.Бикарбонат является ключевым компонентом главной буферной системы организма. Она состоит из двух кислотно-основных частей, находящихся в динамическом равновесии: угольная кислота / бикарбонатный ион и бикарбонатный ион / карбонатный ион. Концентрация водородных ионов в крови, которая определяется как рН крови, является одним из параметров гомеостаза, колебания в норме возможны в очень узких пределах от 7,35 до 7,45. Стоит отметить, что смещение рН за указанные пределы приводит к развитию ацидоза (смещение в кислую сторону) или алколоза (в щелочную сторону). Организм способен сохранять жизнедеятельность, если рН крови не выходит за пределы 7,0-7,8. В отличие от крови, параметры кислотно-основного состояния для различных органов и тканей колеблются в более широких пределах. Например, рН желудочного сока составляет в норме 2,0, простаты – 4,5, а в остеобластах среда щелочная, и значение рН достигает отметки в 8,5. Регуляция кислотно-основного состояния в крови осуществляется за счет специальных буферных систем, которые реагируют на изменение рН достаточно быстро, посредством дыхательной системы и почек, а также пищеварительного канала и кожи, через которые выводятся кислые и щелочные продукты. Для изменения рН крови легким потребуется около 1-3 минут (за счет уменьшения или увеличения частоты дыхания и выведения углекислого газа), а почкам – около 10-20 часов. Таким образом, буферные системы крови являются наиболее быстро реагирующим механизмом регуляции рН крови. К буферным системам относят белки плазмы крови, гемоглобиновый, бикарбонатный и фосфатный буферы. 13.Основные понятия термодинамики: термодинамическая система, термодинамические параметры, функции состояния. Классификация термодинамических систем.Понятия о внутренней энергии и энтальпии. Первый закон термодинамики. Классификация термодинамических процессов. Термодинамическая система — это процесс или среда, которая используется при анализе передачи энергии. Системы, которые обмениваются с окружающей средой, вещ-ом и энергией называются открытыми. Если обмен только энергией-закрытая система. Изолированная система-не обменивается не с окружающей средой, не с обменом и энергией. Температура и давленияе и объём являются параметрами системы. Они являются функцией состояние системы. Любая ТДС характеризуется параметрами: температура, давление, плотность, концентрация, мольный объем. В любой ТДС обязательно протекают процессы, и они могут быть равновесными, неравновесными, обратимыми и необратимыми. Если в ТДС определенное свойство системы не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы – равновесные. В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды. Обратимые процессы – процессы, в которых система возвращается в первоначальное состояние. Необратимые – когда система не возвращается в первоначальное состояние. Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, – функции состояния; внутренняя энергия, энтальпия, энтропия и другие – полные дифференциалы. Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q, A. Понятия о внутренней энергии и энтальпии. Первый закон термодинамики. Классификация термодинамических процессов. Внутренняя энергия (система тел) U– это энергия движения и взаимодействия частиц, из которых состоит тело. Энтальпия(нагреваю) — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту. дельта H. Изменение энтальпии характеризует изабарный процесс-постоянное давление. Классификация термодинамических процессов. Эндо- и экзотермические процессы. Эндотермические процессы сопровождаются поглощением энергии системой из окружающей среды. Экзотермические процессы сопровождаются выделением энергии из системы в окружающую среду. |
