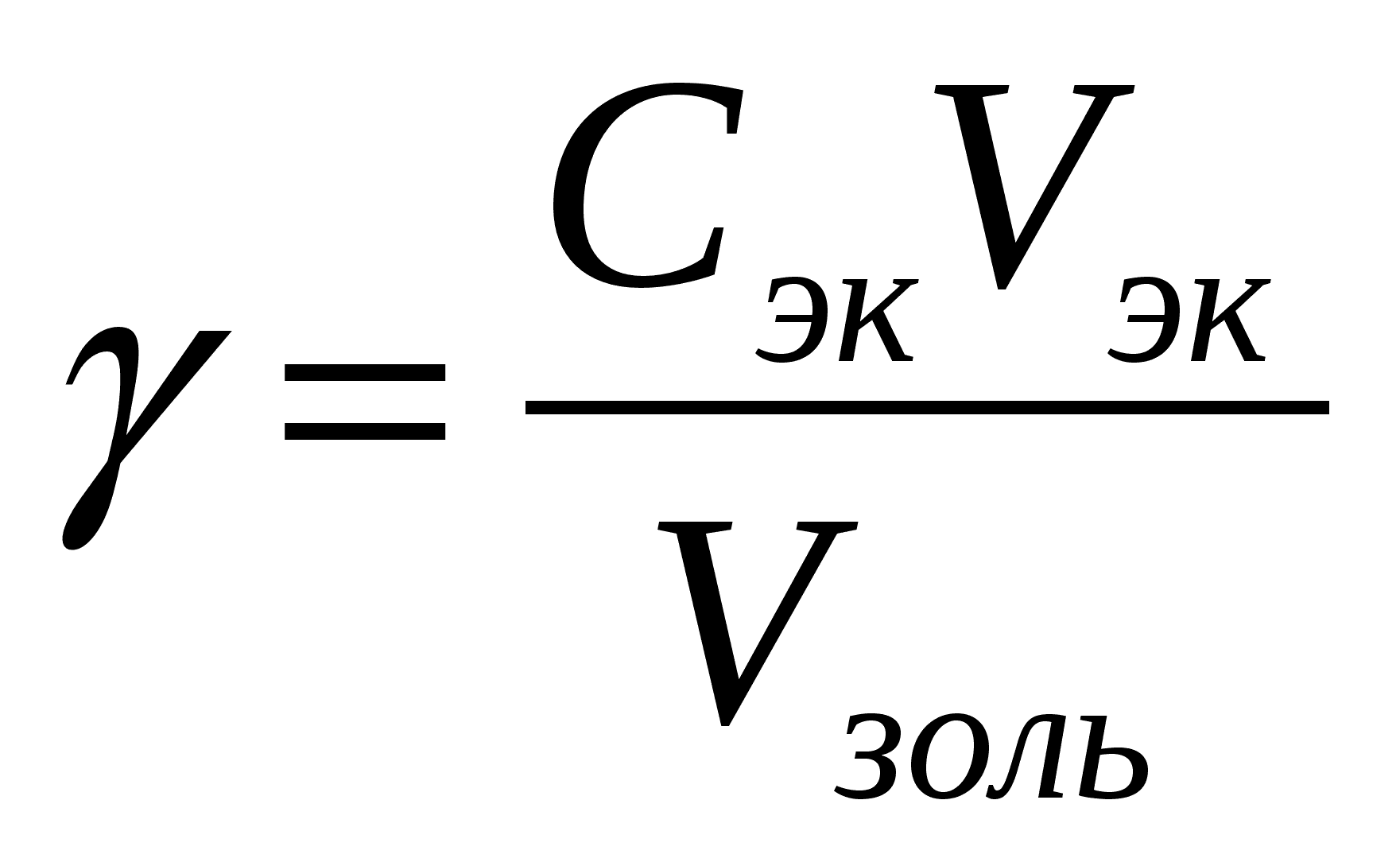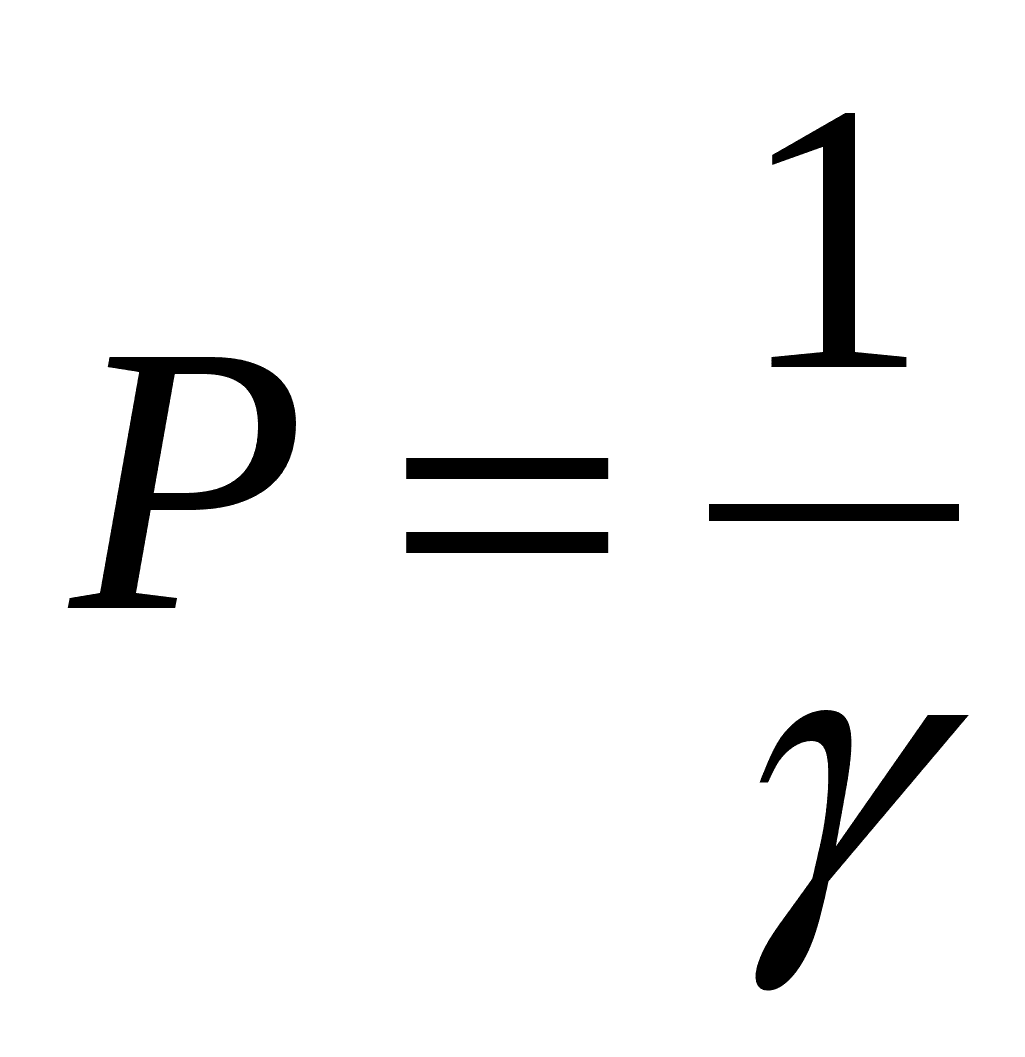|
|
1. Периодический закон Д. И. Менделеева, его современная формулировка. Структура периодической системы с точки зрения строения атома.
25.Свойства дисперсных систем: молекулярно кинетические (броуновское движение, диффузия, колигативные свойства), оптические свойства (эффект Тиндаля) Электро-кинетические свойства коллоидных систем. Электроосмос и электрофорез. Их применение в медико-биологических исследованиях.
БРОУНОВСКОЕ ДВИЖЕНИЕ (брауновское движение) - беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием ударов молекул окружающей среды. Исследовано в 1827 P. Броуном (Браун; R. Brown), к-рый наблюдал в микроскоп движение цветочной пыльцы, взвешенной в воде. Наблюдаемые частицы (броуновские) размером
1 мкм и менее совершают неупорядоченные независимые движения, описывая сложные зигзагообразные траектории. Интенсивность Б. д. не зависит от времени, но возрастает с ростом темп-ры среды, уменьшением её вязкости и размеров частиц (независимо от их хим. природы).
ДИФФУЗИЯ (от лат. diflusio - распространение, растекание, рассеивание), перенос частиц разной природы, обусловленный хаотич. тепловым движением молекул (атомов) в одно-или многокомпонентных газовых либо конденсир. средах.
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:1) понижение давления насыщенного пара растворителя над раствором,2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.3) осмотическое давление.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя.
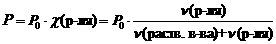 ,где Р – давления насыщенного пара растворителя над раствором, Па; ,где Р – давления насыщенного пара растворителя над раствором, Па;
Р0 – давления насыщенного пара над растворителем, Па;
c(р-ля) – мольная доля растворителя;
n(раств. в-ва) – количество растворенного вещества, моль;
n(р-ля) – количество вещества растворителя, моль.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:
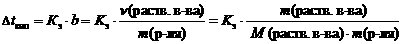
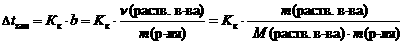
где Dtкип – повышение температуры кипения раствора, °С;
Dtзам – понижение температуры замерзания раствора, °С;
Кэ – эбуллиоскопическая константы растворителя, (кгЧ°С)/моль;
Кк – криоскопическая константы растворителя, (кгЧ°С)/моль;
b – моляльная концентрация, моль/кг;
n(раств. в-ва) – количество растворенного вещества, моль;
m(р-ля) – масса растворителя, кг;
m(раств. в-ва) – масса растворенного вещества, г;
М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
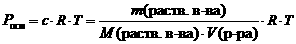 где Росм – осмотическое давление, кПа; где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;
R – универсальная газовая постоянная, 8,314 Дж/(мольЧК);
Т – абсолютная температура, К;
V(р-ра) – объем раствора, л.
ТИНДАЛЯ ЭФФЕКТ -свечение оптически неоднородной среды вследствие рассеяния проходящего через неё света. арактерен для коллоидных систем (напр., гидрозолей, табачного дыма) с низкой концентрацией частиц дисперсной фазы, имеющих показатель преломления, отличный от показателя преломления дисперсионной среды.
Электро-кинетические свойства коллоидных систем относится электроосмос и электрофорез.
Электроосмос – перемещение дисперсионной среды относительно неподвижной дисперсной фазы (капиллярно-пористых материалов, диафрагм) по действием внешнего электрического поля в сторону одного из электродов. Электроосмос-это движение частиц дисперсной срды во внешнем электрическом поле.
Электроосмос используется, например, для обезвоживания древесины, грунта, продуктов питания.Все электрокинетические явления связаны с относительным перемещением дисперсной фазы или дисперсионной среды, осуществляемой по границе скольжения. Их интенсивность определяют значением дзета-потенциала. Поэтому данную величину используют для оценки электрокинетических явлений.
Электрофорез — это процесс направленного движения частиц, диспергированных в жидкости в постоянном электрическом поле. Электрофорез-движение частиц дисперсной фазы во внешнем электрическом поле.
Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей. В медицине электрофорез используют для введения лекарств. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху электроды, к которым приложен безопасный для организма ток.
26.Понятие о лиофобных золях. Мицелярная теория строения лиофобных золей.
Лиофобными называют системы, частицы дисперсной фазы которых не взаимодействуют с дисперсионной средой, не сольватируются и не растворяются в ней.
К лиофобным системам относятся золи драгоценных металлов, золи металлоидов (серы, селена, теллура), дисперсии полимеров в воде (например, полистирола, фторолона), золи сульфидов мышьяка, сурьмы, кадмия, ртути, золи гидроксидов железа, алюминия и т.д. Эти системы характеризуются, так называемой, кинетической устойчивостью и агрегативной неустойчивостью и требуют стабилизации. К лиофильным коллоидным системам Фрейндлих отнес растворы, образующиеся при растворении природных или синтетических ВМС. Таковы растворы белков, крахмала, пектинов, камедей, эфиров целлюлозы и разнообразных смол, как природных так и синтетических.
Всякий лиофобный (гидрофобный) коллоидный раствор состоит из двух частей: мицелл и интермицеллярной жидко-сти. Мицеллы — это отдельные коллоидные частицы, которые в совокупности составляют дисперсную фазу золя, а интермицеллярная жидкость — это дисперсионная среда того же золя, включающая помимо растворителя все другие растворенные в нем вещества (электролиты и неэлектролиты), которые не входят в состав мицелл.
Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю — нейтральную, обычно называемую ядром, и внешнюю — ионогенную, в свою очередь состоящую из двух слоев (двух ионных сфер).
Ядро составляет основную массу коллоидной мицеллы и представляет собой комплекс, состоящий из атомов (в случае гидрозолей металлов или неметаллов) или нейтральных молекул [в золях гидроксида железа (III) или иодида серебра]. Общее число входящих в состав ядра атомов или молекул огромно (от нескольких сот до миллионов) и зависит от степени дисперсности золя и от размеров самих атомов или молекул.
В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого адсорбционного слоя из ионов стабилизатора. Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев (или двух сфер)— адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром эта ионная атмосфера образует как бы отдельный гигантских размеров многозарядный ион — катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоионов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в адсорбционном слое.
Гранула вместе с диффузным слоем противоионов составляет коллоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ноны тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси. Для примера рассмотрим получение гидрозоля иодида серебра методом конденсации. Оно основано на химической реакции
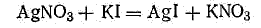
Согласно теории строения коллоидной мицеллы ядро в данном случае будет состоять из нейтральных молекул AgI. В зависимости от относительной концентрации реагирующих веществ может быть три случая.
1. Концентрация нитрата серебра больше концентрации иодида калия. При этом в системе, помимо нерастворимого комплекса Agl, имеются ионы Ag+, K+ и NO3-. В процессе роста ядра коллоидной мицеллы достраивание решетки AgI идет только за счет ионов Ag+, которые прочно входят в его структуру, сообщают ему электрический заряд и потому называются потенциалопределяющими. Полученный в результате адсорбции ионов Ag+ электрический заряд определяет термодинамический потенциал.
Положительно заряженное ядро притягивает оставшиеся в растворе противоионы NО3-. Часть противоионов при этом входит в состав адсорбционного слоя, оставшаяся часть — в
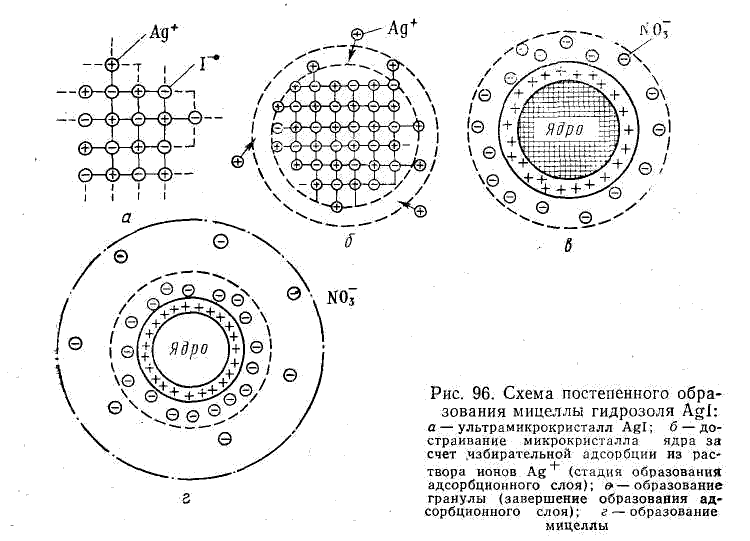
На строение мицеллы влияют электролиты.
27.Устойчивость коллоидных систем. Агрегационная и седиментационная устойчивость. Коагуляция. Коагуляция под действием сильных электролитов. Порог коагуляции. Правила Шульца-Гарди. Коллоидная защита.
Устойчивость коллоидных систем-это способности системы сохранять неизменные размеры частиц дисперсной фазы и их равномерное распределение в дисперсионной среде.
Коллоидные системы могут существовать длительное время, устойчивы с дисперсных систем делятся на 2 вида: кинетическую(седиментационная-осаждение) и агрегатную.
Кинетическая определяется способностью системы противодействовать оседанию.
Агрегативность-это способность сохранять неизменную первоначальный размер частиц.
КОАГУЛЯЦИЯ (от лат. coagulatio—створаживание), характерный для коллоидных растворов (золей) процесс, заключающийся либо в выпадении дисперсной фазы в осадок либо в застывании всего коллоидного раствора в студень— гель. В обоих случаях имеет место слияние отдельных мельчайших частиц дисперсной фазы, их укрупнение, или агрегация.
Коагуляция под действием сильных электролитов.
Коллоидные растворы очень чувствительны к присутствию посторонних электролитов и коагуляция может быть вызвана даже присутствием малых их количеств. Например, коагуляция наступает очень быстро, практически сразу же после образования золя, если он был получен в плохо вымытой посуде, сохранившей следы солей, содержащихся в водопроводной воде. Однако в присутствии каких-то определённых очень малых количеств электролита-ко-а-гулятора коллоидные растворы способны сохранять агрегативную устойчивость. Наименьшая концентрация электролита, вызывающая явную коагуляцию коллоидного раствора, называется порогом коагуляции . Экспериментально порог коагуляции может быть определён постепенным (например, из бюретки) добавлением к исследуемому золю раствора электролита-коагу-ля-то-ра. Другой способ определения - приготовление серии растворов электролита с равномерно увеличивающейся концентрацией с последующим добавлением к ним одинаковых объёмов золя. Наступление коагуляции может отмечаться визуально или с помощью приборов. Чаще всего для этих целей используются оптические методы. В любом случае порог коагуляции может быть вычислен по формуле
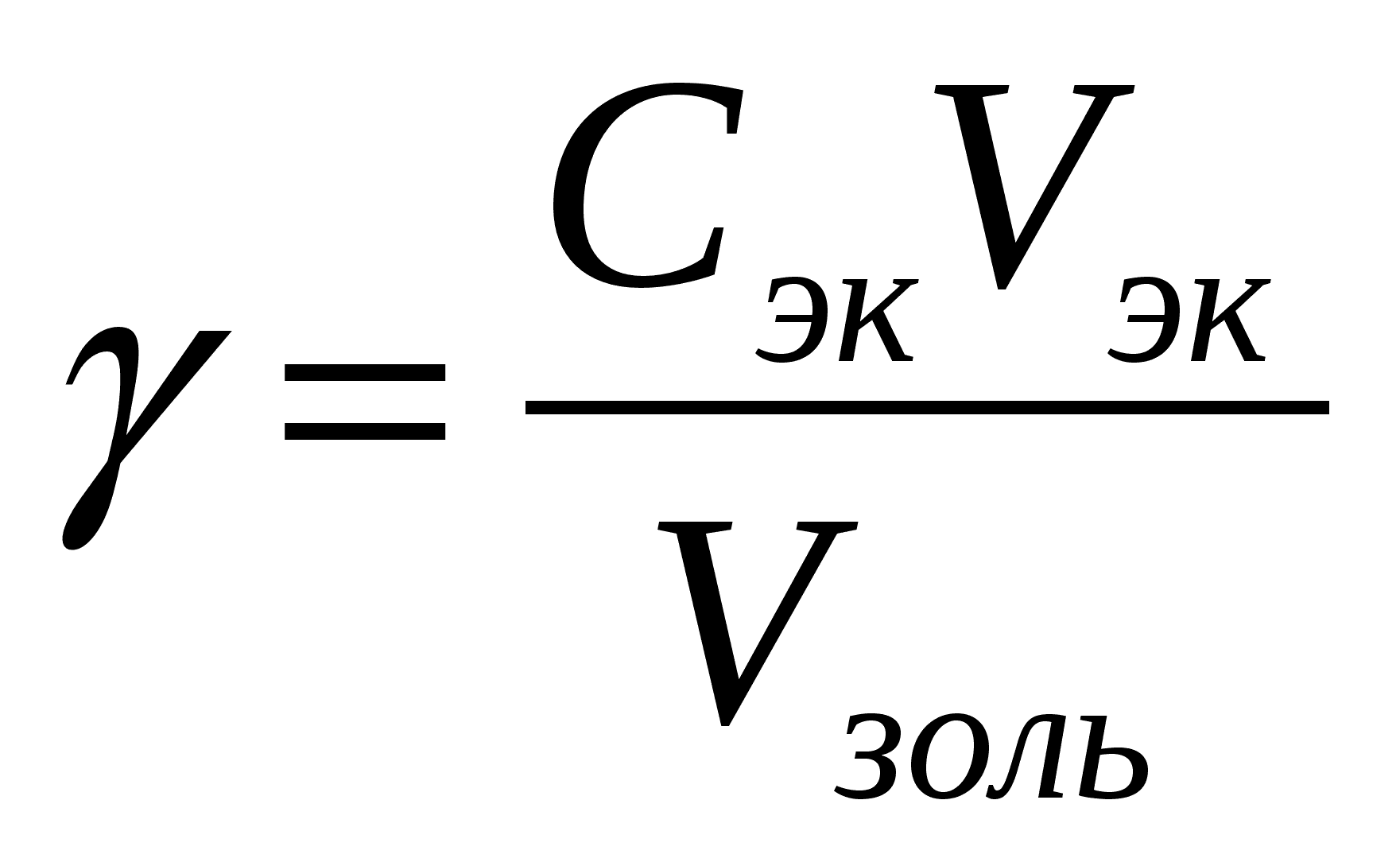
Порог коагуляции обычно измеряется в моль/л или в ммоль/л. При этом следует помнить, что физический смысл этой размерности – количество электролита (моль или ммоль), способное вызвать коагуляцию 1 литра коллоидного раствора.
Кроме порога коагуляции в коллоидной химии используется и обратная ему величина – коагулирующая способность Р:
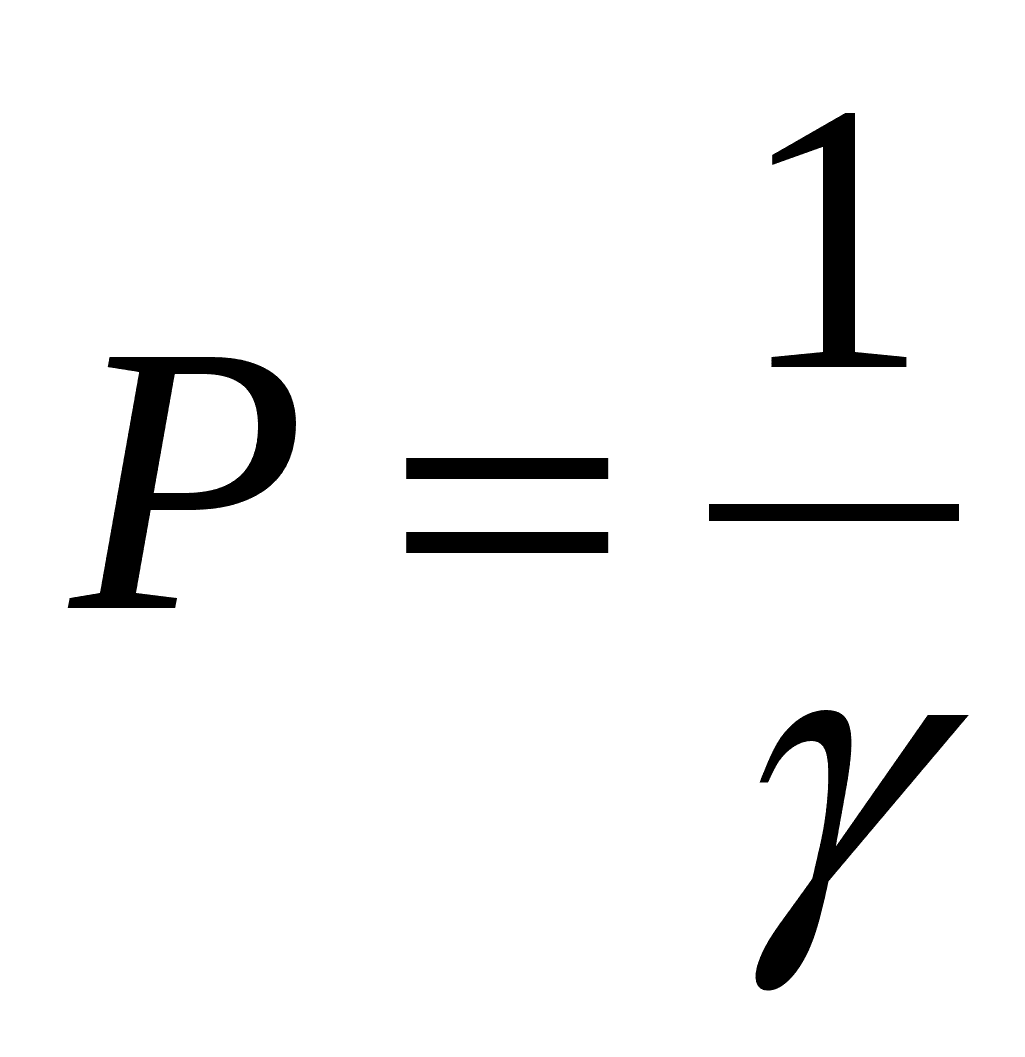
Размерность Р – л/моль или л/ммоль, что по физическому смыслу соответствует объёму золя, который может быть скоагулирован 1 молем (или миллимолем) электролита.
Порог коагуляции, а значит, и коагулирующая способность являются приблизительными характеристиками, так как зависят от очень многих факторов – от скорости прибавления электролита-коагулятора, от способа приготовления золя, от метода регистрации, от времени между добавлением электролита и моментом фиксирования явной коагуляции, от температуры и др.
Правило шульце-гарди. Коагулирующий ион имеет заряд, протиоположный коллоидной частицы, и чем он больше, тем больше его коагулирующее действие.
28)Классификация высокомолекулярных соединений. Сравнительная характеристика растворов ВМС, коллоидных и истинных растворов. Основные классы биополимеров: белки, нуклеиновые кислоты, полисахариды. Глобулярная и фибриллярная структура белков. Изоэлектрическое состояние. Изоэлектрическая точка белка. Электрофорез.
ВМС-это соединение молекулярной массы, которая преваешт 1000 углеродные единиц массы или а.е.м. и макромолекулы, которые построены из большого числа повторяющихся мономерных звеньев или молекулярных группировок.
ВМС обладают свойствами не только истинных растворов (само-произвольность образования раствора, его термодинамиче-ская устойчивость, молекулярная дисперсность, гомоген-ность), но и свойствами коллоидных растворов (неспособ-ность молекул полимера проникать через полупроницаемую мембрану, низкое осмотическое давление, малые скорости диффузии молекул, светорассеяние).
Коллоидные растворы
Как уже отмечалось, нерастворимых веществ нет. Даже твёрдые вещества, которые, вроде бы, являются нерастворимыми, - тоже частично растворяются, при этом образуя мельчайшие частицы в растворителе мицеллы. Эти частицы проходят через фильтр. Они настолько мелкие и лёгкие, что не выпадают в осадок. Такие частицы (мицеллы) называют коллоидными. А растворы - коллоидные растворы.
Коллоидные частицы можно рассмотреть в растворе с помощью пучка света - лучи отражаются и преломляются, и тогда коллоидные частицы становятся видны невооружённым глазом. (Такое явление называют эффектом Тиндаля).
В коллоидных растворах частицы имеют размер от 0,1...0,001 мкм (микрон).
Ещё одно распространённое название коллоидных растворов - золи. При длительном хранении золи переходят в гель (структура геля отличается от золи положением частиц (мицелл) - в гелях они сгруппированы).
Но если гель нагреть, то он снова перейдёт в золь.
Суспензия
Золи, которые переходят в гель, но при этом обратное превращение исключается - называют суспензиями. Если из геля снова получается золь - то это уже эмульсия.
Примерами коллоидного раствора могут быть молоко, клей, чернила, майонез, эмульсия фотоплёнок (раствор серебра). Облака - это тоже коллоидные растворы, где воздух - растворитель, а капли воды - коллоидные частицы.
Если насыпать в воду песок и взболтать, то песок очень быстро отделится от воды и окажется на дне ёмкости. Если перемешать пыль с водой, то тоже выпадет осадок, но гораздо медленнее. В таких случаях нельзя говорить о растворе, так как частицырастворяемого вещества видны невооруженным глазом или с помощью лупы, или микроскопа. Эта смесь является гетерогенной. Смеси такого типа, в которых компоненты можно отделить друг от друга путём простой фильтрации, также называют суспензиями.
Истинные растворы – это однофазные дисперсные системы, они характеризуются большой прочностью связи между дисперсной фазой и дисперсионной средой. Истинный раствор сохраняет гомогенность неопределенно долгое время. Истинные растворы всегда прозрачны. Частицы истинного раствора не видны даже в электронный микроскоп. Истинные растворы хорошо диффундируют.
Компонент, агрегатное состояние которого не изменяется при образовании раствора, называют растворителем (дисперсионная среда), а другой компонент – растворенным веществом (дисперсная фаза).
При одинаковом агрегатном состоянии компонентов растворителем считается компонент, количество которого в растворе преобладает.
В растворах электролитов вне зависимости от соотношения компонентов электролиты рассматриваются как растворенные вещества.
Истинные растворы подразделяются:
· по типу растворителя: водные и неводные
· по типу растворенного вещества: растворы солей, кислот, щелочей, газов и т.д.
· по отношению к электрическому току: электролиты и неэлектролиты
· по концентрации: концентрированные и разбавленные
· по степени достижения предела растворимости: насыщенные и ненасыщенные
· с термодинамической точки зрения: идеальные и реальные
· по агрегатному состоянию: газообразные, жидкие, твердые.
Основные классы биополимеров: белки, нуклеиновые кислоты, полисахариды.
Белки-высокомолекулярные биополимеры мономерами, которых явлются аминокислоты.
Аминокислоты-органические к-ты, содержащие амминогруппу (-NH2), еоторой присущи щёлочные св-ва, и карбоксильную группы (-COOH) с кислотными остатками (основ, к-т).
Ренатурация-процесс восстановления природной структуры белка.
Денаурация-процесс нарушения природной структуры белка под влиянием различных физико-химических факторов(температура, давление, кислоты, и др.) без разрушения пептидной связи(первичной структуры).
Функции белков: строительная, энергетическкая, защитная, сократительная или двигательная, резервная, транспортная, регуляторная, каталитическая.
Нуклеиновые кислоты-сложные высокомолекулярные биополимеры, мономерами которых являются нуклеотиды. Молекула нуклеотидов состоит из остатков азотистого основания, пятиуглеродного моносахарида (пентозы) и фосфорной кислоты.
Нуклеиновые кислоты-это продукты конденсации фосфатной к-ты, моносахаридов(рибоза, дезоксирибоза) и гетероциклических оснований.
Углеводы.
Полисахариды (С6Н10О5)n - полимеры, содержащие больше 10-ти моносахаридных звеньев(глюкоза, амилоза, ацетилглюкозамин и др.), соединённых между собой О-гликозидными связями. Они входят в состав мембран клеток и их органелл, а так же являются поставщиками энергии.(Крахмал, гликоген, целлюлоза).
Комплексные соединения: углеводов с белками-гликопротеиды, углеводов с липидами-гликолипиды, сложный гликопептид-муреин, хитин-в отличие от целлюлозы в молекулах остатки глюкозы связаны с азотсодержащими группами и др.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
Глобулярная (сферическая) – компактные шаровидные. Образования: гемоглобин, гликоген, пепсин, трипсин, панкреатин и др.
Ограниченно набухающие:процесс перехода от набухания к растворению происходит при определенных факторах (повышение температуры и др.)
Фибриллярная (линейная,слаборазветвленная) –ассиметричные пачки молекул:желатин,целлюлоза и ее производные, коллаген, полиакрилат натрия и др.
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей.
Электрофорез-движение частиц дисперсной фазы во внешнем электрическом поле.
рН при которой белок находится в изоэлектрическом состоянии называется изоэлектрической точкой (ИЭТ).
29.Факторы термодинамической устойчивости растворов ВМС. Методы осаждения белков. Особенности высаливания биополимеров из растворов. Коацервация и денатурация белков.
Методы осаждения белков:
1)Высаливание – это процесс осаждения белков нейтральными солевыми растворами щелочных и щелочноземельных металлов.Высаливание – это уменьшение растворимости ВМС и выпадение в осадок. 2)Центрифугирование — это разделение механических смесей на составные части действием центробежной силы.3)Коацервация-это разрушение гидратной сферы молекулы белка или полимера с последующим слиянием и образованием общей гидратной сферы. Коацервация – раслаивание системы на два слоя.4)Денатурация-процесс нарушение макрструктуры белка в результате разрушения не ковалентных связей. Ренатурация-процесс восстановления природной структуры белка.
30.Физико-химические свойства растворов ВМС: набухание, студнеобразование, вязкость, осмотическое давление. Роль ВМС в процессах жизнедеятельности организма. Применение биополимеров в медицине и фармации.
Физико-химические свойства растворов ВМС:
1. Студнеобразование-это процеес перехода р-а полимера в студнеобразное состояние.
2.Набухание-процесс проникновения молекул раствоителя в полимерную структуру, сопровождающийся увеличением объёма образца полимера. На набухание влияют: температура, значение рН среды, наличие электролитов и др.
Количественная характеристика набухание: a(альфа)=m-m0*100 %/m0
3.Вязкость — величина, обратная текучести жидкости; зависит от природы жидкости и уменьшается с увеличением температуры.
4.Осмотическое давление — давление на раствор, отделенный от чистого растворителя мембраной, проницаемой только для молекул растворителя (полупроницаемая мембрана), при котором прекращается осмос.
Роль ВМС в процессах жизнедеятельности организма. Применение биополимеров в медицине и фармации. |
|
|
 Скачать 1.4 Mb.
Скачать 1.4 Mb.