1. Периодический закон Д. И. Менделеева, его современная формулировка. Структура периодической системы с точки зрения строения атома.
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
14.Тепловые эффекты химических реакций. Первый закон Гесса и следствия из него. Термодинамические расчеты для энергетической характеристики биохимических процессов и оценки калорийности продуктов питания. Закон Гесса: тепловой эфект реакции не зависит от пути прохождения реакции, а только от начального и конечного состояния. 1-ое следствие из закона Гесса: тепловой эффект прямой реакции равен тепловому эфект обратной реакции с обратным знаком. 2-ое следствие-тесловой эффект циклического процесса равен нулю. 3-ое следствие-тепловой эффект реакции равен разности между суммой энтальпии продуктов и сумме энтальпии исходных вещ-в. аА+вВ→ сС+dD+Q Любой самопроизвольный процесс протекает с уменьшением энергии системы. Теплота не может самопроизвольно переходить от менее нагретого тела, к более нагретому. 15.Второй закон термодинамики. Понятие энтропии. Энтропия как мера неупорядоченности вселенной. Термодинамические потенциалы. Энергия Гиббса, энергия Гельмгольца. Критерии направленности процессов.Экзэргонические и эндэргонические процессы. Второй закон термодинамики: все самопроизвольные процессы в природе идут с увеличением энтропии. (Энтропия - мера хаотичности, неупорядоченности системы) . Энтропия, или S-термодинамическая функция состояние системы, которая является мерой упорядочености системы. Стандартная энтропия для простых в-в не равна нулю. Зависит от природы в-ва, от агрегатного состояния в-ва, от температуры (с ростом, которой энтропия возрастает). Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, которые содержат в себе всю термодинамическую информацию о системе. Наибольшее значение имеют четыре основных термодинамических потенциала: 1) внутренняя энергия U(S,V), 2) энтальпия H(S,p) = U + pV, 3) энергия Гельмгольца F(T,V) = U - TS, 4) энергия Гиббса G(T,p) = H - TS = F + pV. Самопроизвольно протекающие при данных условиях реакции называются экзергоническими; реакции, которые могут протекать только при оказании постоянного воздействия извне называютсяэндергоническими. Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называютэкзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую. Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими 16.Основные понятия химической кинетики. Скорость химической реакции, факторы ее определяющие. Константа скорости химической реакции. Понятие о порядке реакции. Кинетические уравнения реакций нулевого, первого и второго порядков. Химическая кинетика-это раздел химии, который изучает механизмы и скорости протекания химических реакций. Процессы протекающие быстро называются лабильными. Процессы протекающие медленно называются инертными. Факторы, которые влияют на скорость гомогенной реакции (все реагенты находятся в 1-ой фазе, напр. в растворе): 1)природа реагентов; 2) концентрация реагентов; 3)температура;4)катализатор. Введение катализатора в системе приводит к снижению энергии активации. Всё это гомогенные реакции. Факторы влияющие на скорость гетерогенной реакции (реагенты находящиеся в разных фазах, напр. ж. и тв.): 1)природа реагирующих в-в; 2)температура; 3)скорость диффузий молекул; 4)величина поверхности раздела фаз; 5)катализатор. Кинетические уравнения. Константа скорости химической реакции. Понятие о порядке реакции. Кинетические уравнения реакций нулевого, первого и второго порядков. Уравнение Аррениуса: К=А*е-Е/(RT), где А-постоянная, не зависящая от температуры, е=2,71828, Е-энергия активации, R=8,314 Дж(К*моль)-газовая постоянная. Константа скорости увеличивается с увеличение температуры и уменьшением энергии активации. 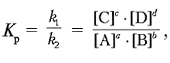 Для реакций нулевого порядка кинетическое уравнение имеет следующий вид: Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения. 17.Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент химических и биохимических процессов. Понятие об энергии активации Првило Вант-Гоффа: при повышении температуры на каждые 10 °C скорость большинства реакции возрастает в 2-4 раза, а при понижении температуры на 10 °C скорость реакции во столько же раз уменьшается.  Столкновение приводящие к химическим реакциям называются активными. Сильное изменение скорости реакции с изменением температуры объясняет теория активации. Согласно этой теории в хими-ческое взаимодействие вступают только активные молеку-лы (частицы), обладающие энергией, достаточной для осущест-вления данной реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, - этот процесс называется активацией. Один из способов активации - увели-чение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается ско-рость. Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации. Её определяют опытным путем, обозначают буквой Еa и обычно выражают в кДж/моль. Так, например, для соединения водорода и иода (Н2 + I2 = 2НI) Еа = 167,4 кДж/моль, а для распада иодоводорода (2НI = Н2 + I2) Еа = 186,2 кДж/моль. Энергия активации Еa зависит от природы реагирующих веществ и служит характеристикой каждой реакции. 18.Обратимые и необратимые реакции. Константа равновесия. Принцип Ле-Шателье. Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты, называются необратимыми.(К>10^6) К ним откосятся как гетерогенные, так и гомогенные реакции. Например, реакции горения простых веществ — фосфора, угля, железа и сложных — метана СН4, сероуглерода СS2. Обратимые реакции протекают не до конца - при обратимой реакции ни одно из реагирующих в-в не израсходуется полностью.(К<10^6). Это различие связано с тем, что не обратимая реакция может протикать только в одном направлении. Обратимая реакция может протекать как в прямом, так и в обратных направлениях. Константа равновесия-это мера протекания прямой реакции. к=0-прямая реакция не идёт; к>1-равновесие сдвинуто вправо, смещено в сторону продуктов; к<1-равновесие сдвинуто влево, смещено в сторону реагентов. Принцип Ле-Шателье-если на систему, находящуюся в состоянии химического равновесия, осуществляется воздействие (изменяется температура, давление или концентрация в-в), то в первую очередь происходит та реакция, которая уменьшает это воздействие. 19.Поверхностные явления. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества. Правило Дюкло-Траубе. Сорбционные процессы: адсорбция, абсорбция, хемосорбция. Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. Правило Дюкло-Траубе: в гомонологическом ряду карбоновых к-т, спиртов и амминов (NH3) при увеличение длины углеводной цепи на СН2-группу поверхностная активности увеличивается в 3-3,5 раза. Поверхностно-активные вещества (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения. Уменьшают поверхностное натяжение воды. Примеры: карбоновые к-ты, спирты, аммины. Поверхностно-неактивные вещества (ПНВ)-в-ва, которые не влияют на поверхностное натяжение. Сорбционные процессы: адсорбция, абсорбция, хемосорбция. Адсорбция-поглощение поверхностью сорбента. Абсорбция-поглощение пов-стью сорбента. Хемосорбция-сорбция с химическим взаим-вием. 20.Адсорбция на поверхности раздела жидкость-газ и жидкость-жидкость. Уравнение Гиббса. Ориентация молекул в поверхностном слое. Представления о структуре биологических мембран. Адсорбция-поглощение газов, паров и жидкостей поверхностным слоем твёрдого тела(адсорбента) или жидкостью.  Представления о структуре биологических мембран. Мембраны биологические — функционально активные поверхностные структуры толщиной в несколько молекулярных слоев, ограничивающие цитоплазму и большинство органелл клетки, а также образующие единую внутриклеточную систему канальцев, складок, замкнутых областей. Биологические мембраны имеются во всех клетках. Их значение определяется важностью функций, которые они выполняют в процессе нормальной жизнедеятельности, а также многообразием заболеваний и патологических состояний, возникающих при различных нарушениях мембранных функций и проявляющихся практически на всех уровнях организации — от клетки и субклеточных систем до тканей, органов и организма в целом. Химический состав и строение биологических мембран. Состав биологических мембран зависит от их типа и функций, однако основными составляющими являются липиды и белки, а также углеводы (небольшая, но чрезвычайно важная часть) и вода (более 20% общего веса). 21.Адсорбция на поверхности раздела твердое вещество-газ. Факторы, определяющие адсорбцию на поверхности твердого тела. Уравнение Ленгмюра. Физическая и химическая адсорбция. Адсорбция на границе твердое тело – газ. При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию. Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле. Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах Теория мономолекулярной адсорбции Ленгмюра. Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях. 1) Адсорбция является локализованной и вызывается силами, близкими к химическим. 2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными. 3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул. 4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие..(уравнения в тетраде) 22.Адсорбция на поверхности раздела твердое вещество-жидкость. Молекулярная адсорбция. Ионная адсорбция: селективная и ионообменная. Правило Паннета-Фаянса. Физико-химические основы адсорбционной терапии (гемосорбция, плазмосорбция, энтеросорбция, аппликационная терапия). Поверхностные явления на подвижных границах раздела фаз. Поверхностное натяжение жидкости – это основная термодинамическая характеристика поверхностного слоя жидкости на границе с газовой фазой или другой жидкостью. Поверхностное натяжение зависит от природы жидкости, температуры, природы и концентрации растворенных веществ. Поверхностное натяжение возрастает с увеличением сил взаимодействия между частицами жидкости. Поверхностное натяжение на границе жидкость – газ колеблется в широких пределах от 1 мДж/м2 для сжиженных инертных газов до нескольких тысяч – для расплавов тугоплавких веществ. Поверхностное натяжение уменьшается с ростом температуры вследствие уменьшения сил взаимодействия между молекулами жидкости. Поверхностное натяжение на границе жидкость – газ уменьшается при увеличении давления вследствие увеличения концентрации молекул газа над поверхностью жидкости. Растворенные вещества могут повышать, понижать и практически не влиять на поверхностное натяжение растворителя. Способность растворенных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Ионная адсорбция — адсорбция из растворов сильных электролитов. В этом случае растворенное вещество адсорбируется в виде ионов. АДСОРБЦИЯ СЕЛЕКТИВНАЯ (ИЗБИРАТЕЛЬНАЯ) — процесс, основанный на неодинаковой способности отдельных компонентов газовой или жидкой смеси поглощаться из данного растворителя данным адсорбентом. Ионообменная адсорбция — это процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из жидкого раствора. Правило-Панета Фаянса(правило фаянса)  Гемосорбция - метод лечения, основанный на удалении из крови токсических веществ при прохождении ее через колонку с активированным углем или массообменники, имеющие фильтры. Плазмосорбция - метод эфферентной терапии (экстракорпоральной детоксикации, гравитационной хирургии крови), направленный на удаление из плазмы крови различных токсических продуктов путем контакта плазмы с сорбентом вне организма. Энтеросорбция – это современный и очень эффективный метод очищения всего организма от вредных веществ, путем “пропускания” препаратов - энтеросорбентов через желудочно – кишечный тракт. Аппликационная терапия. Одним из наиболее широко встречающихся методов локальной терапии является аппликационное применение лекарственных препаратов, что обусловлено простотой, безболезненностью процедур, при которых не повреждаются кожные покровы. 23.Дисперсные системы. Классификация дисперсных систем по степени дисперсности. Коллоидное состояние. Лиофильные и лиофобные коллоидные системы. Дисперсные системы-это микрогетерогенные системы состоящие из 2-х или более компонентов, первый компонент называется дисперсной средой, а второй компонент называется дисперсной фазой-распределение в объёме дисперсной среды в виде отдельных частиц. КЛАССИФИКАЦИЯ ПО СТЕПЕНИ ДИСПЕРСНОСТИ Свободнодисперсные: 1) ультрамикрогетерогенные: 10 -7см. а 10 -5см. (от 1 до 100 мкм) – истинно-коллоидные – (т/т); 2) микрогетерогенные: 10 -5см. а 10 -3см. (от 0,1 до 10 мкм) т/ж, ж/ж, г/ж, т/г. 3) грубодисперсные: а > 10 -3см; т/г. Связнодисперсные системы: 1) микропористые: поры до 2 мм; 2) переходнопористые: от 2 до 200 мм; 3) макропористые: выше 200 мм. Коллоидное состояние вещества - это такое состояние, в котором вещество находится в высокодисперсном (сильно раздробленном) виде, отдельные его частицы являются не молекулами, а агрегатами, состоящими из множества молекул. Лиофобными называют системы, частицы дисперсной фазы которых не взаимодействуют с дисперсионной средой, не сольватируются и не растворяются в ней. К лиофобным системам относятся золи драгоценных металлов, золи металлоидов (серы, селена, теллура), дисперсии полимеров в воде (например, полистирола, фторолона), золи сульфидов мышьяка, сурьмы, кадмия, ртути, золи гидроксидов железа, алюминия и т.д. Лиофильные- это системы, частицы дисперсной фазы которых интенсивно взаимодействуют с дисперсионной средой. Примеры:р-ры многих высокомолекулярных соединений(белки, нуклеиновые к-ты, крахмал) р-р целлюлозы в ацетоне. 24.Методы получения лиофобных коллоидов: методы диспергирования и конденсации. Методы очистки золей: фильтрация, ультрафильтрация, ультрацентрифугирование. Диализ, электродиализ, компенсационный диализ. Гемодиализ, аппарат ”искусственная почка”. Методы диспергирования практически осуществляются путем механического измельчения, дробления, истирания на дробилках, жерновах, шаровых мельницах и др.; такие методы широко применяются в производстве фармацевтических препаратов, минеральных красок, графита, цементов. ДИСПЕРГИРОВАНИЕ (от лат. dispergo - рассеиваю, рассыпаю), тонкое измельчение твердого тела или жидкости, в результате к-рого образуются дисперсные системы: порошки, суспензии, эмульсии, аэрозоли. Коллоидные растворы можно получать также и методом химической конденсации, основанном на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Для этой цели используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д. Так, красный золь золота получают восстановлением натриевой соли золотой кислоты формальдегидом: NaAuO2 + HCOH + Na2CO3 ––> Au + HCOONa + H2O. Методы очистки золей. Ультрафильтрация-это фильтрация коллоидных р-а через мембрану при повышенном внешнеем давлений или под вакуумом. Ультрафильтрация — это способ очистки воды, одновременная безреагентная дезинфекция и осветление воды. Фильтрование (фильтрация) — это отделение жидкости или газа от взвешенных в них твердых частиц в процессе пропускания их через пористые материалы, называемые фильтрами. УЛЬТРАЦЕНТРИФУГИРОВАНИЕ, метод разделения и исследования частиц размером менее 100 нм (коллоидные системы, молекулы белков, неуклеиновых к-т, синтетич. полимеров) под действием центробежных сил. Используется для отделение алазмы крови, для отделении отдельных клеточных элементов, для очистки колоидных систем, от грубодисперсных систем.(суспензии, аэрозоли, эмульсии). Диализ - искусственное очищение крови и других жидкостей человеческого тела от скопившихся шлаков, когда органы самого человека неспособны нормально выполнять эти функции. Обычно кровь фильтруется в почках, которые задерживают полезные вещества, а вредные выделяют с мочой. При заболеваниях почек, когда одна или обе почки не функционируют, больному необходим диализ. Существуют два метода диализа. Первый - очищение крови через брюшину (перитониальный) в самом теле, второй - подключение к искусственной почке. Электродиализ — это метод очистки жидких дисперсных систем (коллоидных растворов, суспензий и др., а также растворов высокомолекулярных веществ, например белков) от примесей низкомолекулярных веществ, растворенных в дисперсионной среде. Электродиализ основан на ускорении диффузии ионов через мембрану под действием достоянного электрического поля. Компенсационный диализ и вивидиализ - методы, разработанные для исследования биологических жидкостей, представляющих собой коллоидные системы. Принцип метода компенсационного диализа состоит в том, что в диализаторе вместо чистого растворителя используют растворы опре-деляемых низкомолекулярных веществ различной концентрации. Напри-мер, для определения свободного, не связанного с белками, сахара крови проводят ее диализ против изотонического солевого раствора, содержащего различные концентрации сахара. В том растворе, где концентрация сахара равна концентрации свободного сахара в сыво-ротке крови, в ходе диализа концентрация сахара не изменяется. Этот метод позволил выявить присутствие в крови глюкозы и мочевины в свободном состоянии. Гемодиализ – внепочечное очищение крови. Аппарат «искусственная почка» фильтрует кровь через особую мембрану, очищает ее от воды и токсичных продуктов жизнедеятельности организма. Он работает вместо почек, когда те не в состоянии выполнять свои функции. Гемодиализ необходим людям с острой почечной недостаточностью, отравлением лекарственными средствами, спиртами, ядами. Но больше всего в гемодиализе нуждаются люди с хронической почечной недостаточностью. Аппарат берет на себя функции неработающих почек, что позволяет продлить жизнь таких больных на 15-25 лет. Аппарат для гемодиализа отфильтровывает из крови токсины, мочевину, избавляет от лишней жидкости, нормализует электролитный баланс, артериальное давление и восстанавливает кислотно-щелочное равновесие. Искусственная почка — аппарат для временного замещения выделительной функции почек. |
