1-18 (кратко). 1. Понятие дыхательная недостаточность и ее виды. Дыхательная недостаточность
 Скачать 0.68 Mb. Скачать 0.68 Mb.
|
|
Кардиогенный отек легких развивается при острой недостаточности левых отделов сердца. Ослабление сократительной и диастолической функций левого желудочка возникает при миокардитах, кардиосклерозе, инфаркте миокарда, гипертонической болезни, недостаточности митрального клапана, аортальных клапанов и стенозе устья аорты. Недостаточность левого предсердия развивается при митральном стенозе. Исходным моментом недостаточности левого желудочка является повышение в нем конечного диастолического давления, что затрудняет переход крови из левого предсердия. Повышение давления в левом предсердии препятствует переходу в него крови из легочных вен. Повышение давления в устье легочных вен приводит к рефлекторному повышению тонуса артерий мышечного типа малого круга кровообращения (рефлекс Китаева), что вызывает легочную артериальную гипертензию. Давление в легочной артерии возрастает до 35-50 мм рт.ст. Особенно высокой легочная артериальная гипертензия бывает при митральном стенозе. Фильтрация жидкой части плазмы из легочных капилляров в ткани легких начинается, если гидростатическое давление в капиллярах превышает 25- 30 мм рт.ст., т.е. величину коллоидно-осмотического давления. При повышенной проницаемости капилляров фильтрация может происходить при меньших величинах давления. Попадая в альвеолы, транссудат затрудняет газообмен между альвеолами и кровью. Возникает так называемая альвеолярно-капиллярная блокада. На этом фоне развивается гипоксемия, резко ухудшается оксигенация тканей сердца, может возникнуть его остановка, развиться асфиксия. Отек легких может возникнуть при быстром внутривенном вливании большого количества жидкости (физиологический раствор, кровезаменители). Отек развивается в результате снижения онкотического давления крови (из-за разведения альбуминов крови) и повышения гидростатического давления крови (из-за увеличения ОЦК). При микробном поражении легких развитие отека связано с поражением системы сурфактанта микробными агентами. При этом повышается проницаемость АКМ, что способствует развитию внутриальвеолярного отека и снижению диффузии кислорода. Это происходит не только в очаге воспалительного отека, а диффузно в легких в целом. Токсические вещества различной природы также повышают проницаемость АКМ. Аллергический отек легких обусловлен резко возникающим повышением проницаемости капилляров в результате действия медиаторов, высвобождающихся из тучных и других клеток при аллергии. 15. Пневмоторакс, виды, причины, патогенез. Пневмоторакс — наличие воздуха в плевральной полости. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ Возникновение сообщения плевральной полости с окружающей средой (через просвет бронха или при нарушении целостности грудной клетки). Поступление воздуха в плевральную полость и повышение внутриплеврального давления (в норме ниже атмосферного). Сдавление и спадение лёгочной ткани (коллапс лёгкого) -» неэффективная вентиляция -> гипоксия. Смещение средостения в противоположную сторону, сдавление и перегиб крупных кровеносных сосудов (верхней полой вены и других) -> уменьшение венозного возврата -» снижение сердечного выброса -» нарушение гемодинамики и усугубление гипоксии. Через 4—6 ч развития пневмоторакса возникает воспалительная реакция плевры, через 2—5 сут плевра утолщается за счёт отёка, что затрудняет расправление лёгкого. Приоткрытом пневмотораксе плевральная полость сообщается с атмосферным воздухом постоянно — как при в вдохе, так и при выдохе. Если в дальнейшем дефект в плевре закрывается фибрином и сообщение прекращается, то формируется закрытый пневмоторакс. Наиболее опасным является напряженный пневмоторакс, при котором воздух во время доха поступает в плевральную полость, а во время выдоха отверстие закрывается и воздух задерживается в плевральной полости. В итоге давление в плевральной полости прогрессивно нарастает, что приводит к полному коллапсу лёгкого, значительному смещению средостения и развитию угрожающих жизни нарушений дыхания и кровообращения. КЛАССИФИКАЦИЯ По происхождению Спонтанный пневмоторакс Первичный — без клинически очевидных заболеваний лёгких (ограниченная буллезная эмфизема при недостаточности альфа-1-антитрипсина, синдром Марфана). Чаще встречается у высоких молодых мужчин 20—40 лет. Курение увеличивает риск в 22 раза. Вторичный — на фоне заболеваний лёгких (ХОБЛ, бронхиальная астма, пневмоцистная пневмония, муковисцидоз, туберкулёз, нагноительные заболевания лёгких, бронхоэктазии, злокачественные опухоли, СПИД и др.) Травматический пневмоторакс, возникающий вследствие проникающего ранения или тупой травмы грудной к клетки. Ятрогенный пневмоторакс, развивающийся после: торакоцентеза или биопсии плевры (лёгких); трансторакальной игольчатой биопсии; постановки подключичного катетера; баротравмы. По распространённости: тотальный, частичный. и неосложненный, осложненный (кровотечением, плевритом, медиастинальной эмфиземой). 16. Виды, этиология и патогенез периодического дыхания. Нарушения ритма дыхательных движений Типы периодического дыхания. Периодическим дыханием называется такое нарушение ритма дыхания, при котором периоды дыхания чередуются с периодами апноэ. К нему относятся дыхание Чейна-Стокса и дыхание Биота (рис. 16-4). При дыхании Чейна- Стокса паузы (апноэ - до 5-10 с) чередуются с дыхательными движениями, которые сначала нарастают по глубине, затем убывают. При дыхании Биота паузы чередуются с дыхательными движениями нормальной частоты и глубины. В основе патогенеза периодического дыхания лежит понижение возбудимости дыхатель ного центра. Оно может возникать при органических поражениях головного мозга - травмах, инсультах, опухолях, воспалительных процессах, при ацидозе, диабетической и уремической комах, при эндогенных и экзогенных интоксикациях. Возможен переход в терминальные типы дыхания. Иногда периодическое дыхание наблюдается у детей и людей старческого возраста во время сна. В этих случаях нормальное дыхание легко восстанавливается при пробуждении. В основе патогенеза периодического дыхания лежит снижение возбудимости дыхательного центра (или другими словами - повышение порога возбудимости дыхательного центра). Предполагают, что на фоне пониженной возбудимости дыхательный центр не реагирует на нормальную концентрацию углекислого газа в крови. Для возбуждения дыхательного центра требуется большая его концентрация. Время накопления этого раздражителя до пороговой дозы определяет длительность паузы (апноэ). Дыхательные движения создают вентиляцию легких, СО2 вымывается из крови, и дыхательные движения вновь замирают. Терминальные типы дыхания. К ним относятся дыхание Куссмауля (большое дыхание), апнейстическое дыхание и гаспингдыхание. Есть основания предполагать существование определенной последовательности фатального нарушения дыхания до его полной остановки: сначала возбуждение (дыхание Куссмауля), апнейзис, гаспинг-дыхание, паралич дыхательного центра. При успешных реанимационных мероприятиях возможно обратное развитие нарушений дыхания до его полного восстановления. Дыхание Куссмауля - большое, шумное, глубокое дыхание («дыхание загнанного зверя»), характерное для пациентов с нарушением сознания при диабетической, уремической комах, при отравлении метиловым спиртом. Дыхание Куссмауля возникает в результате нарушения возбудимости дыхательного центра на фоне гипоксии мозга, ацидоза, токсических явлений. Глубокие шумные вдохи с участием основной и вспомогательной дыхательной мускулатуры сменяются активным форсированным выдохом. 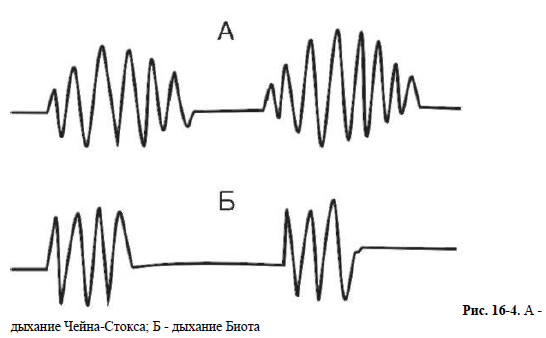 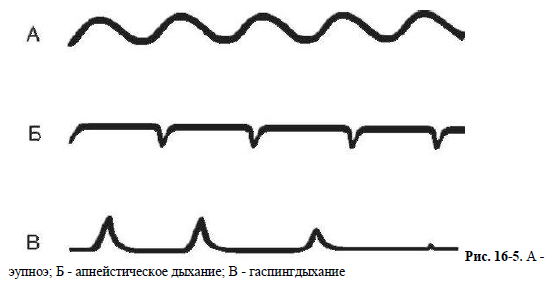 Апнейстическое дыхание (рис. 16-5) характеризуется продолжительным вдохом и изредка прерывающимся, форсированным коротким выдохом. Длительность вдохов многократно превышает продолжительность выдохов. Развивается при поражении пневмотаксического комплекса (передозировка барбитуратов, травмы головного мозга, инфаркт моста мозга). Такой вид дыхательных движений возникает в эксперименте после перерезки у животного обоих блуждащих нервов и ствола на границе между верхней и средней третью моста. После подобной перерезки устраняются тормозные влияния верхних отделов моста на нейроны, отвечающие за вдох. Гаспинг-дыхание (от англ. gasp - ловить воздух ртом, задыхаться) возникает в самой терминальной фазе асфиксии (т.е. при глубокой гипоксии или гиперкапнии). Оно встречается у недоношенных детей и при многих патологических состояниях (отравлениях, травмах, кровоизлияниях и тромбозах ствола головного мозга). Это единичные, редкие, убывающие по силе вдохи с длительными (по 10-20 с) задержками дыхания на выдохе. В акте дыхания при гаспинге участвуют не только диафрагма и дыхательные мышцы грудной клетки, но и мускулатура шеи и рта. Источником импульсов при данном виде дыхательных движений являются клетки каудальной части продолговатого мозга при прекращении функции вышележащих отделов мозга. Различают еще диссоциированное дыхание - нарушение дыхания, при котором наблюдаются парадоксальные движения диафрагмы, асимметрии движения левой и правой половины грудной клетки. «Атаксическое» уродливое дыхание Грокко-Фругони характеризуется диссоциацией дыхательных движений диафрагмы и межреберных мышц. Это наблюдается при нарушениях мозгового кровообращения, опухолях мозга и других тяжелых расстройствах нервной регуляции дыхания. 17. Этиология и патогенез респираторного дистресс-синдрома детей и взрослых. Респираторный дистресс-синдром взрослых (РДСВ) РДСВ (пример острой дыхательной недостаточности) - полиэтилогическое состояние, характеризующееся острым началом, выраженной гипоксемией (не устраняемой оксигенотерапией), интерстициальным отеком и диффузной инфильтрацией легких. РДСВ может осложнять любое критическое состояние, вызывая тяжелейшую острую дыхательную недостаточность. Несмотря на прогресс в диагностике и лечении данного синдрома, летальность составляет 50%, по некоторым данным - 90%. Этиологическими факторами РДСВ являются: шоковые состояния, множественные травмы (включая ожоговые), ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания крови), сепсис, аспирация желудочным содержимым при утоплении и вдыхании токсических газов (включая чистый кислород), острые заболевания и повреждения легких (тотальная пневмония, контузии), атипичная пневмония, острый панкреатит, перитонит, инфаркт миокарда и др. Многообразие этиологических факторов РДСВ отражается во множестве синонимов: синдром шокового легкого, синдром влажных легких, травматическое легкое, синдром легочных нарушений у взрослых, синдром перфузионного легкого и др. Картина РДСВ имеет две основные черты: 1) клинические и лабораторные (раО2 <55 мм рт.ст.) признаки гипоксии, некупируемой ингаляцией кислородом;
2) диссеминированная двусторонняя инфильтрация легких, выявляемая рентгенологически, дающая внешние проявления затрудненного вдоха, «надрывного» дыхания. Кроме того, при РДСВ отмечаются интерстициальный отек, ателектазы, в сосудах легких - множество мелких тромбов (гиалиновых и фибриновых), жировые эмболы, гиалиновые мембраны в альвеолах и бронхиолах, стаз крови в капиллярах, внутрилегочные и субплевральные кровоизлияния. На клинике РДСВ сказываются также проявления основного заболевания, вызвавшего РДСВ. Основным звеном патогенеза РДСВ является повреждение АКМ этиологическими факторами (например, токсическими газами) и большим количеством биологически активных веществ (БАВ). К последним относятся агрессивные вещества, выделяющиеся в легких в ходе выполнения ими недыхательных функций при деструкции задержанных легкими жировых микроэмболов, тромбов из фибрина, агрегатов тромбоцитов и др. клеток, поступивших в легкие в большом количестве из различных органов при их повреждении (например, при панкреатите). Таким образом, можно считать, что возникновение и развитие РДСВ является прямым следствием перегрузки недыхательных функций легких - защитной (очистка крови и воздуха) и метаболической (участие в гемостазе). К БАВ, секретируемым различными клеточными элементами легких и нейтрофилами при РДСВ, относятся: ферменты (эластаза, коллагеназа и др.), свободные радикалы, эйкозаноиды, хемотаксические факторы, компоненты системы комплемента, кинины, ПДФ и др. В результате действия этих веществ отмечаются: бронхоспазм, спазм легочных сосудов, повышение проницаемости АКМ и увеличение внесосудистого объема воды в легких, т.е. возникновение отека легкого, усиление тромбообразования. В патогенезе РДСВ выделяют 3 патогенетических фактора:
1. Нарушение диффузии газов через АКМ, так как из-за действия БАВ отмечаются утолщение и повышение проницаемости АКМ. Развивается отек легкого. Формирование отека усиливается снижением образования сурфактанта, обладающего противоотечным действием. АКМ начинает пропускать внутрь альвеол белки, которые образуют гиалиновые мембраны, выстилающие изнутри альвеолярную поверхность. В результате снижается диффузия кислорода и развивается гипоксемия. 2. Нарушение альвеолярной вентиляции. Развивается гиповентиляция, так как имеют место обструктивные расстройства (бронхоспазм) и увеличивается сопротивление движению воздуха по дыхательным путям; возникают рестриктивные расстройства (растяжимость легких снижается, они становятся жесткими в связи с образованием гиалиновых мембран и снижением образования сурфактанта вследствие ишемии легочной ткани, образуются микроателектазы). Развитие гиповентиляции обеспечивает гипоксемию альвеолярной крови. 3. Нарушение перфузии легких, так как под влиянием медиаторов развивается спазм легочных сосудов, легочная артериальная гипертензия, увеличивается тромбообразование, отмечается внутрилегочное шунтирование крови. На конечных этапах развития РДСВ формируется правожелудочковая, а затем и левожелудочковая недостаточность, а в конечном итоге еще более выраженная гипоксемия. Оксигенотерапия при РДСВ неэффективна из-за шунтирования крови, гиалиновых мембран, недостатка продукции сурфактанта, отека легкого. С гиперкапнией, тяжелой гипоксемией, дыхательным и метаболическим ацидозом протекает дистресс-синдром новорожденных, который относят к диффузионному виду нарушения внешнего дыхания. В его патогенезе имеет большое значение анатомическая и функциональная незрелость легких, заключающаяся в том, что к моменту рождения в легких в недостаточной мере вырабатывается сурфактант. В связи с этим при первом вдохе раскрываются не
все отделы легких, возникают участки ателектаза. В них повышена проницаемость сосудов, которая способствует развитию кровоизлияний. Гиалиноподобное вещество на внутренней поверхности альвеол и альвеолярных ходов способствует нарушению диффузии газов. Прогноз тяжелый, зависит от степени и протяженности патологических изменений в легких. 18. Защитно-приспособительные реакции и явления вторичного повреждения при дыхательной недостаточности. Механизмы развития компенсаторных и приспособительных реакций при гипоксии.Изменения функции органов дыхания и кровообращения, возникающие при острой гипоксии, являются в основном рефлекторными. Они обусловлены раздражением дыхательного центра и хеморецепторов дуги аорты и каротидной зоны низким напряжением кислорода в артериальной крови. Эти рецепторы чувствительны также к изменению содержания СО2 и Н+, но в меньшей степени, чем дыхательный центр. Тахикардия может быть результатом прямого действия гипоксии на проводящую систему сердца. Сосудорасширяющим действием обладают продукты распада АТФ и ряд других ранее упомянутых тканевых факторов, количество которых при гипоксии возрастает. Гипоксия является сильным стрессорным фактором, под действием которого происходит активация гипоталамо-гипофизарнонадпочечниковой системы, увеличивается выделение в кровь глюкокортикоидов, которые активируют ферменты дыхательной цепи и повышают стабильность клеточных мембран, в том числе мембран лизосом. Это снижает опасность выделения из последних в цитоплазму гидролитических ферментов, способных вызвать аутолиз клеток. При хронической гипоксии происходят не только функциональные сдвиги, но и структурные изменения, имеющие большое компенсаторно-приспособительное значение. Механизм этих явлений был подробно исследован в лаборатории Ф.З. Меерсона. Установлено, что дефицит макроэргических фосфорных соединений, обусловленный гипоксией, вызывает активацию синтеза нуклеиновых кислот и белков. Итогом этих биохимических сдвигов является усиление в тканях пластических процессов, лежащих в основе гипертрофии миокардиоцитов и дыхательной мускулатуры, новообразования альвеол и новых сосудов. В результате повышается работоспособность аппарата внешнего дыхания и кровообращения. Вместе с тем функционирование этих органов становится более экономичным вследствие повышения мощности системы энергообеспечения в клетках (увеличение числа митохондрий, повышение активности дыхательных ферментов).
Установлено, что при длительной адаптации к гипоксии уменьшается продукция тиреотропного и тиреоидных гормонов; это сопровождается снижением основного обмена и уменьшением потребления кислорода различными органами, в частности сердцем, при неизменной внешней работе. Активация синтеза нуклеиновых кислот и белков при адаптации к хронической гипоксии обнаружена и в головном мозгу и способствует улучшению его функции. Состояние устойчивой адаптации к гипоксии характеризуется уменьшением гипервентиляции легких, нормализацией функции сердца, снижением степени гипоксемии, устранением стресссиндрома. Происходит активация стресс-лимитирующих систем организма, в частности многократное повышение содержания опиоидных пептидов в надпочечниках, а также в мозгу животных, подвергнутых острой или подострой гипоксии. Наряду с антистрессорным действием опиоидные пептиды понижают интенсивность энергетического обмена и потребность тканей в кислороде. Усиливается активность ферментов, устраняющих повреждающее действие продуктов перекисного окисления липидов (супероксиддисмутазы, каталазы и т.д.). Установлено, что при адаптации к гипоксии повышается резистентность организма к действию других повреждающих факторов, различного рода стрессоров. Состояние устойчивой адаптации может сохраняться в течение многих лет. Повреждающее действие гипоксии При резко выраженной гипоксии компенсаторые механизмы могут оказаться недостаточными, что сопровождается выраженными структурными, биохимическими и функциональными расстройствами. Чувствительность различных тканей и органов к повреждающему действию гипоксии сильно варьирует. В условиях полного прекращения доставки кислорода сухожилия, хрящи и кости сохраняют свою жизнеспособность в течение многих часов; поперечно-полосатые мышцы - около двух часов; миокард, почки и печень - 20-40 мин, тогда как в коре головного мозга и в мозжечке в этих условиях уже через 2,5-3 мин появляются очаги некроза, а через 6-8 мин происходит гибель всех клеток коры головного мозга. Несколько большей устойчивостью обладают нейроны продолговатого мозга - их деятельность может восстанавливаться спустя 30 мин после прекращения доставки кислорода.
Нарушение процессов обмена веществ при гипоксии. В основе всех нарушений при гипоксии лежит пониженное образование или полное прекращение образования макроэргических фосфорных соединений, которое ограничивает способность клеток выполнять нормальные функции и поддерживать состояние внутриклеточного гомеостаза. При недостаточном поступлении в клетки кислорода усиливается процесс анаэробного гликолиза, но он может лишь в незначительной степени компенсировать ослабление окислительных процессов. Особенно это касается клеток центральной нервной системы, потребность которых в синтезе макроэргических соединений наиболее высока. В норме потребление кислорода мозгом составляет около 20% от общей потребности в нем организма. Под действием гипоксии повышается проницаемость капилляров мозга, что ведет к его отеку и некрозу. |
