1. Предмет и задачи химической термодинамики. Классификация систем. Типы процессов. Понятие, обозначение, единицы измерения теплового эффекта химической реакции.
 Скачать 5.09 Mb. Скачать 5.09 Mb.
|
коллоквиум1.Предмет и задачи химической термодинамики. Классификация систем. Типы процессов. Понятие, обозначение, единицы измерения теплового эффекта химической реакции. Экзо- эндотермические реакции. Приведите пример термохимического уравнения, особенности термохимических уравнений. Предметы и задачи Задачи химической термодинамики: 1. Установление энергетических эффектов химических, физических и биологических процессов. 2. Установление возможности самопроизвольного протекания химических, физических и биологических процессов. 3. Установление условий равновесного состояния. Предмет термодинамики - изучение законов взаимных превращений различных видов энергии, связанных с переходом энергии между телами в форме теплоты и работы Классификация систем: Термодинамическая система — совокупность тел, выделенных из материального мира и являющимися объектами исследования термодинамическими методами Химическая система - это индивидуальные вещества или смеси веществ, отделенные от окружающей среды поверхностью раздела. Компоненты - вещества, из которых состоит химическая система. Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем. Гетерогенная система — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Фазы гетерогенной системы можно отделить друг от друга механическими методами Понятие, обозначение, единицы измерения теплового эффекта химической реакции: Тепловой эффект реакции – количество теплоты, которое выделя-ется или поглощается системой в результате протекания химической ре-акции. в кДж/моль. Экзо- эндотермические реакции: Эндотермический процесс - система получает тепло (+) Экзотермический процесс - система отдает тепло (-) Приведите пример термохимического уравнения, особенности термохимических уравнений: 1) ΔH зависит от массы реагирующих веществ. Обычно тепловой эффект рассчитывают для 1 моль вещества, поэтому возможно использовать дробные коэффициенты. ПРИМЕР 2: ½Н2(г.) + ½Сl2(г.) = HCl(г.) ; ΔfHо = –91,8 кДж H2(г.) + Cl2(г.) = 2HCl(г.) ; ΔrHо = –184 кДж Особенности термохимических уравнений 13 2) ΔH зависит от агрегатного состояния реагентов. ПРИМЕР 3: H2(г.) + ½O2(г.) = H2O(ж); ΔfHо = –285,8 кДж H2(г.) + ½O2(г.) = H2O(г); ΔfHо = –241,8 кДж 3) С термохимическими уравнениями можно производить любые алгебраические действия. 2.Понятие, обозначение, единицы измерения энтальпия образования вещества. Закон Гесса, следствие из закона Гесса. Постулат Лавуазье Лапласа. Понятие, обозначение, единицы измерения энтальпия образования вещества:  Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания . Постулат Лавуазье Лапласа - закон гласит: при разложении сложного вещества на простые поглощается (млн. выделяется) такое же количество теплоты, какое выделяется (млн. поглощается) при образовании той же массы вещества из простых веществ. 3.Понятие, обозначение, единицы измерения энтропии, формула для ее расчета. Покажите на примере определение изменения энтропии для реакций, в которых участвуют газообразные вещества, без табличных данных. Для каких систем энтропия служит критерием протекания химических реакций? Понятие, обозначение, единицы измерения энтропии, формула для ее расчета: Энтропия (S) ― функция состояния термодинамической системы, характеризующая степень (меру) упорядоченности частиц в системе. Увеличение энтропии (∆S > O, Дж/моль·K) увеличивает неупорядоченность расположения частиц. Любая система стремится к переходу в наиболее вероятное состояние (т.е к увеличению беспорядка). S(газ) > S(ж) > S(тв) 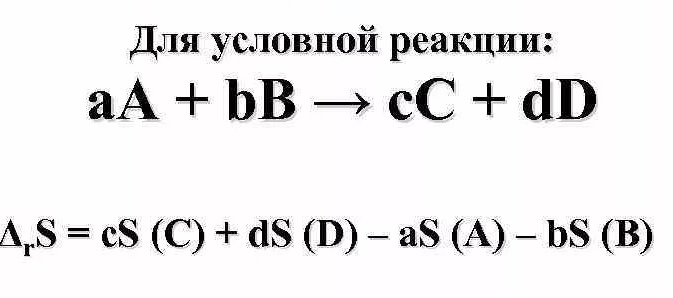  Покажите на примере определение изменения энтропии для реакций, в которых участвуют газообразные вещества, без табличных данных: Для каких систем энтропия служит критерием протекания химических реакций: Направление процесса S> 0Необратимо идет прямая реакция> S< 0Необратимо идет обратная реакция> S> 0Реакция обратима, при повышении Т идет прямая реакция S< 0Реакция обратима, при повышении Т идет обратная реакция 4.Понятие, обозначение, единицы измерения энергии Гиббса, формулы для ее расчета. Для каких систем энергия служит критерием протекания химических реакций? Как по ее знаку судят о направлении протекания процесса? Понятие, обозначение, единицы измерения энергии Гиббса, формулы для ее расчета: энергии Гиббса - это величина, показывающая изменение энергии в ходе химической реакции и характеризующая возможности самопроизвольного протекания химической реакции. Обозначение – ΔG единицы измерения - кДЖ формулы для ее расчета -ΔG=ΔH−TΔS Для каких систем энергия служит критерием протекания химических реакций? энергии Гиббса служит критерием самопроизвольного протекания химических реакций при изобарно-изотермический процессах ΔG< 0. Данное уравнение является условием возможности самопроизвольного течения реакции в прямом направлении. Химическая реакция не может протекать самопроизвольно, если энергия Гиббса системы возрастает, т.е. ΔG> 0. Термодинамическое условие возможности самопроизвольного протекания обратной реакции. Если ΔG= 0, то система находится в равновесии, реакция протекает как в прямом, так и в обратном направлениях. Как по ее знаку судят о направлении протекания процесса?  5.Понятие энергии Гиббса образования. Как по знаку энергии Гиббса образования судят об устойчивости веществ? Понятие энергии Гиббса образования. функция состояния системы. Критерий самопроизвольного протекания процесса Энергия Гиббса равна: G = Н – ТS Как по знаку энергии Гиббса образования судят об устойчивости веществ? Если Go < 0, то вещество получено из простых веществ, а разложение на простые вещества невозможно, такие вещества называются термодинамически устойчивыми. Если же Go > 0, то получение из простых веществ невозможно, и наоборот, должно идти разложение сложного вещества на простые. Такие вещества получают из других сложных веществ («косвенным путем») и они являются термодинамически неустойчивыми. Go = 0 – термодинамическое равновесие 6.Химическое равновесие и константа равновесия. Факторы, от которых зависит константа равновесия. Уравнение, связывающее термодинамические параметры и константу равновесия. Химическое равновесие – это не изменяющееся состояние системы, которая содержит вещ-ва способные к взаимодействию. И это предел убыли энергии Гиббса (G=0). Константа равновесия - величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Формула: 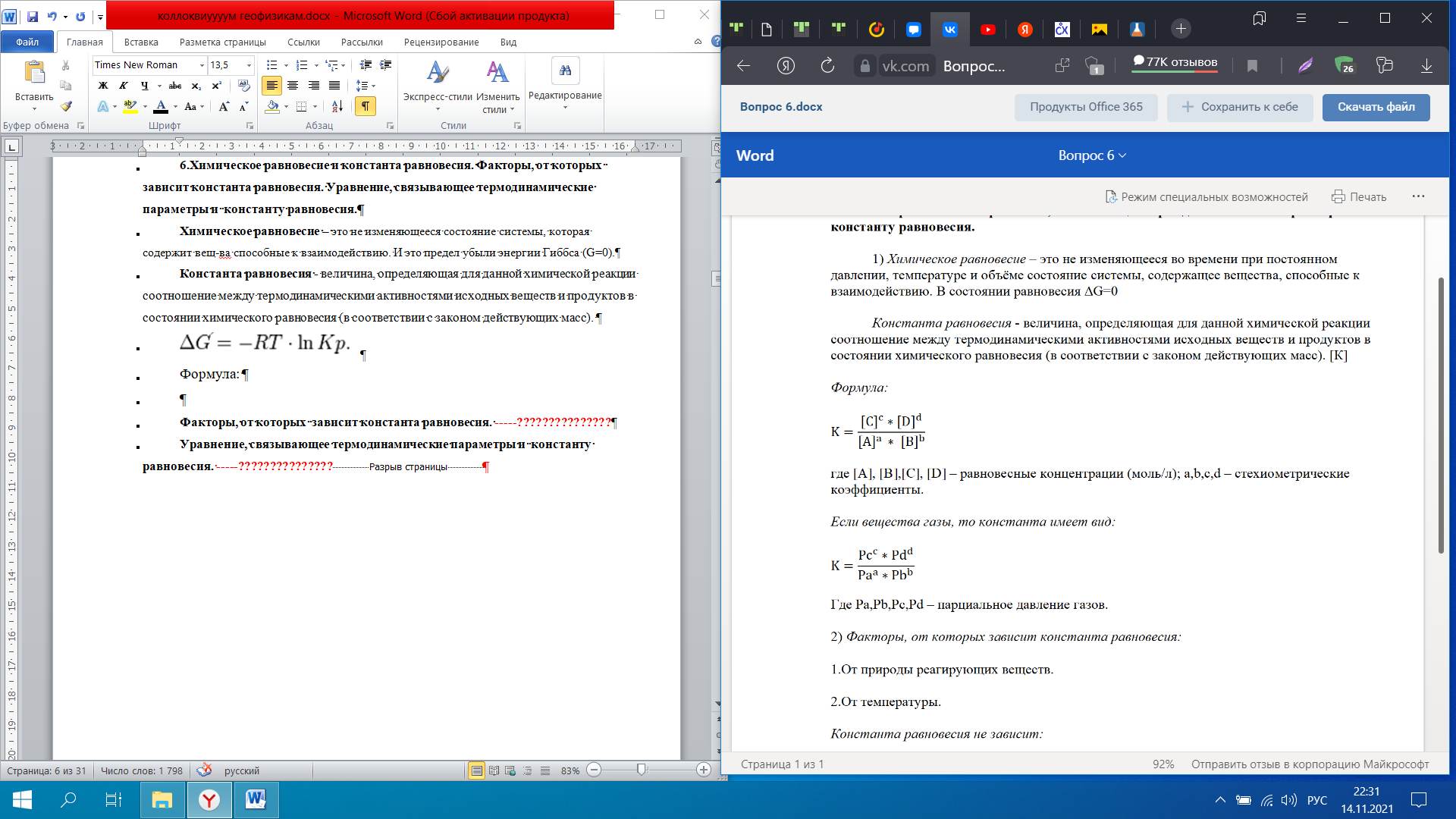 где [A], [B],[C], [D] – равновесные концентрации (моль/л); a,b,c,d – стехиометрические коэффициенты. Если вещества газы, то константа имеет вид: 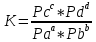 Где Pa,Pb,Pc,Pd – парциальное давление газов. Факторы, от которых зависит константа равновесия. 1.От природы реагирующих веществ. 2.От температуры Константа равновесия не зависит: 1.От концентрации реагирующих веществ. Уравнение, связывающее термодинамические параметры и константу равновесия. Значение константы равновесия связано с основными термодинамическими функциями ( где 7.Принцип Ле-Шателье. На примере реакции рассмотрите направление смещения равновесия при повышении и понижении Р,Т, концентрации исходных веществ и продуктов реакции, при введении катализатора. Принцип Ле-Шателье. - Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие сместится в сторону той реакции, которая компенсирует это воздействие. На примере реакции рассмотрите направление смещения равновесия при повышении и понижении Р,Т, концентрации исходных веществ и продуктов реакции, при введении катализатора. 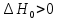 Равновесие сместится вправо, если увеличить концентрацию реагентов N2 и O2; уменьшить концентрацию продукта NO; увеличить температуру; Изменение давления и объёма в данном случае на равновесие не повлияет, т.к. одинаковое количество моль газов с обеих сторон. Катализатор не влияет не смещение равновесия никогда. 8.Понятие скорости химической реакции в гомогенной и гетерогенной системах. Приведите кинетические уравнения для гомогенной и гетерогенной реакций через концентрацию веществ, и парциальные давления. Особенности кинетического уравнения в гетерогенной реакции. Графический способ определения кинетического порядка вщества (нулевого, первого, второго). Понятие скорости химической реакции в гомогенной и гетерогенной системах. Скорость хим.-ой реакции - изменение количества одного из реагентов за промежуток времени в реакционном пространстве. Гомогенные – реакции при которых реагирующие вещ-ва находятся в одном агрегатном состоянии Гетерогенные – реагирующие вещ-ва находятся в разных агрегатных состояниях Приведите кинетические уравнения для гомогенной и гетерогенной реакций через концентрацию веществ, и парциальные давления.  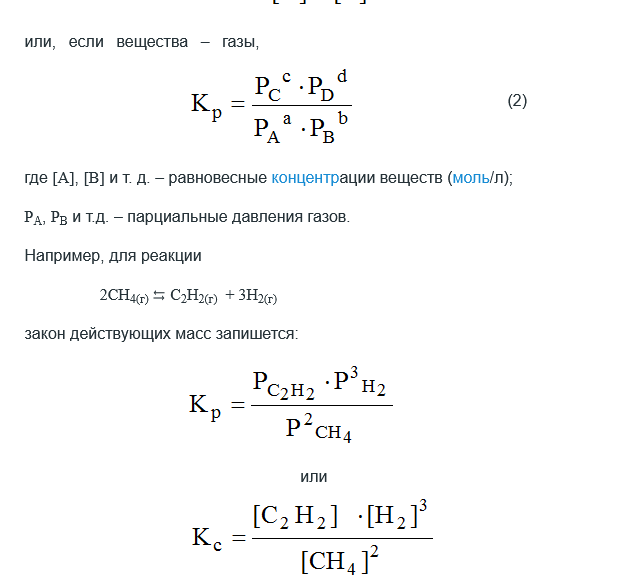 Особенности кинетического уравнения в гетерогенной реакции   Графический способ определения кинетического порядка вщества (нулевого, первого, второго). 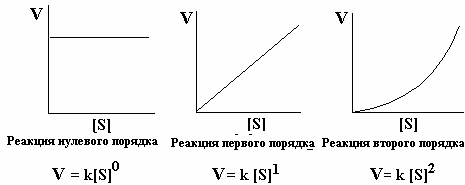 9.Сложные реакции: последовательные, параллельные, цепные, приведите примеры. Чем сложные реакции отличаются от простых? Сложные реакции - реакции, протекающие через несколько последовательных или параллельных стадий  Виды сложных реакций: Виды сложных реакций: . Простые реакции – протекают в одну стадию и их стехиометрическое уравнение правильно отражает реальный ход реакции. Сложные реакции – протекают через несколько стадий. Стехиометрическое уравнение не отражает реального хода процесса и является выражением суммарного результата нескольких стадий . Простые реакции – протекают в одну стадию и их стехиометрическое уравнение правильно отражает реальный ход реакции. Сложные реакции – протекают через несколько стадий. Стехиометрическое уравнение не отражает реального хода процесса и является выражением суммарного результата нескольких стадий10.Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Понятие энергии активации. Энергетический профиль реакции. Уравнение Аррениуса. Расчетный метод определения энергии активации. Влияние температуры на скорость химической реакции – при повышении температуры, большинство реакций протекают быстрее. По правилу Вант-Гоффа: νt2νt1=γt2−t110, где гамма — температурный коэффициент, который показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10 °С. Правило Вант-Гоффа- при повышении температуры на каждые 10 °С скорость большинства реакций увеличивается в 2–4 раза. Понятие энергии активации- это минимальная избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества. Или это минимальная энергия необходимая для запуска реакции Её можно определить графически по уравнению Аррениуса в линейной форме. ln k= - 𝑬𝒂𝑹∗𝟏𝑻 +const или k= 𝑨𝒆−𝑬акт𝑹𝑻 где А – предэкспоненциальный множитель. где kск константа скорости реакции Т- температура R – универсальная газовая постоянная: R=8,314 Дж/моль∙К +Еакт - энергия активации. Энергетический профиль реакции. 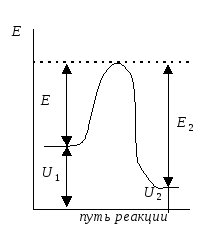 Е1 и Е2 энергии активации прямой и обратной реакций. ΔU=U2 – U1 - тепловой эффект реакции. Энергетический профиль реакции - график зависимости потенциальной энергии от координаты реакции Уравнение Аррениуса. Расчетный метод определения энергии активации.  11. Понятие катализа, гомогенный, гетерогенный катализ, привести формулу для расчета энергии активации в присутствии катализатора. . Катализ - избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов) Катализ гомогенный – катализатор и реагент в одной фазе Катализ гетерогенный – катализатор и реагирующие вещ-ва в разных фазах (твердые и газообразные)  12. Понятие коллигативных свойств растворов неэлектролитов, от чего они зависят? 1 - Закон Рауля, 2 - закон Рауля. Явление осмоса. Осмотическое давление. Понятие коллигативных свойств растворов неэлектролитов Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества. от чего они зависят свойства неэлектролитов -----??????????????? |
