1. Предмет и задачи химической термодинамики. Классификация систем. Типы процессов. Понятие, обозначение, единицы измерения теплового эффекта химической реакции.
 Скачать 5.09 Mb. Скачать 5.09 Mb.
|
|
1 - Закон Рауля Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе: p = p0 · χр-ль p = p0 · nр-ля/(nв-ва + nр-ля), где p — давление пара над раствором, Па; p0 — давление пара над чистым растворителем, Па; χр-ль — мольная доля растворителя. nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль. 2 - закон Рауля Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления. При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются. Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля: ΔTкип = E· mв-ва, ΔTкрист = K·mв-ва, где E—эбулиоскопическая константа, K — криоскопическая константа, mв-ва — моляльность вещества в растворе. Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества: ΔTкип = i·E·mв-ва ΔTкрист = i·К·mв-ва Явление осмоса - процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества Осмотическое давление Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного π = C·R·T, где C — молярная концентрация раствора, моль/м3, R — универсальная газовая постоянная (8,314 Дж/моль·К); T — абсолютная температура раствора. 13. Свойства растворов электролитов, характеристики растворов электролитов: степень и константа электролитической диссоциации. Закон разбавления Оствальда. Свойства растворов электролитов Свойства: · Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. · Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра. · Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы. · По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты). · Для количественной характеристики способности электролита к диссоциации введен параметр «степень диссоциации». Эта величина отражает процент молекул, подвергшихся распаду. Она зависит от: самого вещества; растворителя; концентрации вещества; температуры. · Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли. характеристики растворов электролитов Степень электрической диссоциации. Степень диссоциации электролитов – отношение числа распавшихся молекул к общему числу растворённых. Зависит от концентрации растворов. Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы. (α- степень диссоциации) Константа электролитической диссоциации. Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например: в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10. степень и константа электролитической диссоциации - вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когдакомплекс распадается на составляющие молекулы Закон разбавления Оствальда. С увеличением разведения (уменьшением концентрации электролита) степень диссоциации электролита возрастает. Зная характеристики a и Кдисс можно рассчитать концентрацию ионов в растворах электролитов: См иона = См эл-та∙ a ∙ n для сильного электролита a = 1, поэтому См иона = См эл-та∙ n для слабого электролита a = √ Кдисс/См, поэтому См иона = √ См эл-та∙ Кдисс ∙ n, где n – число ионов данного типа, образовавшихся при диссоциации одной молекулы электролита. Кдисс = a2 ∙ См 14. Типы необратимых ионо-обменных реакций, полные и сокращенные уравнения, направление протекания ионных реакций. Реакции обмена, протекающие в растворе, идут практически до конца, если в результате реакции образуется осадок; газ; слабый электролит ( например вода).  В насыщенном растворе электролита произведение концентрации его ионов есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться, ее наз. произведением растворимости.  15. Ионное произведение воды, водородный и гидроксильный показатели. Привести формулы для расчета рН, рОН. Ионное произведение воды — произведение концентраций ионов водорода Н+ или гидроксидионов OH− в воде или в водных растворах, Константа автопротолиза воды - 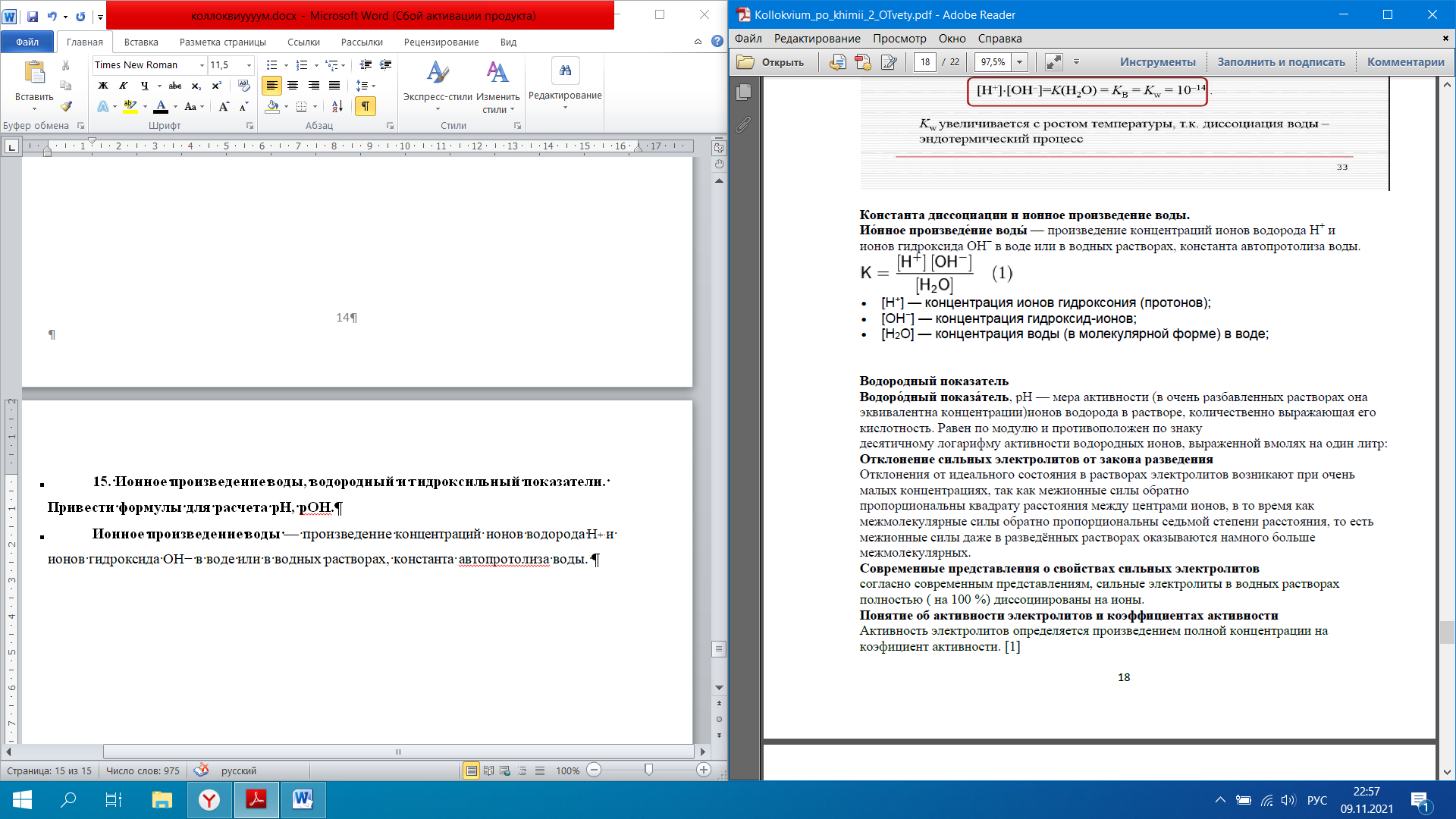  водородный и гидроксильный показатели - pH — мера активности ионов водорода в растворе, количественно выражающая его кислотность Привести формулы для расчета рН, рОН   16. Понятие и типы гидролиза. Смещение равновесия при гидролизе. . Понятие и типы гидролиза. Гидролиз – это химическая реакция, происходящая при взаимодействии какого-либо вещества с водой Типы: гидролиз по аниону Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и сильное основание, например, по аниону гидролизуются метасиликат натрия (Na2SiO3), формиат натрия (HCOONa) гидролиз по катиону Характерен для неорганических солей, в образовании которых участвовали сильная кислота и слабое основание, например, по катиону гидролизуются хлорид железа (III) (FeCl3), сульфат меди (II) (CuSO4). гидролиз и по катиону, и по аниону Характерен для неорганических и органических солей, в образовании которых участвовали слабая кислота и слабое основание. Например, по катиону и аниону гидролизуются сульфит аммония (NH4SO3), сульфид железа (II) (FeS), щелочной гидролиз Характерен только для органических соединений. Вещество гидролизуется под действием щелочей. Пример галогенпроизводных: 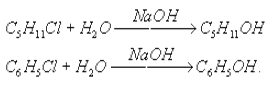 кислотный гидролиз Характерен для органических соединений. Вещество гидролизуется в присутствии сильных минеральных кислот (чаще всего соляной — HCl и серной-H2SO4). Рассмотрим более подробно на примере сложных эфиров: 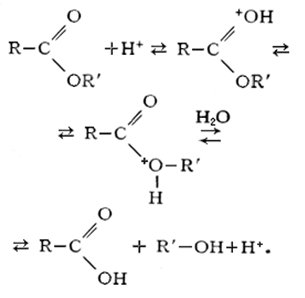 ферментативный гидролиз Такому гидролизу подвергают биополимеры, например, белки и углеводы: на одной из стадий гидролиза для более быстрого расщепления высокомолекулярных соединений в реакционную смесь вводят энзимы (ферменты). Смещение равновесия при гидролизе Добавление ионов водорода (кислоты) – подавляет гидролиз, смещая равновесие гидролиза влево. Добавление щелочи – усиливает гидролиз, смещая равновесие гидролиза вправо. Концентрация соли. Поскольку гидролиз — процесс обратимый, то добавление воды в раствор будет способствовать смещению этой равновесной реакции вправо, т. е. разбавление соли усиливает ее гидролиз. Температура. Все реакции нейтрализации идут с выделением теплоты. Следовательно, гидролиз — процесс эндотермический: соль + вода = продукты гидролиза — Q. Согласно принципу Ле-Шателье повышение температуры для таких процессов способствует смещению равновесия вправо, т. е. усиливает гидролиз соли. 17. Понятие произведения растворимости, Запишите выражение для произведения растворимости и рассчитайте растворимость для любого соединения по выбору. Понятие произведения растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Запишите выражение для произведения растворимости и рассчитайте растворимость для любого соединения по выбору.  18. Понятие электродного потенциала металла. Потенциал водородного электрода. Уравнение Нернста. Ряд напряжений металлов. Как делится ряд по активности металлов? Какие выводы вытекает из электрохимического ряда? Понятие электродного потенциала металла это разность потенциалов, которая возникает на границе раздела фаз металл-раствор при погружении металла в раствор электролита в результате взаимодействия поверхностных ион-атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, Потенциал водородного электрода при стандартных условиях (101 325 Па, 298 К) принят равным 0. Стандартный водородный электрод является эталоном, относительно которого ведется определение электродного потенциала всех существующих электродов. Уравнение Нернстауравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Было выведено немецким физико-химиком Вальтером Нернстом  Ряд напряжений металлов (далее Р. н.) последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод. Поэтому в Р. н. включают и водород, электродный потенциал значение которого принимается равным нулю. Наибольшие отрицательные потенциалы характерны для щелочных металлов (около — 3 в), за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют благородные металлы (около + 1,5 в; численные значения см. в ст. Металлы, табл. 2 и 3). Наиболее распространённые металлы расположены в Р. н. в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au Как делится ряд по активности металлов 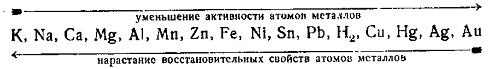 1. В этом ряду металлы расположены в определённой системе, а именно в порядке убывающей активности. Из двух металлов, стоящих рядом, легче отдают электроны атомы металла, стоящего левее. 2. Каждый металл этого ряда вытесняет все следующие за ним металлы из растворов их солей, иначе говоря, каждый металл окисляется ионами всех следующих за ним металлов, например: 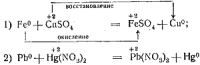 Какие выводы вытекает из электрохимического ряда- последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов E0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me 19. Рассмотрите принцип составления гальванического элемента (ГЭ) на примере ГЭ Даниэля Якоби, его работу, рассчитайте ЭДС. ГЭ – состоит из анода и катода на примере ГЭ Даниэля Якоби - используются медный и цинковый электроды, помещенные в один раствор электролита. Ёмкости разделены перегородкой. Цинковый электрод опущен в раствор ZnSO4.При замыкании цепи гальванического элемента между электродом и раствором электролита идёт реакция окисления: 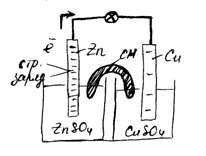 в гальваническом элементе окисление — отдача электронов —происходит на аноде ( цинковый электрод), восстановление — приобретение электронов - на катоде (медном электроде) Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны; таким образом цинковая пластинка заряжается отрицательно и становится анодом. Возникает отрицательный электродной потенциал Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом. Электродный потенциал его будет равен Запись ГЭ: 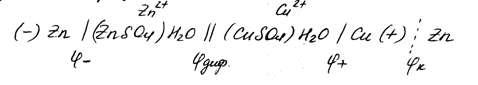 ЭДС — это предельное значение разности потенциалов гальванического элемента, которое наблюдается в условиях равенства нулю тока во внешней цепи и когда устанавливаются все химические и локальные равновесия в фазах и на границы фаз, за исключением границы электрод - электрод. 20. Концентрационный ГЭ, принцип работы и расчет ЭДС привести пример. Концентрационный ГЭ— это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями принцип работы и расчет ЭДС привести пример-  21. Электролиз раствора солей. Привести варианты электролиза растворов в зависимости от активности металлов. Электролиз раствора солей. Электролиз — окислительно-восстановительный процесс, протекающий при прохождении электрического тока через раствор либо расплав электролита Электролиз водных растворов солей осуществить гораздо проще. Для этого необходим подходящий сосуд, электроды и низковольтный источник постоянного тока, в качестве которого подходит даже обычная батарейка. Несмотря на простоту практического осуществления, записать уравнения химических реакций, протекающих при электролизе водных растворов, труднее, чем в случае электролиза расплавов. Объясняется это тем, что при электролизе водных растворов в реакции могут участвовать не только ионы электролита, но и молекулы воды. При электролизе водного раствора соли или щелочи на катоде, в зависимости от активности восстанавливающегося металла, возможны следующие реакции: Восстановление катионов металла (Men+): Men+ + nē Me Восстановление водорода из воды: 2Н2О + 2ē Н2↑ + 2ОН Легче всего восстанавливаются наименее активные металлы, расположенные в ряду активности после водорода. Наиболее активные металлы являются сильными восстановителями, поэтому обратный процесс – восстановление активных металлов из соединений осуществить сложно. В связи с этим, при электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода. Для металлов со средней химической активностью, расположенных в ряду активности после алюминия, на катоде происходят одновременно две реакции – образование водорода и выделение металла. В общем виде схема катодных процессов электролиза водных растворов солей выглядит следующим образом: Схема катодных процессов: 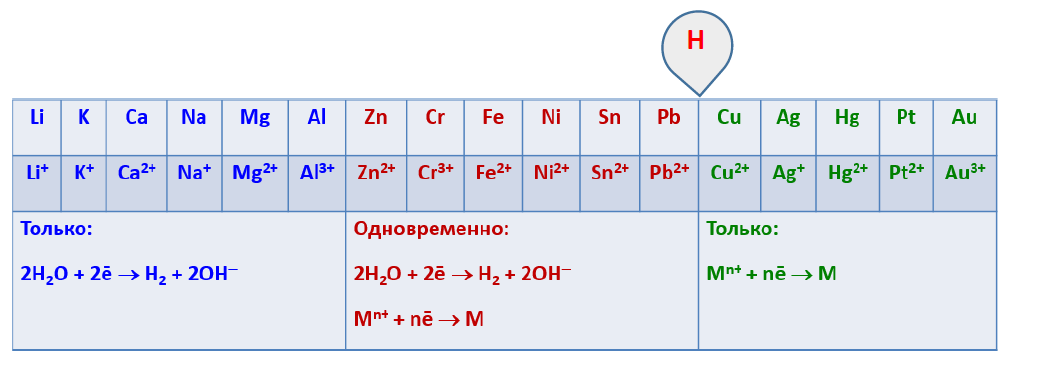 При электролизе водного раствора соли или щелочи на аноде, в зависимости от природы аниона, возможны следующие реакции: Окисление анионов (Ann– ), образующихся при диссоциации соли или щелочи: Ann– nē An Для щелочи: 4ОН– – 4ē О2↑ + 2Н2О Окисление воды: 2Н2О 4ē О2↑ + 4Н Схема анодных процессов: 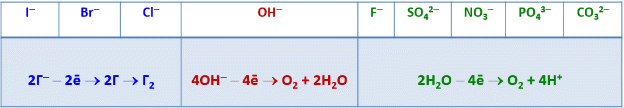 Отсюда следует, что при электролизе растворов галогенидов (кроме фтора) на аноде происходит выделение галогена. При электролизе растворов щелочей и солей кислородсодержащих кислот на аноде выделяется кислород. Электролиз раствора хлорида меди CuCl2 Медь располагается в ряду активности после водорода, поэтому на катоде выделяется металлическая медь: Катод(- ): Cu2+ + 2ē=Cu На аноде образуется хлор: Анод(+): 2Cl - 2ē= 2Cl = Cl2↑  Суммарное уравнение: CuCl2 =электролиз= Cu + Cl2↑ Суммарное уравнение: CuCl2 =электролиз= Cu + Cl2↑ |
