1. Предмет и задачи химической термодинамики. Классификация систем. Типы процессов. Понятие, обозначение, единицы измерения теплового эффекта химической реакции.
 Скачать 5.09 Mb. Скачать 5.09 Mb.
|
|
Привести варианты электролиза растворов в зависимости от активности металлов. Электролиз раствора NaCl В отличие от электролиза расплава хлорида натрия, в процессе электролиза его водного раствора участвуют молекулы воды. Натрий располагается в ряду активности перед алюминием, поэтому на катоде восстанавливаются не катионы натрия, а вода, при этом выделяется водород и образуются гидроксид-ионы: Катод(-): 2H2O + 2ē = H2↑+ 2OH На аноде выделяется хлор: Анод(+): 2Cl+2ē = 2C=Cl2↑ Суммарное уравнение: 2NaCl + 2H2O=электролиз= H2↑ + 2NaOH + Cl2↑ Таким образом, в процессе электролиза водного раствора хлорида натрия на аноде выделяется хлор, на катоде – водород, а в растворе образуется гидроксид натрия. Эта реакция используется в промышленности для получения гидроксида натрия и хлора. При промышленном осуществлении электролиза водного раствора хлорида натрия с целью получения гидроксида натрия и хлора катодное и анодное пространства электролизера разделяют мембраной либо пористой керамической перегородкой (диафрагмой) во избежание взаимодействия продуктов электролиза между собой. Электролиз раствора CuSO4 Медь располагается в ряду активности после водорода, поэтому на катоде восстанавливается металл: Катод(-): Cu^2+ + 2ē = Cu На аноде протекает окисление воды, выделяется кислород и образуются катионы водорода: Анод(+): 2H2O 4ē O2↑ + 4H+ Суммарное уравнение: 2CuSO4 + 2H2O=электролиз=2Cu + 2H2SO4 + O2↑ Таким образом, при электролизе водного раствора медного купороса на катоде выделяется медь, на аноде – кислород, в растворе образуется серная кислота. 22. Виды анодов. Электролиз раствора соли с растворимым анодом. Виды анодов Никелевый анод Фосфорно-медный анод Электролитический медный анод Бескислородный медный анод Цинковый анод Латунный (желтый) анод Оловянный анод Платинированный титановый анод Графитовый (угольный) анод Кадмиевый анод Свинцовый анод Электролиз раствора соли с растворимым анодом. Пример 1. Электролиз водного раствора соли CuCl2 с растворимым анодом: Катод (-): Cu-анод (+): Сu2+ + 2ē → Cu0 Сu0 - 2ē → Cu2+ Таким образом, происходит как бы рафинирование медного анода: он растворяется, примеси остаются в анодном пространстве, а чистая медь осаждается на катоде. Хлор-анион при этом не окисляется, а накапливается в анодном пространстве. Пример 2. Электролиз водного раствора соли KCl с Cu-анодом: Cu-анод (+): Сu0 - 2ē → Cu2+ На катоде в первоначальный момент начинает восстанавливаться водород из воды, но появление Cu2+ в растворе делает две реакции катодного восстановления конкурентными: К(-): 2Н2О + 2ē → Н2↑+ 2НО- Е0 = - 0,828 В Сu2+ + 2ē → Cu0 Е0 = + 0,34 В В результате преимущественно протекает та, которая характеризуется более высоким потенциалом, т.е. восстановление Сu2+ до Cu0. Таким образом, и в этом случае будет происходить растворение Cu-анода: Сu0 - 2ē → Cu2+, а на катоде образовавшиеся катионы меди будут восстанавливаться: Сu2+ + 2ē → Cu0. Соль KCl нужна лишь для увеличения электропроводности раствора, а непосредственного участия в окислительно-восстановительных процессах она не принимает. 23. Закон Фарадея, привести понятия: выход по току, напряжение разложения, перенапряжение. Закон Фарадея – масса электролита подвергающегося превращению при электролизе, а также mобразованная на электроде в-ва прямо пропорционально количеству электричества, прошедшего через раствор или расплав электролита. M = 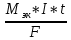 I – сила тока F- Постаянная Фарадея = 96500 Кл/моль t- время M – масса выделившегося или подвергшегося превращению вещества (г) : выход по току - это масса вещества, образовавшегося в результате электролиза при пропускании через раствор тока определенной силы тока в течение определенного времени. Рассчитывается с помощью закона Фарадея напряжение разложения, перенапряжение Напряжение разложения электролита - минимальное напряжение между электродами, при котором начинает протекать электролиз; оно должно быть как минимум равно разности электродных потенциалов, т.е. потенциалов разрядки анионов ( на аноде) и катионов ( на катоде) из растворов электролитов Перенапряжение - Часто реально необходимый потенциал разложения электролита оказывается больше теоретической величины. Эта разность называется перенапряжением η = ϕ(р) - ϕ(i) где ϕ(р) – равновесный потенциал, ϕ(i) – потенциал при протекание тока. 24. Понятие коррозия, химической и электрохимической, привести пример механизма электрохимической коррозии с кислородной деполяризацией. . Понятие коррозия - это естественный физико-химический процесс разрушения металлов и их сплавов, под влиянием внешней среды химической и электрохимической коррозия – Химическая коррозия – взаимодействие металлов с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают в одной стадии 4Al+3 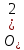 = 2 = 2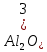 Электрохимическая коррозия металлов – это процесс разрушения металлов в (чаще всего влажной среде) среде различных электролитов, который сопровождается возникновением внутри системы электрического тока. привести пример механизма электрохимической коррозии с кислородной деполяризацией. Водородная деполяризация Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде: 2H++2e— = H2 разряд водородных ионов 2H3O++2e— = H2 + 2H2O Кислородная деполяризация Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде: O2 + 4H++4e— = H2O восстановление растворенного кислорода O2 + 2H2O + 4e— = 4OH— 25. Привести пример механизма с водородной деполяризацией. Что такое протекторная защита? Наиболее распространенными деполяризаторами являются молекулы растворенного в воде кислорода (О2), сами молекулы воды (Н2О) и катионы водорода (Н+ ). Как правило, в коррозионной среде присутствуют все три деполяризатора. Какой из них будет определять протекание катодного процесса, зависит от соотношения их концентраций. Различают два вида процессов деполяризации – с поглощением кислорода (кислородная деполяризация) и с выделением водорода (водородная деполяризация). В деаэрированной (освобожденной от кислорода воздуха, например, кипячением) нейтральной и щелочной среде (pH > 7) деполяризация протекает с участием воды: 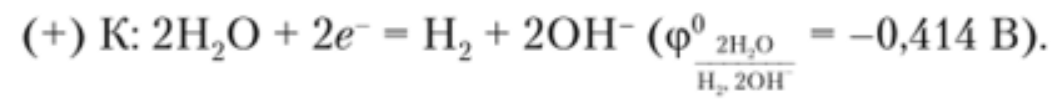 В деаэрированной (освобожденной от кислорода воздуха например, кипячением) кислой среде (pH < 7) деполяризация протекает с участием катионов водорода: 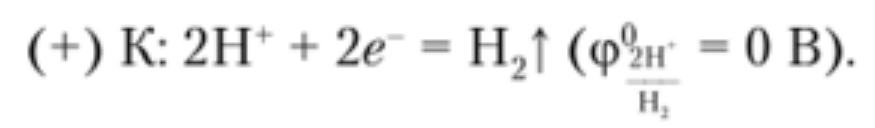 Уравнение для расчета электродного потенциала водородной деполяризации в обоих случаях имеет вид: 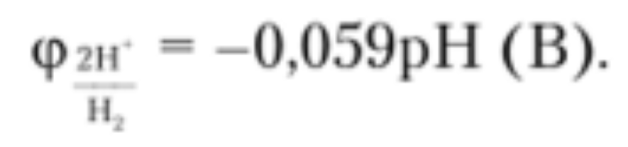 В коррозионных процессах, разрешенных термодинамически (Д(7корр < 0), в аэрированных средах возможно одновременное участие всех трех деполяризаторов: кислорода, водорода и воды. Интенсивность каждого деполяризационного процесса будет определяться соотношениями концентраций всех участвующих в процессе веществ. Количественно оценить вклад каждого из процессов можно но величине ЭДС гальванических пар конкурирующих катодных процессов при одном и том же анодном процессе. Протекание коррозионных процессов в замкнутых средах может существенно изменять состав электролита и механизм деполяризационных процессов. 26. Классификации элементов по распространенности. (по этому билету советую, дождаться теории от Перевезенцевой, т.к информация в интернете очень не понятная и странная) Гольдшмидтовская классификация элементов: Атмофильные элементы - H,N и инертные газы, для них характерно нахождение в элементарном состоянии (кроме Н) и скоплеение в атмосфере Халькофильные элементы - обладают сродством к сере. (Ag, As, Bi, Cd, Cu, Ga, Hg, In, Pb, Po, S, Sb, Se, Te, Tl, Zn.) Литофильные элементы - Обладают сродством к силикатным минералам и расплавам. (Al, At B, Ba, Be, Br, Ca, Cl, Cr, Cs, F, I, Hf, K, Li, Mg, Mn, Na, Nb, O, Rb, Sc, Si,Sr, Ta, Th, Ti, U, V, Y, Zr, W, Лантаноиды.) Сидерофильные элементы - Обладают сродством к железу. (Au, C, Co, Fe, Ge, Ir, Mo, Ni, Os, P, Pd, Pt, Re, Rh, Ru, Sn) - 27. Закономерности изменения степеней окисления элементов в таблице Менделеева. степень окисления возрастает от меньшей группы к большей. Высшая степень окисления равна номеру группы элемента 28. Закономерности изменения кислотно-основных свойств соединений в таблице Менделеева. Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные - возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные - ослабевают. Исключение: В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств Если менее прочна связь Э−О («Э» - элемент), то гидроксид проявляет основные свойства, если О−Н − кислотные. Прочность связей Э−О и О−Н в гидроксиде зависит от распределения электронной плотности в цепочке Э−О− H. На последнюю наиболее сильно влияют степень окисления элемента и ионный радиус. Увеличение степени окисления (слева направо увеличивается) элемента и уменьшение его ионного радиуса, вызывают смещение электронной плотности к атому  29. Классификация простых веществ, общая характеристика, их свойства. 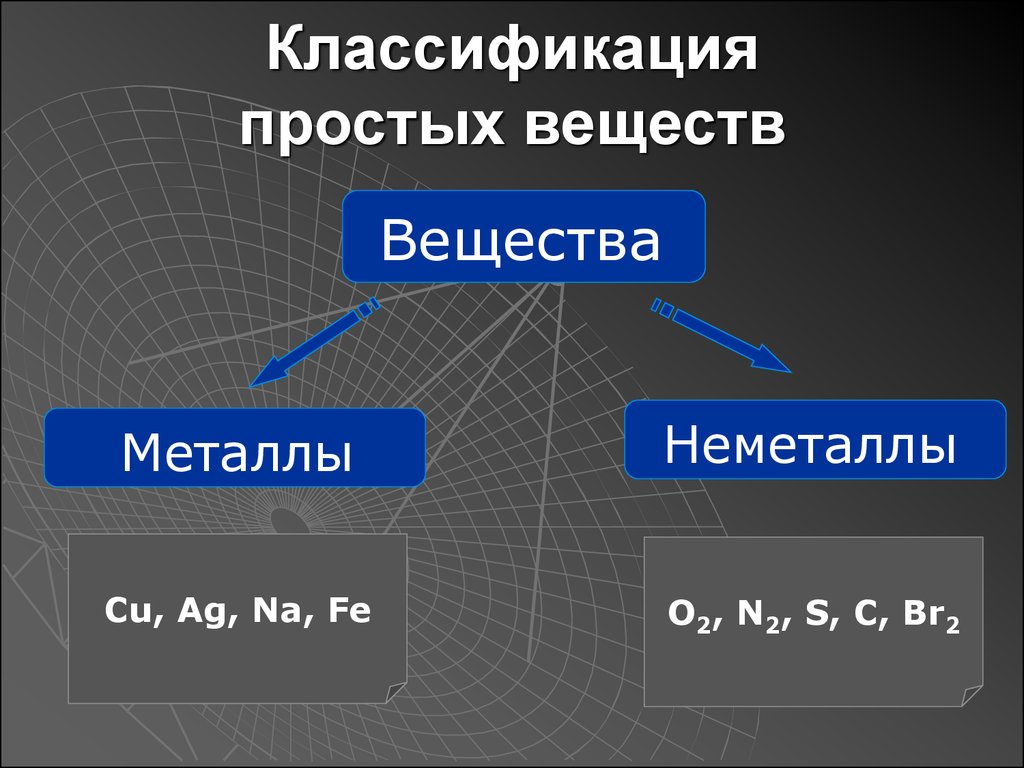 Классификация простых веществ. Все простые вещества можно разделить на металлы и неметаллы, поскольку их свойства существенно отличаются. Металлы обладают металлическим блеском, высокой тепло- и электропроводностью, пластичны, проявляют восстановительные свойства. Неметаллы обладают очень разными физическими и химическими свойствами, но, как правило, в твердом состоянии хрупкие, плохо проводят электрический ток и тепло. Граница между металлами и неметаллами условна. Существуют вещества, обладающие свойствами как металлов, так и неметаллов. Например, серый мышьяк имеет металлический блеск и электрическую проводимость (рис. 1), а другая аллотропная модификация – желтый мышьяк – имеет чисто неметаллические свойства. Общая характеристика, их свойства. Физические свойства металлов: Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов. Для металлов характерен ряд свойств: твердость (кроме ртути, которая представляет собой жидкость); металлический блеск; проводимость электрического тока и тепла; пластичность. Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов. Физические свойства неметаллов: Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла. Для неметаллов характерен ряд свойств: хрупкость (неметаллы нельзя ковать); отсутствие блеска; непроводимость электрического тока и тепла.  Красные ячейки – неметаллы, синие – металлы. Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.  30.Закономерности изменения кристаллических структур простых веществ.   Закномерности Большинство простых в-в – твердые вещ-ва Ковалентная связь при 4-х валентных электронах Металлическая – при 1,2,3-х валентных электронах Структура неметаллов: Зависит от положения в ПСХЭ 4-я группа – алмазоподобная кристалическая решетка 5-я группа – гофрированные решетки, сложные структуры 6-я группа – зигзагообразная и линейная структура 7-я группа – островная стрктура 8-группа – структура при низких температурах состоящая из отдельных молекул, объединённые силами Вандервальса – цепные структуры |
