1. предмет, задачи, методы и место биохомии среди других биологических дисциплин
 Скачать 1 Mb. Скачать 1 Mb.
|
12 (8). Способы разделения и очистки белков.Получение белков из биологического материала (тканей, органов) требует такие последовательные стадии как: дробление биологического материала и разрушение клеточных мембран; фракционирование органелл, содержащих те или иные белки; перевод белков в растворённое состояние; разделение смеси белков на индивидуальные белки. Для разрушения биологического материала используют методы: создание однород. структуры в ткане, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком. Создание однород. структуры в ткане- определ. ткань помещают в сосуд с пестиком, пестик вращается и измельчает и растирает ткань о стенки сосуда. Замораживания и оттаивания ткани- в результате образующиеся кристаллы льда разрушают оболочки клеток. После разрушения ткани нерастворимые части осаждают центрифугированием. Удаление из раствора небелковых веществ. Нуклеиновые кислоты, липиды и др. небелковые вещества можно удалить из раствора, используя их свойства. Липиды легко удаляются из р-ра добавлением орган-ких растворителей, например ацетона. Методы очистки белков. Очистка белков от других белков, находящихся в р-ре, полученном из данной ткани. Т.к. белки обладают лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах. Также нужно учитывать термостабильность и устойчивость в кислых р-ах. Сначала нужно удалить из р-ра основную массу балластных белков, которые значительно отличаются от выделяемого белка свойствами. 13 (26). Денатурация и ренатурация. Молекулярная гибридизация нуклеиновых кислот. Денатурация свойственна макромалекулам, имеющим пространственную организацию. Она может быть вызвана нагреванием, воздействием химических веществ, которые нарушают Ван-дер-Вальсовы взаимодействия, разрывают водородные связи, стабилизирующие вторичную и третичную структуры. При нагревании происходит разделение двунитевой ДНК на одиночные полинуклеотидные цепи. При медленном охлаждении они снова воссоединяются по принципу комплементарности, образуются двунитевая полинуклеотидная цепь ДНК – этот процесс называется ренатурацией и при быстром охлаждении она не происходит. Денатурация бывает полной и частичной, обратимой и необратимой. Необратимой будет при разрушении фосфодиэфирных связей между нуклеотидами. Гибридизация нуклеиновых кислот. Все клетки одного организма содержат абсолютно одинаковые молекулы ДНК. Поэтому, если из клеток разных тканей выделить ДНК, денатурировать её и разделить цепи, а потом смешать одноцепочечные молекулы, то одноцепочечные молекулы, выделенные из разных клеток могут полностью комплиментарно спариться- образовать совершенный гибрид ДНК-ДНК.В том случае, если смешиваются ДНК разных организмов, то степень их комплим. спарив. будет зависеть от степени родстатва организмов или видов-образуются несовершенные гибриды ДНК-ДНК. 14 (12).Понятие о ферментах. структурно-функциональная организация ферментов. Ферменты-белки обладающие каталит. активностью, способны ускорять биохим-е р-ции. По своему строению могут быть простыми и сложными белками. Простетическую (небелковую) группу ферментов называют коферментом, а белковую — апоферментом. Апоферментная и коферментная группы сами по себе неактивны, лишь соединенные друг с другом более или менее прочными связями они образуют функционально активный комплекс, получивший название холофермента. Апоферментом определяется специфичность фермента (способность его взаимодействовать только с определенным веществом (субстратом) или группой веществ); тогда как коферментная группа часто выступает в роли акцептора тех или иных отщепляемых от субстрата атомов или функциональных групп, а в некоторых случаях выполняет и каталитическую функцию. Структурно-функц. организация ферментов. Центры ферментов: молекула фермента взаимодействует с S не всей своей поверхностью, а определенными участками. На поверхности фермента различают: Активный центр (это участок фермента, который взаимодействует с S. Наиболее часто в состав актив. центров входят функциональные группы таких аминокислот: ОН – группы серина, треонина, тирозина; SН – группы цистеина; NН – группа гистидина; СООН – группы глутамата и аспартата;NН2 – группы аргинина и лизина. В сложных ферментах в активный центр входят кофакторы (небелковые компоненты): простетические группы, коферменты, ионы металлов. Активный центр является комплементарным к строению S, имеется соответствие Е и S как “ключа и замка”. В структуре активного центра выделяют: участок, который связывается с S: контактный (“якорный”) участок; каталитический участок, в состав которого входят химические группы, принимающие непосредственное участие в преобразовании S. Кроме активного центра, некоторые ферменты имеют дополнительный, регуляторный, аллостерический центр, с которым взаимодействуют аллостерические регуляторы (эффекторы, модуляторы). Аллостерические эффекторы могут быть позитивными (активаторами), которые повышают каталитическую активность фермента или негативными (ингибиторами), которые ее снижают. Активный и аллостерический центры локализуются на разных субъединицах фермента. При взаимодействии аллостерического центра с эффекторами происходят конформационные изменения активного центра фермента, что приводит к увеличению или снижению его активности. Ферменты, имеющие аллостерический центр, называются регуляторными. 15 (16). Классификация и номенклатура ферментов. Все ферменты делятся на 6 классов по типу катализируемой реакции. Каждый класс делится на несколько подклассов. Классы:1.Оксидоредуктазы; 2.Трансферазы; 3.Гидралазы; 4.Лиазы; 5.Изомеразы; 6.Лигазы (синтетазы).1.Оксидредуктазы – ферменты, катализирующие ОВР: а) аэробные дегидрогеназы (оксидазы). Отщепляют водород от субстрата и переносят его на молекулу кислорода, б) анаэробные дегидрогеназы – катализируют перенос водорода от субстрата на любой другой акцептор, кроме кислорода, в) цитохромы – это ферменты, переносящие электроны. г) пероксидазы – гемсодержащие оксидоредуктазы. Они отщепляют водород от субстрата и переносят его на Н2О22. Трансферазы – ферменты, переносящие группы атомов от одного субстрата к другому. При этом один субстрат донор, а другой – акцептор.- аминотрансферазы, переносят NH2;- метилтрансферазы, переносят CH3;- фосфотрансферазы, переносят PO3H2;- ацилтрнсферазы.3. Гидролазы – ферменты, катализирующие разрыв одинарных связей с участием воды, присоединяемой по месту разрыва связи(они принимают участие в реакциях гидролиза). Все ферменты пищеварительного тракта относятся к гидролазам: эстеразы – разрывают сложно-эфирную связь; пептидазы – разрывают пептидную связь; гликозидазы – разрывают гликозидные связи. 4. Лиазы - ферменты осуществляют разрыв углеродных связей без участия воды. Выделяют: декарбоксилазы – катализируют отщепление CO2. альдолазы – катализируют расщепление связи между атомами углерода. гидратазы – разрыв двойной связи с присоединением воды по месту разрыва двойной связи. Ферменты, отщепляющие воду – реакция дегидратации. При этом образуется двойная связь. 5.Изомеразы – ферменты, катализирующие реакции изомеризации и обеспечивающие внутримолекулярную перестройку. 6.Лигазы (синтетазы) – катализируют образование более сложных вещ-в из более простых. При этом требуется энергия из вне. Обязательно участие АТФ или других. Номенклатура ферментов: 1)Тривиальная номенклатура – названия случайные, без системы и основания, например трипсин, пепсин, химотрипсин.2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактатдегирогеназа. 3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.4) Все ферменты имеют цифровой шифр, например ЛДГ - 1.1.1.27.Первая цифра говорит о типе катализируемой реакции, указывая на номер класса. Вторая уточняет действие фермента – номер подкласса. Третья указывает природу разрываемой связи в молекуле субстрата - подподкласс. Четвёртая – порядковый номер фермента. 16 (13). Общие принципы ферментативного катализа. Отличие ферментов от неорганических катализаторов. В основу современной теории о ферм.катализе положена теория Михаэлеса и Ментена. Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратного комплекса. По этой теории весь процесс катализа можно разделить на 3 этапа:1)образование фермент-субстратного комплекса. Происходит диффузия субстрата к ферменту и субстрат, в соответствии с принципом комплиментарности, связывается с активным центром фермента. Реагенты связаны водородными, ионными, гидрофобными, в некоторых случаях и ковалентными связями. Эта стадия непродолжительна, зависит от концентрации субстрата и от скорости диффузии его к активному центру. Энергия активации исходных веществ при этом изменяется незначительно. На этой стадии проявляется эффект концентрирования субстрата на поверхности фермента – эффект ориентации. 2)происходит последовательное преобразование первичного фермент-субстратного комплекса в 1 или несколько активированных. Эта стадия медленная, ее длительность зависит от величины энергии активации данной реакции. В эту стадию происходит разрыв старых связей и образование новых, при этом энергия активации значительно снижается. 3)отделение продуктов от активного центра фермента и диффузия их в окружающую среду. Эта стадия непродолжительна, ее скорость определяется скоростью диффузии продуктов в окружающую среду. Отличия между ферментами и неорг. катализаторами (общие свойства ферментов): сложность строения; высокая мощность действия; специфичность; это вещ-ва с регулируемой активностью; действуют в мягких условиях организма. 17. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, факторов среды (рН,температуры). Число молекул S, претерпивающих изменение в течение минуты, в расчете на единицу веса E при оптимальных условиях его действия называется молекулярной активностью E. При увеличении кол-cтва E скорость ферментативной р-ции повыш-ся до некоторого предела, который характеризуется количеством S, доступным действию E. Зависимость скорости ферментативной реакции от концентрации S может быть описана уравнением: 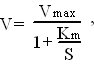 где V -скорость ферментативной реакции, Vmax - максимальная скорость ее при бесконечно большой концентрации субстрата, S - концентрация субстрата в моль/л, Кm - константа Михаэлиса ( она соответствует концентрации субстрата, при которой скорость реакции равна половине максимальной). Зависимость скорости от кол-ва фермента. При условии избытка S скорость р-ции пропорциональна кол-ву E, но при избыточном количестве E прирост скорости реакции будет снижаться, поскольку уже не будет хватать S. Зависимость скорости реакции от температуры. Скорость ферментативных реакций зависит от температуры: при повышении температуры на каждые 10 °С скорость увеличивается примерно вдвое (правило Вант-Гоф-фа). Однако для ферментативных реакций это правило справедливо лишь в области низких температур — до 50-60 °С. Зависимость скорости реакции от рН. Изменение рН приводит к изменению степени ионизации ионогенных групп в активном центре, а это влияет на сродство S к активному центру и на каталитический механизм. Кроме того, изменение ионизации белка вызывает конформационные изменения молекулы E. Зависимость скорости реакции от времени. По мере увеличения времени инкубации скорость реакции снижается .Это может происходить вследствие уменьшения концентрации S, увеличения скорости обратной реакции (в результате накопления продукта прямой реакции), ингибирования E продуктом реакции, денатурации фермента. При количественном определении E и кинетических исследованиях измеряют начальную скорость реакции. 18. Уравнение Михаэлиса- Ментен. Зависимость скорости ферментативной реакции от концентрации субстрата. В 1913 г. Михаэлис и Ментен создали теорию ферментативной кинетики, исходя из того, что фермент (Е) вступает во взаимодействие с субстратом (S) с образованием промежуточного фермент субстратного комплекса (ЕS), который далее распадается на фермент и продукт реакции по уравнению:  19 (15). Механизм действия ферментов. Специфичность действия ферментов(стереохимическая, реакционная и субстратная: абсолютная, групповая). Структура и роль каталитического центра. 1. Происходит активация фермента путем связывания с аллостерическим центром регуляторных веществ это приводит к изменению конформации активного центра фермента и увеличению его способности связывать молекулу субстрата. 2. происходит 'узнавание' ферментом своего S. 3. происходит формирование неактивного фермент-субстратного комплекса за счет образования гидрофобных и водородных связей между радикалами аминокислотных остатков субстратного центра и соответствующими группировками в молекуле S. 4. образуется активный фермент-субстратный комплекс. При этом происходит хим. преобразование S с участием каталитического центра и кофермента. В результате этого молекула S меняет свою пространственную конфигурацию, в ней происходит перераспределение энергии и уменьшается прочность связей. 5.фермент-субстратный комплекс становиться нестабильным и затем преобразуется в комплекс фермент-продукт, который распадается на продукты реакции и фермент. Фермент из реакции выходит в неизменном виде.-Специфичность по отношению к субстрату – это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами. Различают 4 вида субстратной специфичности ферментов:1. Абсолютная специфичность – способность фермента катализировать превращение только одного S. .2. Относительная специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи. 3. Относительная групповая специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав S. 4. Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера. Реакционная специфичность фермента -это специфичность фермента к определённой реакции. Каталитический центр - это та область актив. центра фермента, которая непосредственно участвует в хим. преобразованиях S. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Если фермент явл-ся сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. Образование каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в его входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот. 20 (14). Кофакторы и коферменты, их значение для деятельности ферментов. Коферментные функции витаминов. Коферменты — это орган. вещ-ва аминокислотной природы, непосредственно участвующие в катализе в составе фермента. Простые, относятся обычно к классу гидролаз, практически все гидролитические ферменты состоят только из аминокислот. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками(для каталитической активности многих ферментов кроме белковой части необходим второй компонент-кофактор). Есть каталитически актив. фермент вместе с кофактором-холофермент. Это каталитически актив. фермент, состоящий из белковой и небелковой части кофактора. Белковая часть холофермента-апофермент. У холофермента ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью. Оказывается апофермент резко повышает каталитическую активность кофактора, а кофактор в свою очередь стабилизирует белковую часть, делает ее более устойчивой и менее уязвимой к денатурирующим агентам. Кофакторы - это некоторые полипептиды, группы нуклеотидов и их производные и, наконец, ионы некоторых металлов. Классификация: 1) Кофакторы жирного ряда (глютатион, липоевая кислота, долихол фосфат). 2 Кофакторы алифатического ряда (убихинон или коэнзим Q). 3) Кофакторы гетероциклического ряда. 4) не содержащие витаминов - геминовые кофакторы. Основой этих кофакторов является гемовое железо. 5) Кофакторы-нуклеотиды. Коферментные функции витаминов. Ф-ции водорастворимых вытаминов-образование коферментов и простетич. групп ферментовитамины. Связанные с разл. витаминами ферменты принимают участие во мн. важнейших процессах обмена веществ: энергетич. обмене, биосинтезе и превращениях аминокислот, жирных кислот, пуриновых и пиримидиновых оснований. Некоторые жирорастворимые витамины также выполняют коферментные функции. Ф-ции др. жирорастворимых витаминов: витамин Е стабилизирует и защищает ненасыщ. липиды биол. мембран от окисления; витамин D необходим для осуществления транспорта ионов Са и остатков фосфорной кислоты через клеточные барьеры в процессах их всасывания в кишечнике, реабсорбции в почках и мобилизации из скелета. 21 (19). Регуляция активности ферментов. Ковалентная модификация. Аллостерическая регуляция. Каталитические и регуляторные центры. Понятие об иммобилизированных ферментов и их применение в медицине. Ферменты-регулируемые катализаторы.В качестве регуляторов могут выступать метаболиты, яды. Различают: активаторы – вещ-ва, увеличивающие скорость реакции; ингибиторы – вещ-ва, уменьшающие скорость реакции. Активация ферментов. Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами S. Активация с помощью металлов протекает по различным механизмам: а)металл входит в состав каталитического участка активного центра; б)металл с S образуют комплекс; в)за счет металла образуется мостик между S и активным центром фермента.S также являются активаторами. При увеличении концентрации S скорость р-ции повышается. По достижению концентрации насыщения S эта скорость не изменяется. Если активатор связывается вне активного центра фермента, то происходит ковалентная модификация фермента: 1) частичный протеолиз. 2) фосфорилирование - дефосфорилирование |
