Контрольная по аналитической химии. аналитическая химия. 1 Применение в медицине соединений катионов
 Скачать 195.56 Kb. Скачать 195.56 Kb.
|
|
Гидрокарбонат – ион CO3 1. С насыщенным раствором сульфата магния (гф) с образованием белого осадка гидроксокарбоната магния. Гидрокарбонат-ионы образуют осадок только при кипячении. CO32- + 2 H2O + 2 MgSO4 2 С фенолфталеином (ГФ). Раствор карбоната (1:10) при прибавлении 1 капли раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбонатов). CO3 2- + H/OH HCO3- + H/OH HCO3- + H/OH Обнаружение СО32- и HCO3- -ионов при совместном присутствии СО32- + Са2+ 2 HCO3- + Са2+ Ca(HCO3)2 + 2 NH4OH Методика: К 1 см3 анализируемого раствора, содержащего СО32- и НСО3-ионы, прибавляют избыток раствора хлорида кальция, осадок карбоната кальция отделяют центрифугированием и отбрасывают, центрифугат проверяют на полноту осаждения карбонат-ионов, если полнота осаждения достигнута, то добавляют водный раствор аммиака, появление белого осадка указывает на наличие гидрокарбонат-ионов. Реакции тиосульфат-иона S2O3 2- Тиосульфат-ион S2O3 2- - анион тиосерной кислоты H2S2О3 . Тиосерная кислота неустойчива и в свободном виде не существует. Соли щелочных металлов этой кислоты устойчивы, однако в водных растворах подвергаются гидролизу. Тиосульфаты являются сильными восстановителями. Хлорид бария ВаСl2 с тиосульфат-ионом образует белый осадок тиосульфата бария: Na2S2O3 + BaCl2 → ВаS2Оз↓ + 2NaCl S2O3 2- + Ba2+→ ВаS2Оз↓ Осадок растворяется в кипящей воде и в разбавленных минеральных кислотах (кроме серной). ВаS2Оз легко образует пересыщенный раствор. Для ускорения выпадения осадка можно потереть внутреннюю стенку пробирки стеклянной палочкой. Минеральные кислоты вытесняют тиосерную кислоту из ее солей: Na2S2O3 + 2HCl → H2S2O3 + 2NaCl Тиосерная кислота в момент образования разлагается: H2S2O3 → S↓ + SO2↑+ Н2О Образовавшаяся сера вызывает помутнение раствора. Эта реакция позволяет обнаружить тиосульфаты в присутствии сульфитов, так как сернистая кислота при разложении выделяет только SO2 , а серы не образуется. Реакция является фармакопейной. Нитрат серебра AgNO3 образует с растворимыми тиосульфатами белый осадок, который быстро становится желтым, затем бурым и, наконец, черным вследствие перехода в сульфид серебра: Na2S2O3 + 2AgNO3 → Ag2S2O3↓+ 2NaNO3 Ag2S2O3 + H2O → Ag2S↓ + H2SO4 Осадок тиосульфата серебра Ag2S2O3 растворим в избытке тиосульфата натрия с образованием комплексных ионов [Ag(S2O3 )2 ] 3- . Поэтому при проведении этой реакции необходимо добавлять избыток AgNO3 . Реакция характерна для тиосульфат-иона и является фармакопейной. 4.Реакция с йодом.Тиосульфат – ион обесцвечавает нейтральные или слабощелочные растворы йода, восстанавливая йод до йодид – ионов с одновременным образованием тетратионат – иона: одновременным образованием тетратионат – иона: 2Na2S2O3 + I2 → 2NaI +Na2S4O6 Реакции борат-ионов ВО2 - и В4О7 2- Ортоборная кислота Н3ВО3 — бесцветное, твердое кристаллическое вещество, относится к очень слабым электролитам. Соли борной кислоты отвечают по составу не ортоборной кислоте Н3ВО3 , а метаборной кислоте НВO2 или тетраборной кислоте Н2В4О7 . Хлорид бария ВаСl2 с концентрированными растворами буры дает белый осадок метабората бария, который растворяется в уксусной, хлороводородной и азотной кислотах. Na2B4O7 + ВаС12 + ЗН2О → Ba(BO2 )2↓ + 2НзВО3 + 2NaCl В4О7 2- + Ва2+ + ЗН2О → Ba(BО2 )2 + 2НзВО3 Этиловый спирт и концентрированная серная кислота при взаимодействии с сухой борной кислотой или сухим тетраборатом образуют борноэтиловый эфир, который пи горении дает пламя с ярко- зеленой окраской. Na2B4O7 + Н2 SО4 5 H2O → 4НзВО3 + Na2SO4 H3BO3 + 3C2H5OH → B(C2H5O)3 + 3H2O Является фармакопейной. Применение в медицине и фармации солей анионов 1-ой аналитической группы Соли серной кислоты. В качестве лекарственных препаратов используются сульфат магния – слабительное и гипотензивное средство, сульфат бария – рентгеноконтрастное средство, сульфат натрия – слабительное и желчегонное средство. Серная кислота применяется в качестве реактива при количественном определении щелочей, при качественном открытии многих органических и неорганических лекарственных препаратов. Соли сернистой кислоты – сульфит натрия нашел применение в качестве стабилизатора легко окисляющихся веществ. Соли угольной кислоты. Карбонат кальция, гидрокарбонат натрия назначают для лечения заболеваний желудка. Соли фосфорной кислоты с органическими снованиями применяют для различных целей. Борная кислота и тетраборат натрия нашли применение как антисептики для полосканий, промываний, смазываний. Тиосульфат натрия оказывает антисептической и противовоспалительное действие. 3)Задание 3 . Методы кислотно-основного титрирования. Основное уравнение метода .Рабочие Растворы .Стандартные растворы. Индикаторы. Ацидиметрия и алкалиметрия. Порядок и техника тетрирования. Расчеты. Использование метода при анализе лекарственных средств. К методу кислотно-основного титрования относятся методы, основанные на реакции: H+ + OH– = H2О. Метод используют для определения содержания веществ, обладающих кислотными или основными свойствами В процессе титрования изменяется pH раствора, поэтому этим методом проводят определение кислот, оснований и некоторых солей слабых кислот и слабых оснований. В качестве титрантов обычно используют сильные кислоты и основания. Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты – ацидиметрией. Основными рабочими растворами кислот являются HCl, H2SO4, основаниями – NaOH. KOH. Эти вещества не отвечают требованиям для приготовления стандартного раствора – их нельзя приготовить по навеске, только путем титрования. В качестве стандартных веществ при установке концентрации кислот используют Na2B4O7*10H2O, Na2CO3, щелочей – щавелевую кислоту. Растворы в кислотно-основном титровании не имеют окраски. Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo вещества в растворе титранта становится строго эквивалентным количеству определяемого вещества согласно уравнению химической реакции, называют точкой эквивалентности. Точку эквивалентности устанавливают различными способами. В методах ручного анализа преимущественно используют изменение окраски индикатора, добавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,04 мл (2 капли) титранта. Это то количество вещества в растворе титранта, которое необходимо для взаимодейcтвия его с индикатором. Если для приготовления растворов используют вещества, которые не являются стандартными, то проводят их стандартизацию. Например растворы кислот можно стандартизовать по стандартным веществам — натрия тетраборат Na2B4О7 ∙10Н2О, натрия карбонат Nа2СО3 ·10Н2О или по стандартным растворам NaOH, КОН; а растворы оснований — по щавелевой кислоте Н2С2О4 ∙2Н2О, янтарной кислоте Н2С4Н4О4 или по стандартным растворам HCl, H2SO4 , НNО3 . Кривые кислотно-основного титрования выражают зависимость изменения рН раствора от объема добавленного титранта (рис. 3.4). 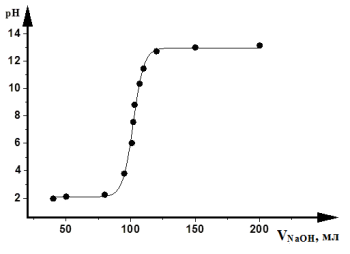 Рис. 3.4. Кривая кислотно-щелочного титрования При расчете рН необходимо знать состав титриметрической смеси. Для упрощения вычислений (что не приводит к заметным ошибкам) не учитывают разбавление раствора в процессе титрования и используют понятие «концентрация», а не «активность». Кривые титрования представляют в виде графика зависимости рН от объема добавленного титранта или объема избытка определяемого вещества и избытка титранта. В начале титрования рН изменяется очень медленно. Кривая (см. рис. 3.4) показывает, в частности, что если оттитровать половину имеющегося количества кислоты (50 мл), рН раствора изменится незначительно по сравнению с исходным, если оттитровать 90 % (90 мл), то и тогда уменьшение рН составит лишь одну единицу. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Оттитровывание кислоты от 90 до 99 % вызывает изменение рН на три единицы. Также на единицу возрастает рН при оттитровывании от 99 до 99,9 %, т. е. на 0,9 %. Титрование остатка кислоты (0,1%) приводит к изменению рН на целых 3 единицы. Введение избытка в 0,1 % NaOH по сравнению с эквивалентным количеством вызывает изменение рН также на 3 единицы, и рН раствора становится равным 13,0. Кривая титрования сильного основания сильной кислотой представляет собой зеркальное отображение кривой титрования сильной кислоты сильным основанием. При титровании сильной кислотой сильного основания и наоборот до точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи или кислоты, а после точки эквивалентности — концентрацией добавленной кислоты или щелочи. В точке эквивалентности раствор нейтрален. Скачок титрования — это резкое изменение рН в области точки эквивалентности. Факторы, влияющие на величину и положение скачка титрования (на величину скачка титрования влияют все факторы, от которых зависят значения рН): ● константа диссоциации титруемого вещества; ● концентрация титруемого вещества; ● концентрация титранта; ● температура; ● ионная сила. Чем меньше концентрация титруемого вещества и титранта, тем меньше скачок. Практически невозможно оттитровать сильные протолиты концентрацией 10 –4 М, а слабые — концентрацией 10 –2 М. При изменении температуры сильно изменяется константа автопротолиза воды, входящая во многие формулы расчета рН. В результате при увеличении температуры скачок уменьшается и смещается в более кислую область. Ионная сила влияет незначительно. В рассматриваемом случае расчет рН проводят по следующим формулам: ● Для сильной кислоты, например HCl, рН определяется концентрацией ионов водорода: [H+] = M кислоты. ● Для сильного основания, например КОН [H+] = 10–14 / Mщелочи. Часто проводят титрование с использованием слабых электролитов. При титровании слабой кислоты сильным основанием чем слабее кислота, тем больше значение рН в начале титрования. Следовательно, ветвь кривой титрования (рис. 3.5) до точки эквивалентности смещается в щелочную область. После достижения точки эквивалентности образуется сильное основание, следовательно, значение рН резко смещается в щелочную область. При дальнейшем титровании кривая изменяется незначительно. В ходе титрования раствора уксусной кислоты сильным основанием значение pH все время остается выше, чем при тех же концентрациях соляной кислоты. В результате этого скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и в первом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/л NaOH. 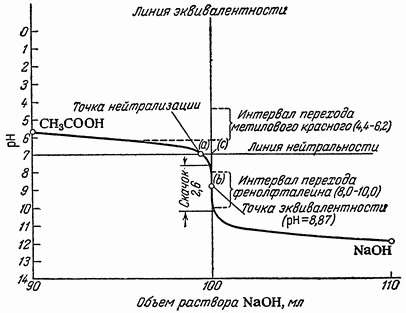 Рис. 3.5. Ход титрования слабой кислоты сильным основанием При титровании слабой кислоты сильным основанием pH раствора кислоты вычисляют с учетом ее константы диссоциации: Интервал скачка рН на кривой титрования 0,1 мольл уксусной кислоты раствором 0,1 мольл NaOH значительно уже предыдущего случая. Он простирается от рН = 7,8 до рН = 10. При титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной области рН. Рассчитывается рН в этом случае следующим образом: При титрование слабой кислоты слабым основанием (или наоборот) сужение интервала скачка рН происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой вовсе исчезает. Пример — нейтрализация раствора 0,1 моль/л СН3СООН раствором 0,1 моль/л NН4ОН. Кривая титрования не имеет скачка рН. Поэтому нельзя ожидать и резкого изменения окраски индикаторов. Титрование слабой кислоты слабым основанием вообще невозможно. Конечную точку титрования устанавливают с помощью кислотноосновных индикаторов – слабых органических кислот и оснований, изменяющих свою окраску в зависимости от рН среды за счет образования протонированных и депротонированных форм, отличающихся по своей структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двухцветные (метиловый оранжевый) кислотно-основные индикаторы. Наряду с индивидуальными индикаторами применяют их смеси с нейтральными красителями. Кислотно-основные индикаторы должны удовлетворять следующим требованиям: 1. быть чувствительными, к изменению рН раствора в процессе титрования, чтобы расход индикатора был как можно меньше; 2. равновесие между обеими формами должно устанавливаться быстро; 3. обе формы (или одна у одноцветных индикаторов) должны иметь интенсивную отличающуюся окраску; 4. интервал перехода окраски индикатора не должен быть большим. Индикаторы метода кислотно-основного титрования. Теории индикаторов Индикаторы — вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. В методах кислотно-основного титрования для определения конечной точки титрования используют кислотноосновные индикаторы (табл. 3.1). Это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды. Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута ли точка эквивалентности. Правильно выбранный индикатор изменяет окраску в области скачка титрования. У неправильно выбранного индикатора изменение окраски может происходить задолго до наступления точки эквивалентности или после нее. Таблица 3.1 Характеристики кислотно-основных индикаторов 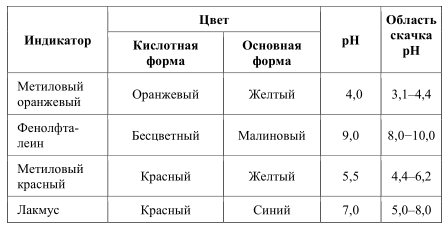 Выбирают индикатор с помощью кривой титрования. Для этого на график наносят интервал перехода индикатора. У правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, то индикатор для данного титрования не подходит. Значение рН, при котором заканчивается титрование с данным индикатором, называют показателем титрования и обозначают рТ. Показатель титрования находится обычно в середине интервала перехода индикатора. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах. Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению: HInd = Н+ + Ind — (бесцветный — малиновый). Окраска раствора, в котором индикатор находится в молекулярной форме (HInd), отличается от окраски раствора, в котором индикатор находится в ионной форме (Ind − ). Молекулы фенолфталеина HInd бесцветны, а его анионы Ind − окрашены в малиновый цвет. Достаточно к раствору, содержащему фенолфталеин, прибавить 1−2 капли щелочи, как введенные ОН – ионы станут связывать катионы Н+ с образованием слабого электролита — молекул воды. При этом равновесие диссоциации индикатора сместится вправо, и накопление анионов Ind − вызовет окрашивание раствора в малиновый цвет. То есть переход одной окраски, присущей молекулярной форме кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+ или ОН − -ионов, т. е. зависит от рН раствора. |
