Химия (расчет ионной силы раствора). 1. Расчет ионной силы раствора
 Скачать 0.98 Mb. Скачать 0.98 Mb.
|
2.2. Равновесия в растворах слабых кислот и оснований2.2.1. Расчет рН в растворах слабых кислот и основанийСлабые кислоты и основания в водных растворах диссоциированы не полностью и основная масса вещества существует в растворе в молекулярной форме. Процесс диссоциации слабого электролита протекает ступенчато. Например, для слабой двухосновной кислоты H2An: Основной количественной характеристикой силы слабого электролита является константа равновесия процесса диссоциации или константа диссоциации. Каждая ступень диссоциации характеризуется своей константой равновесия. Для слабой двухосновной кислоты H2An существует две константы диссоциации: 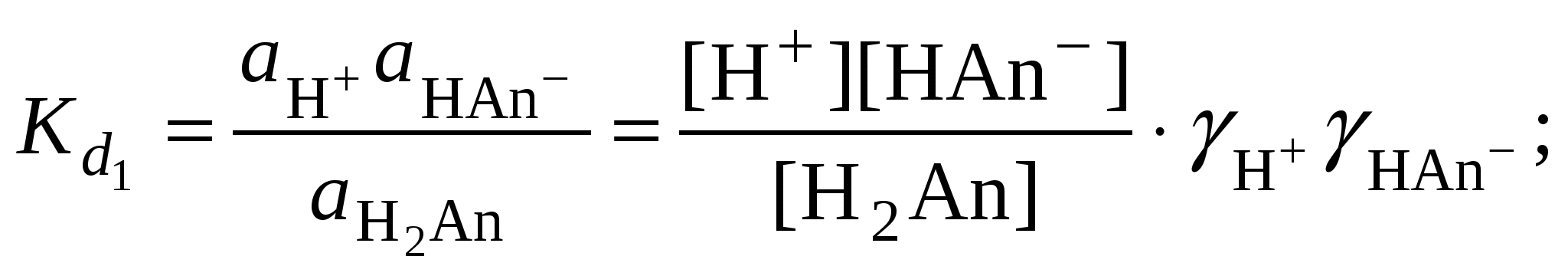 Значения констант диссоциации для 25°С приводятся в справочной литературе Обычно константа диссоциации по второй ступени приближенно в 104-105 раз ниже, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН в растворах многоосновных слабых кислот обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. где Пример 11.Вычислить рН раствора гидроксида аммония концентрацией 0,5 моль/л; Решение. 1. Записать уравнение диссоциации гидроксида аммония 2. Вычислить концентрацию гидроксид-ионов в растворе аммиака в воде и величину рН (полагая Задачи для решенияIV. Определить pH предложенного раствора слабого электролита при температуре 25°
2.3.1. Расчет рН в растворе гидролизующейся солирН в растворе гидролизующейся соли определяется природой слабого электролита. При гидролизе соли, образованной сильным основанием и слабой кислотой, гидролизуется анион слабой кислоты. В растворе появляются ионы ОН, поэтому среда щелочная, рН > 7. Если соль, образована слабым основанием и сильной кислотой, то гидролизуется катион слабого основания: в растворе появляются ионы Н+, поэтому среда кислая, рН < 7. Гидролиз является обратимым процессом и имеет ступенчатый характер. Термодинамической характеристикой гидролиза является его константа равновесия – константа гидролиза. Константу гидролиза проще всего вычислить через значение константы диссоциации слабого электролита по уравнению: Первой константе гидролиза соответствует последняя константа диссоциации, последней константе гидролиза – первая константа диссоциации, в чем нетрудно убедиться, сравнивая состав (по кислотным остаткам) реакций диссоциации и гидролиза для фосфорной кислоты:
Обычно константа гидролиза по второй ступени во много раз меньше, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН обычно учитывают только первую ступень гидролиза, пренебрегая последующими его ступенями. Ионная сила раствора гидролизующейся соли в этом случае может быть вычислена без учета реакции гидролиза по концентрации соли. В случае гидролиза по аниону (2.17) константа равновесия запишется следующим образом: 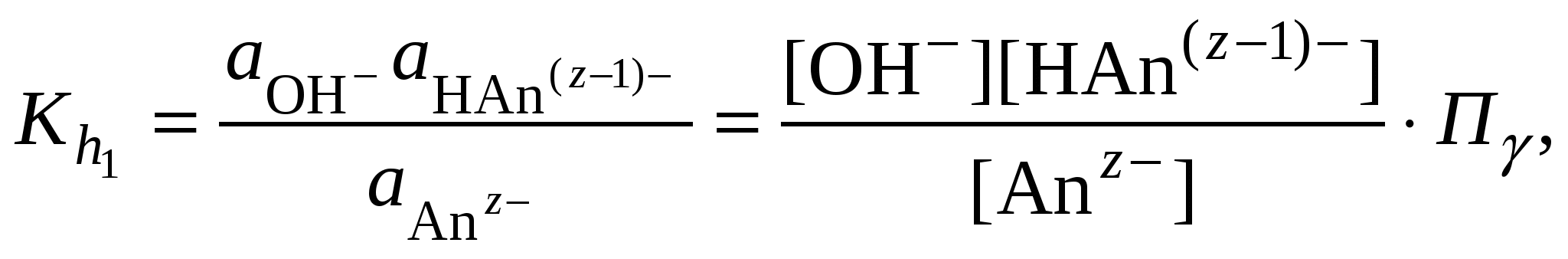 (2.24) (2.24)где 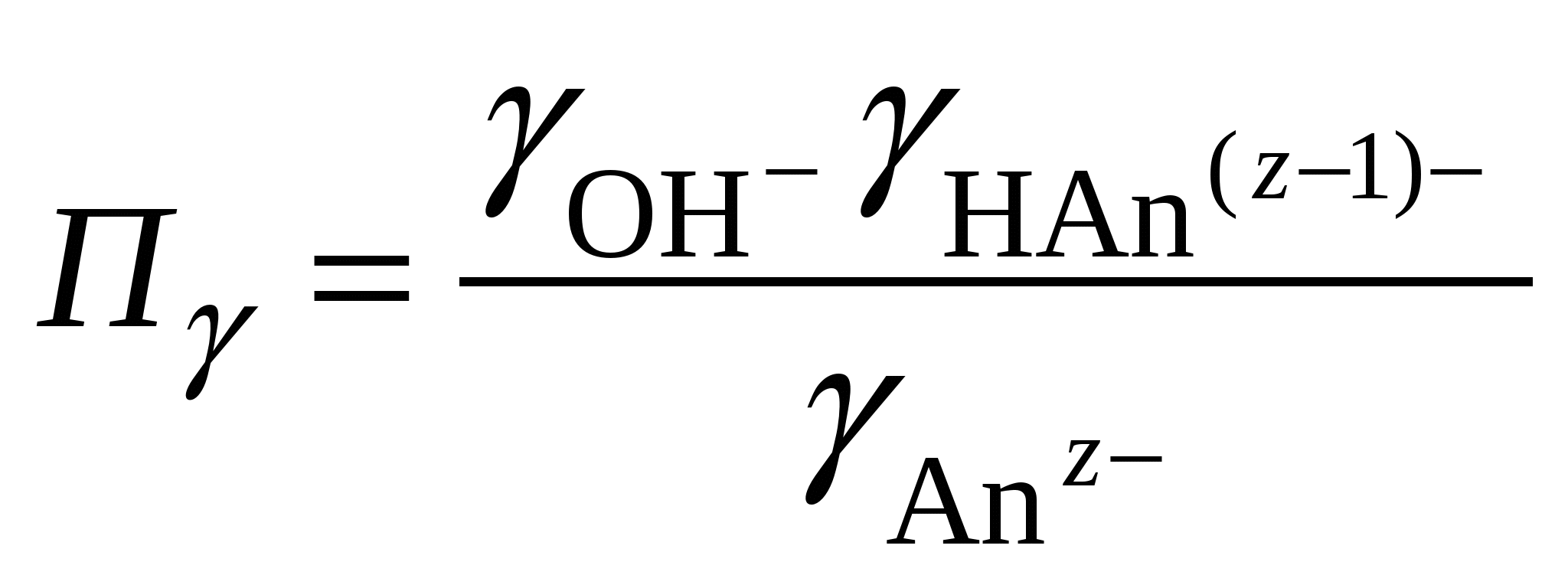 – произведение коэффициентов активности. – произведение коэффициентов активности.Концентрация ионов 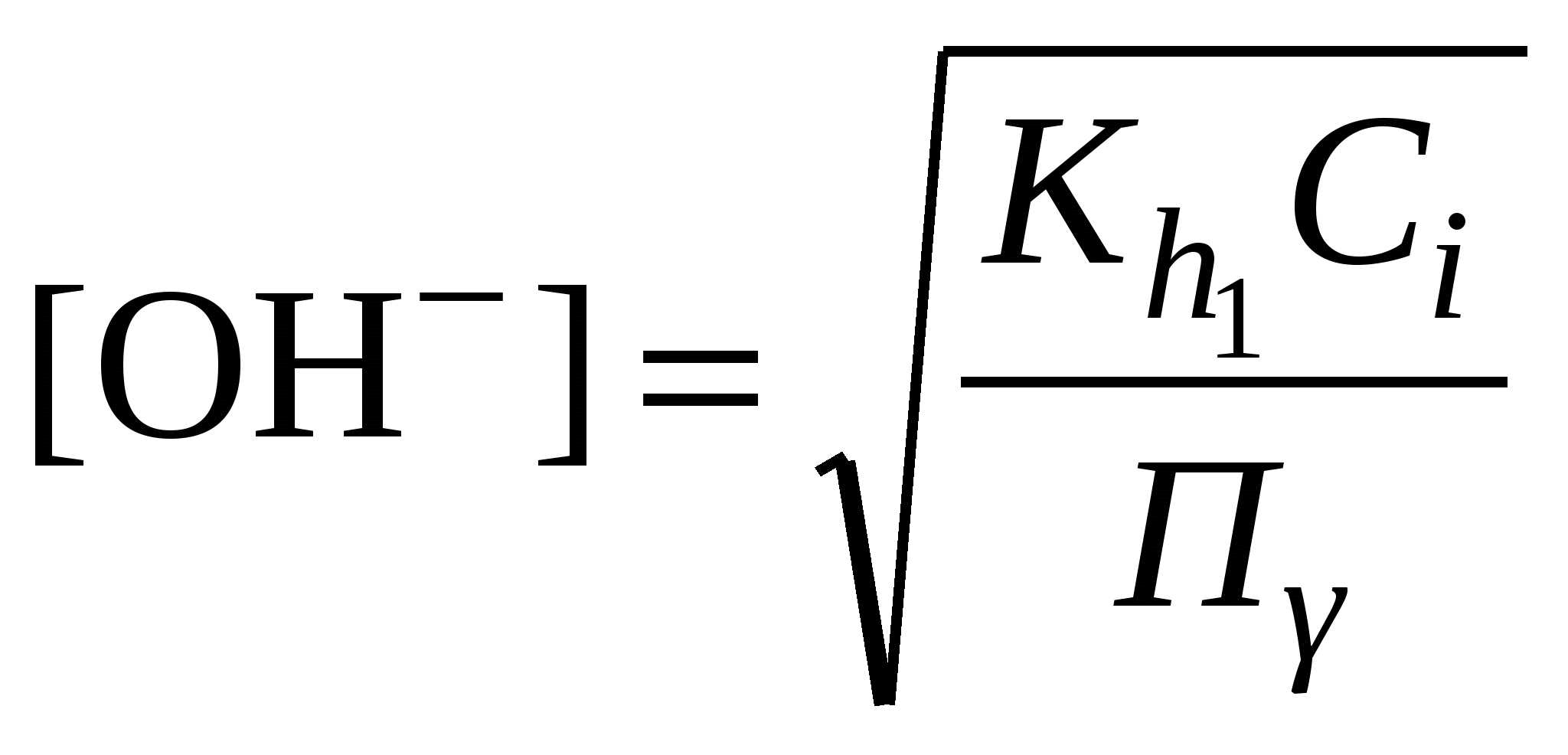 , (2.25) , (2.25)где Сi – моляльная концентрация гидролизующегося иона. При гидролизе по катиону (2.18) константа равновесия запишется следующим образом: 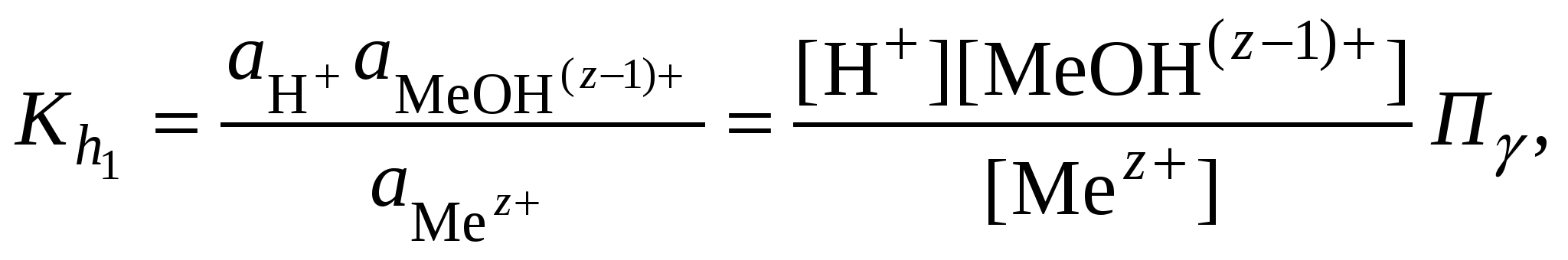 (2.26) (2.26)где 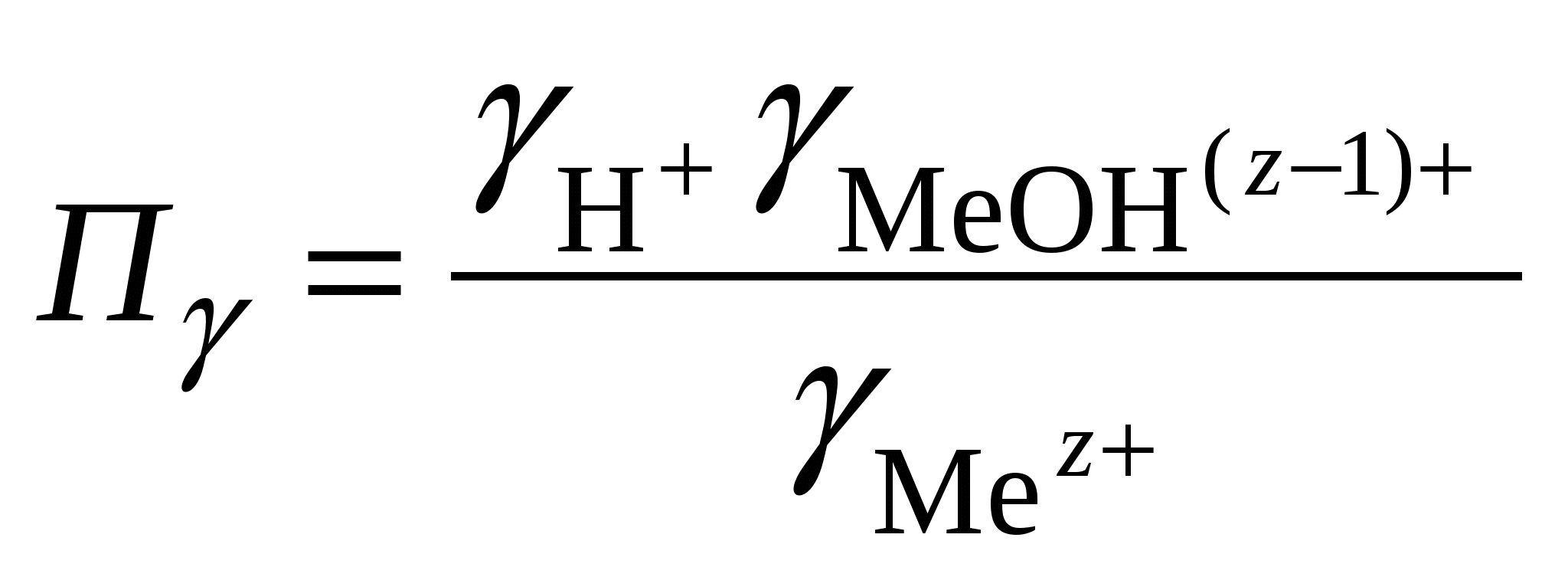 – произведение коэффициентов активности. – произведение коэффициентов активности.Концентрация катионов водорода вычисляется по уравнению: 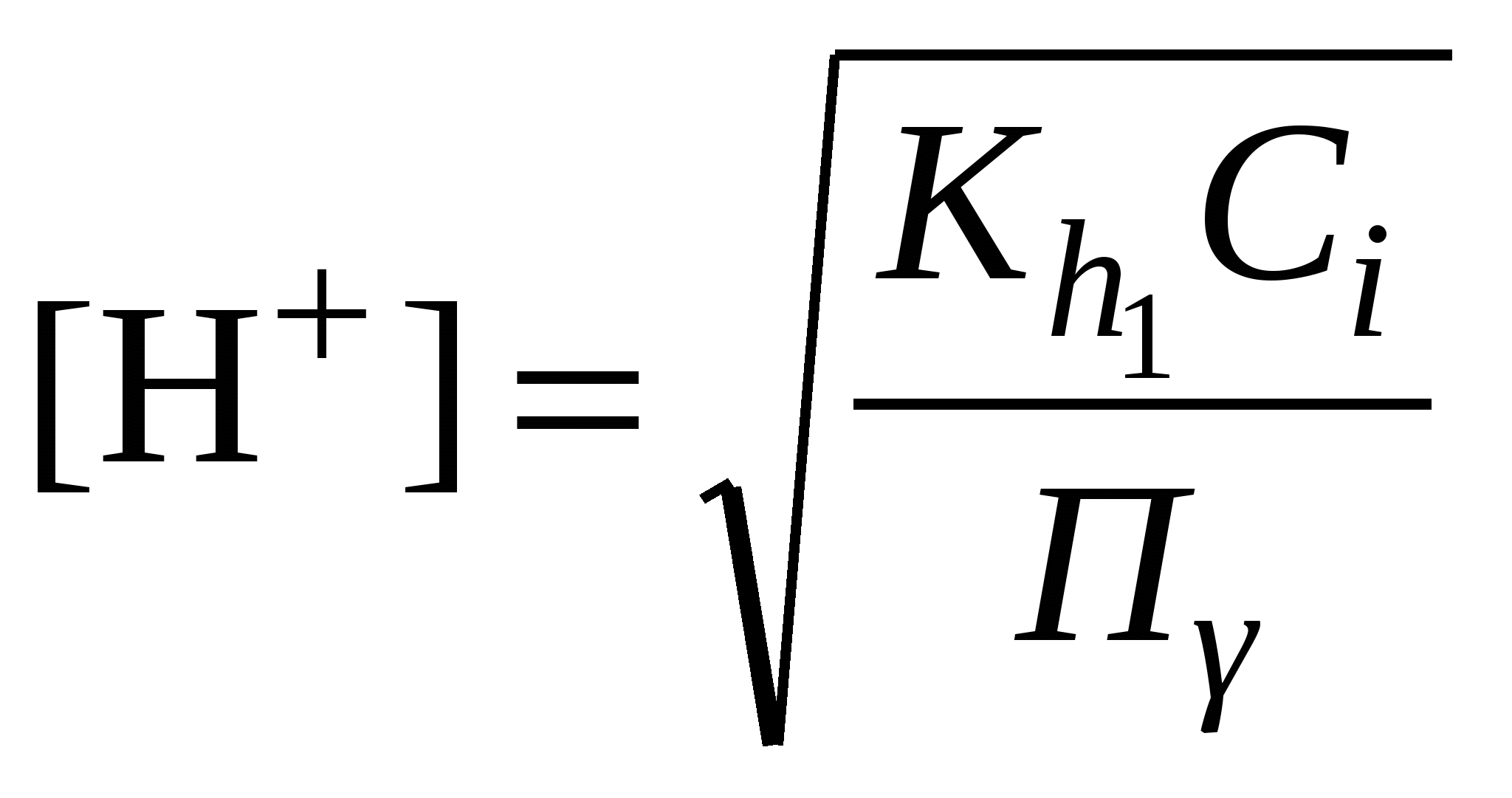 . (2.27) . (2.27)Пример 14.Вычислить рН раствора сульфата аммония концентрацией 3 % при 25°С; Решение. 1. Вычислить моляльную концентрацию сульфата аммония 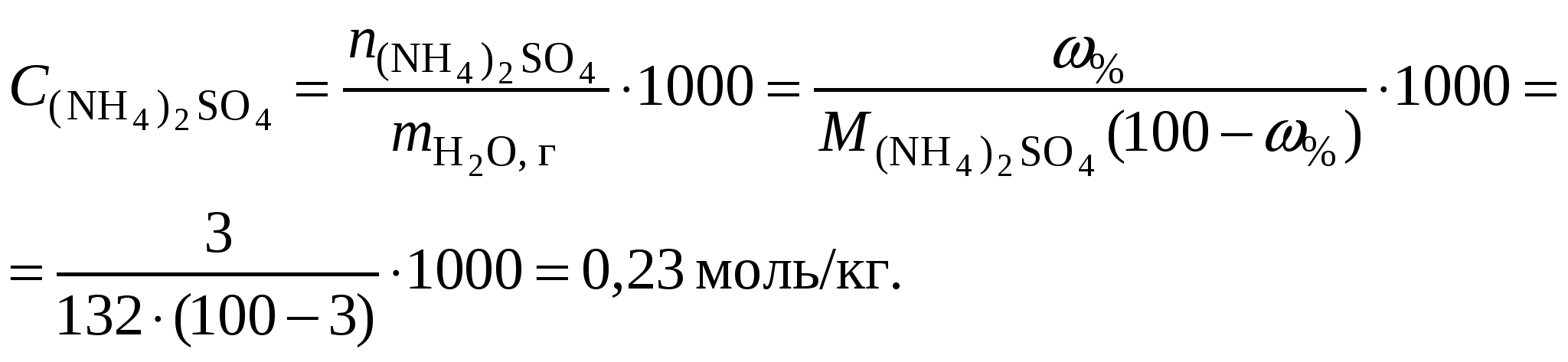 2. Вычислить ионную силу раствора, используя концентрацию соли 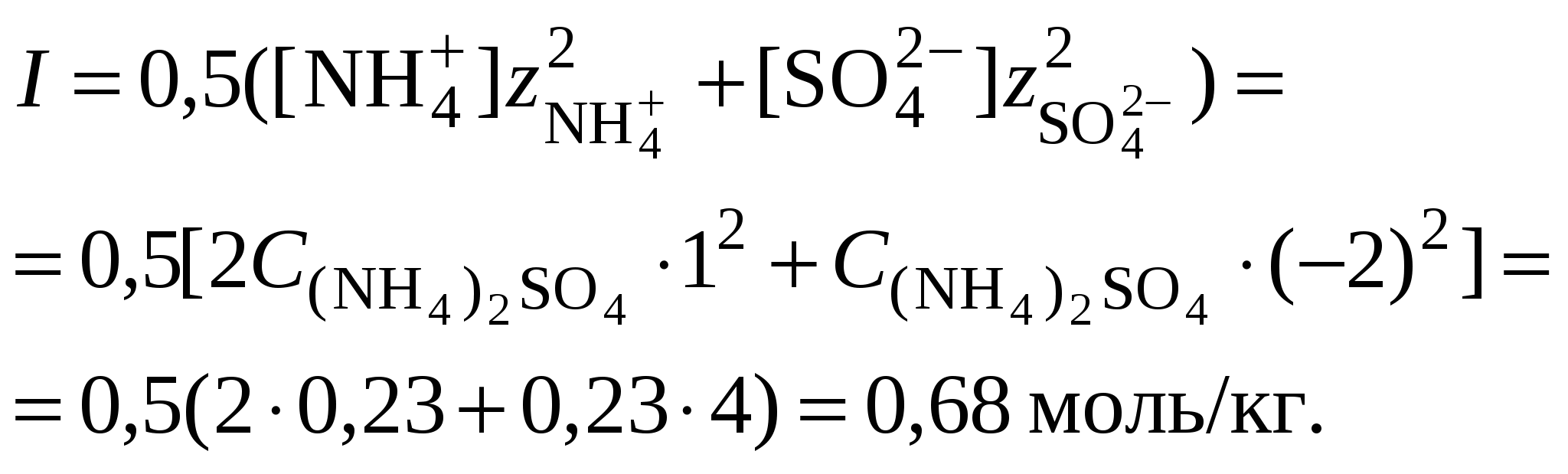 3. Составить ионное уравнение гидролиза сульфата аммония: 4. Составить уравнение константы гидролиза 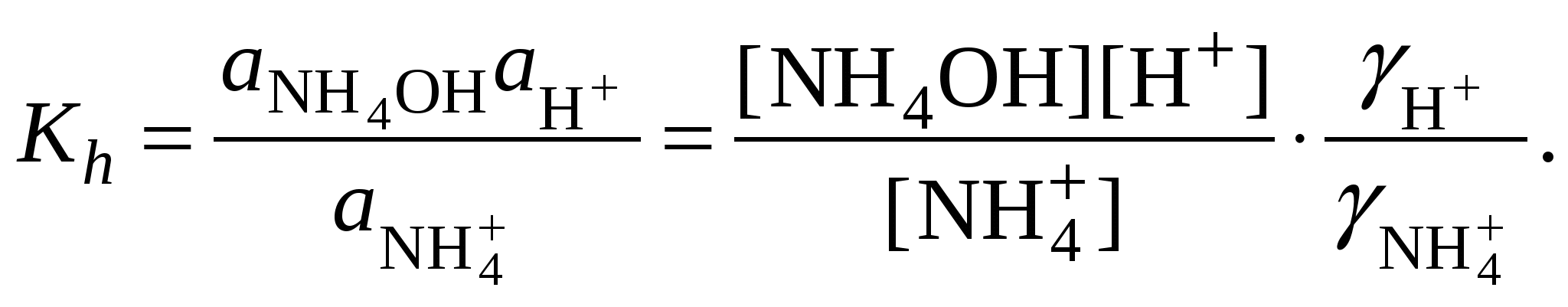 5. Вычислить константу гидролиза 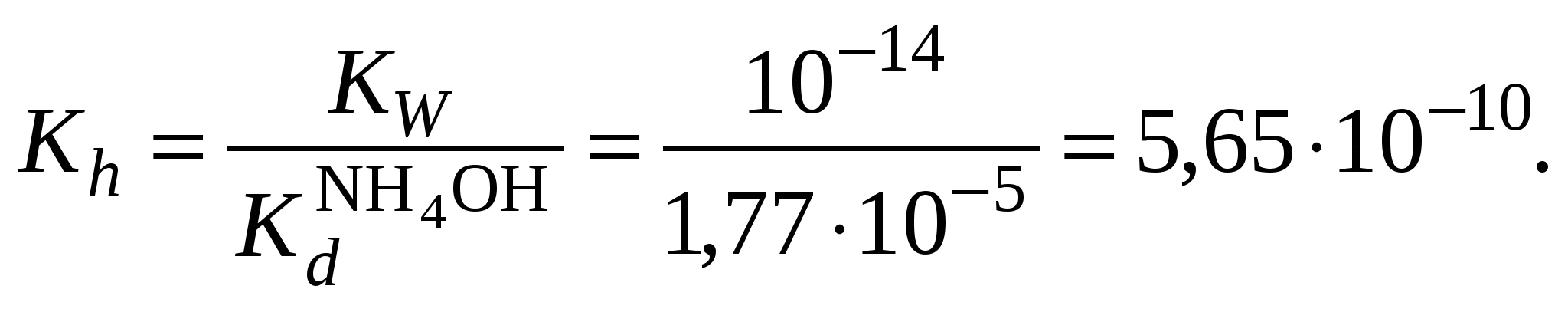 6. Вычислить концентрацию катионов водорода 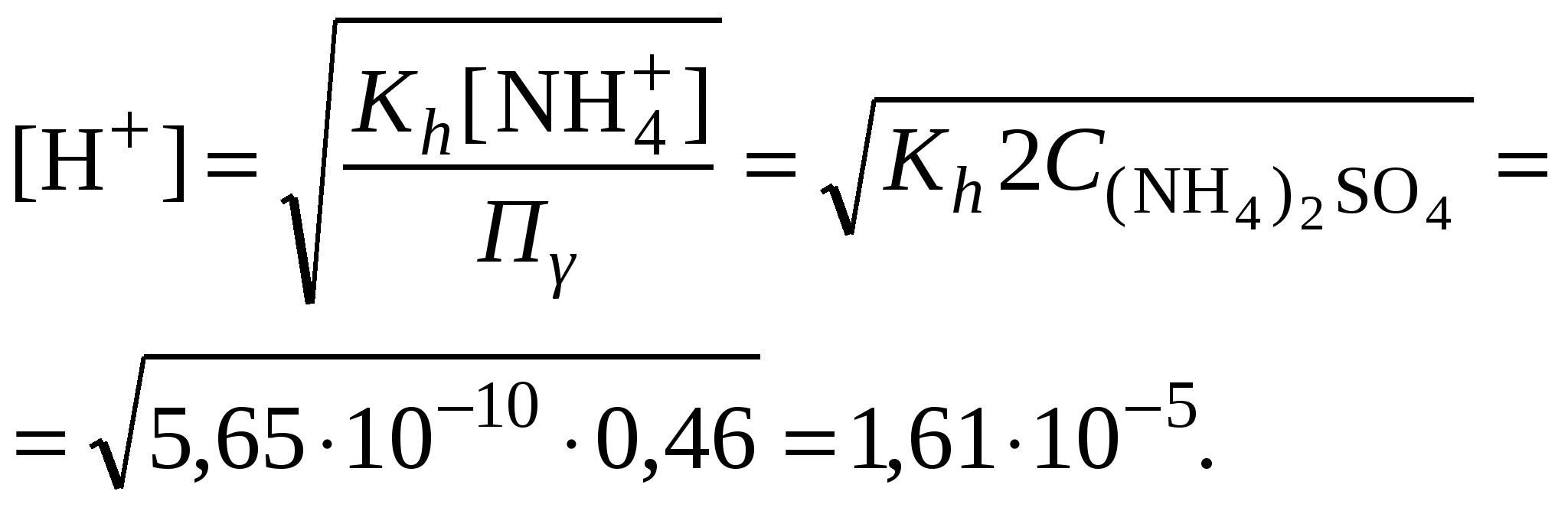 7. Рассчитать коэффициент активности катионов водорода 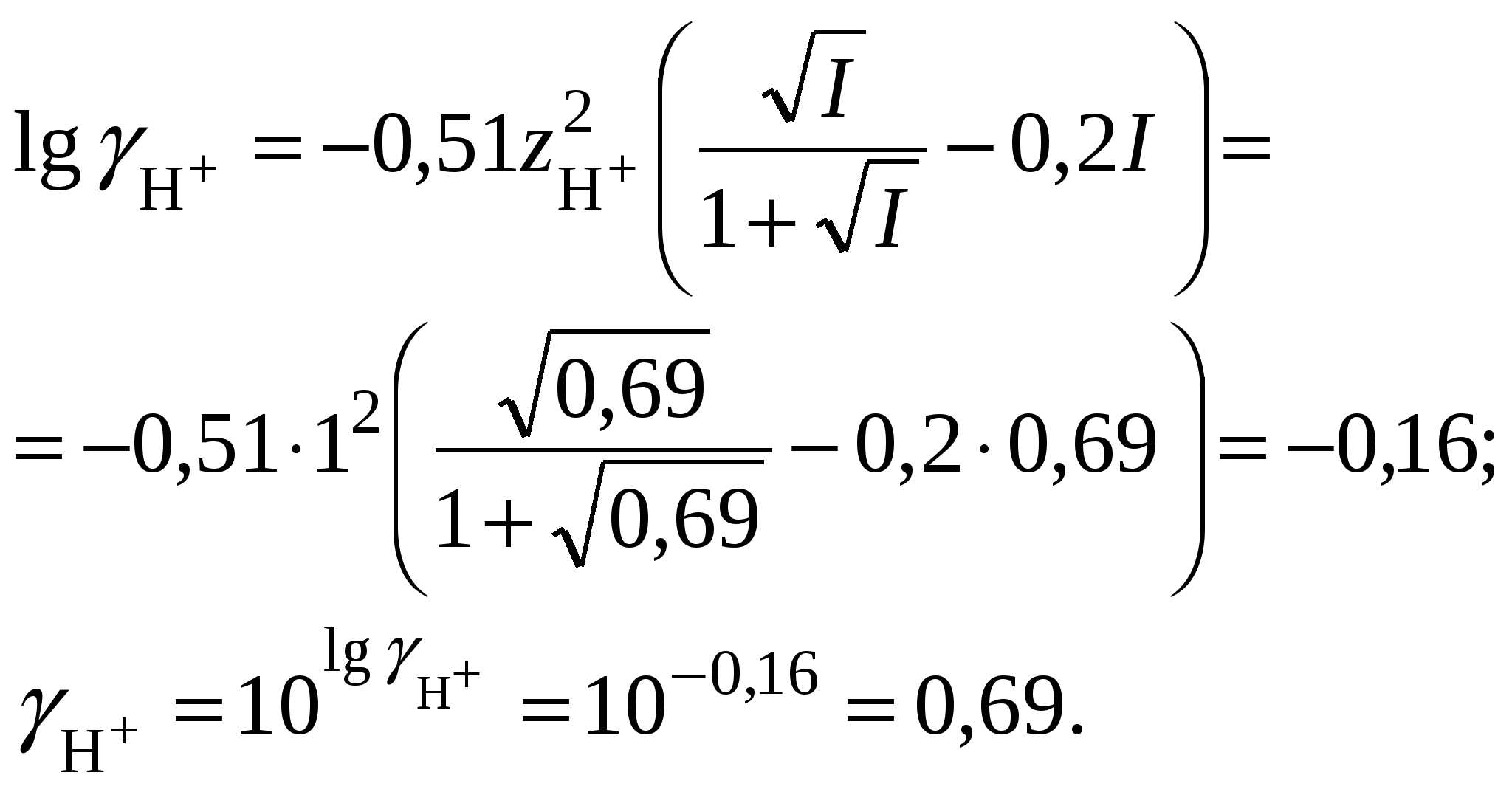 8. Вычислить рН раствора 2.3.3. Расчет равновесного ионно-молекулярного состава гидролизующейся солиДля детального исследования и математического моделирования гидролиза необходим расчет равновесного ионно-молекулярного состава раствора гидролизующейся соли. Равновесный состав рассчитывается при решении системы уравнений, состоящей из уравнений констант гидролиза по всем ступеням, уравнений баланса масс, баланса зарядов, расчета ионной силы раствора и коэффициентов активности. Для соли, гидролизующейся по аниону по двум ступеням состава Me2An такая система уравнений будет выглядеть следующим образом. Уравнения гидролиза аниона соли и их константы: уравнение баланса масс уравнение баланса зарядов: уравнение расчета ионной силы раствора: уравнения расчета коэффициентов активности: уравнение расчета произведения коэффициентов активности Пример 16.Рассчитать равновесный состав раствора сульфида натрия концентрацией 0,1 моль/кг при 25°С; Решение. 1. Составить уравнения гидролиза сульфид-иона и соответствующие константы гидролиза или 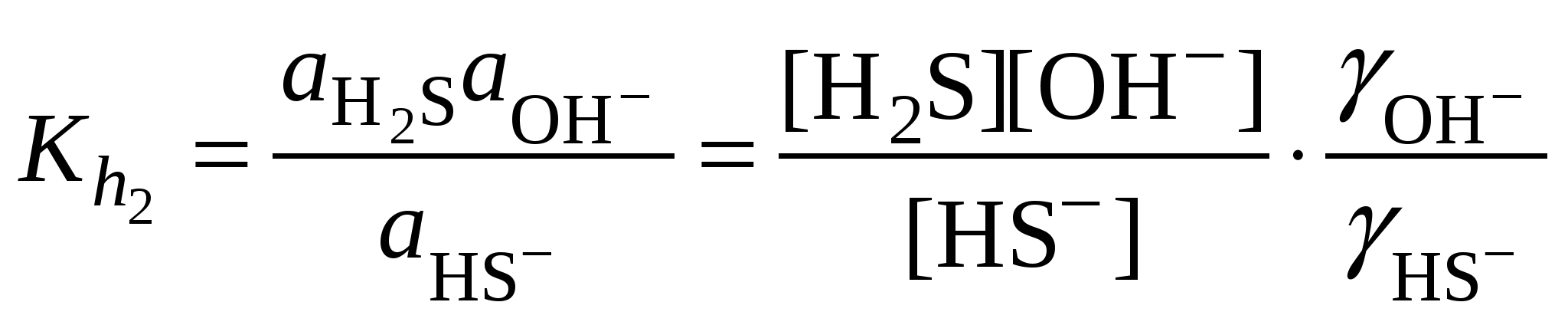 , ,учитывая, что 2. Дополнить систему уравнений (1) и (2) уравнениями баланса масс и баланса зарядов Решить систему уравнений (1) – (4) можно численными методами или аналитически – методом подстановки, как будет показано ниже. 3. Из уравнения (1) выразить концентрацию гидросульфид-ионов 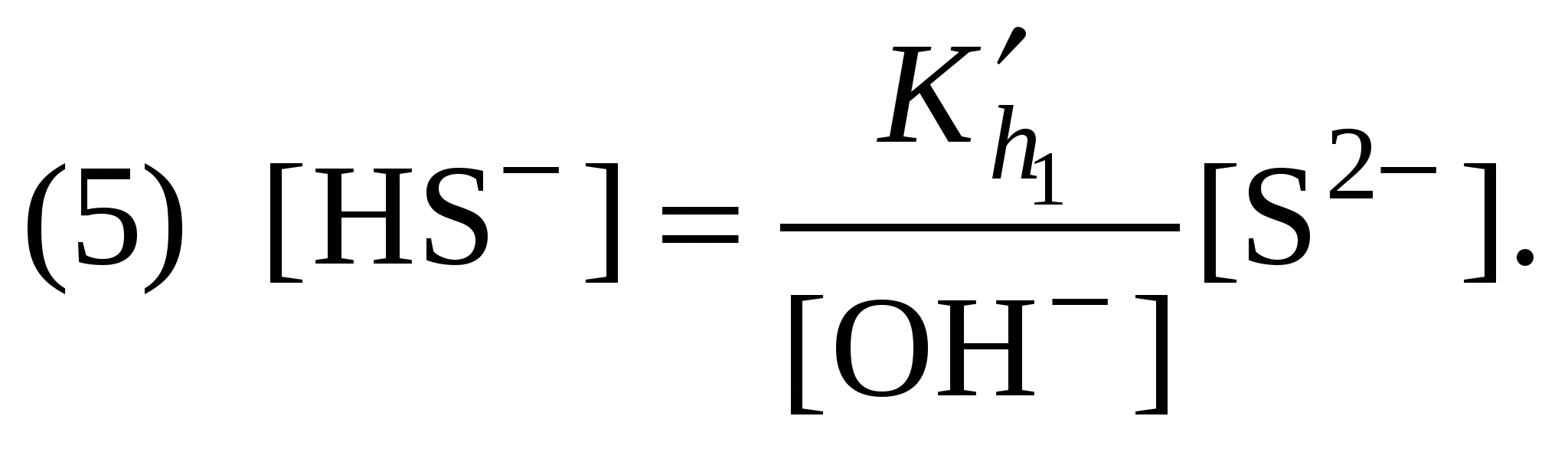 4. Из уравнения (2) выразить концентрацию молекул сероводородной кислоты или с учетом (5) 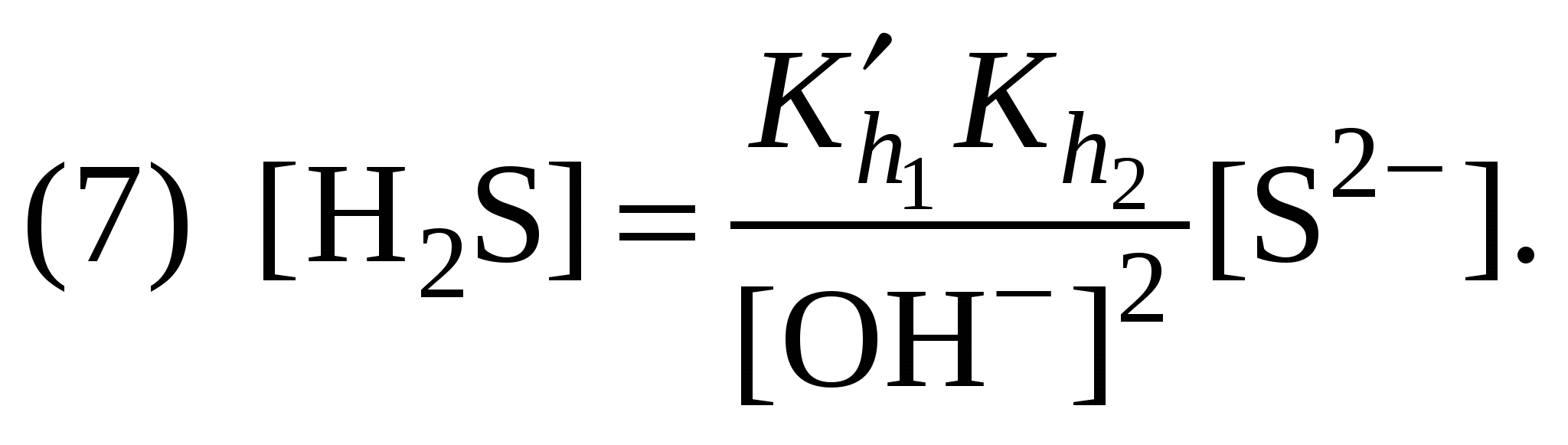 5. Уравнения (5) и (7) подставить в уравнения баланса масс и выразить концентрацию сульфид-иона: 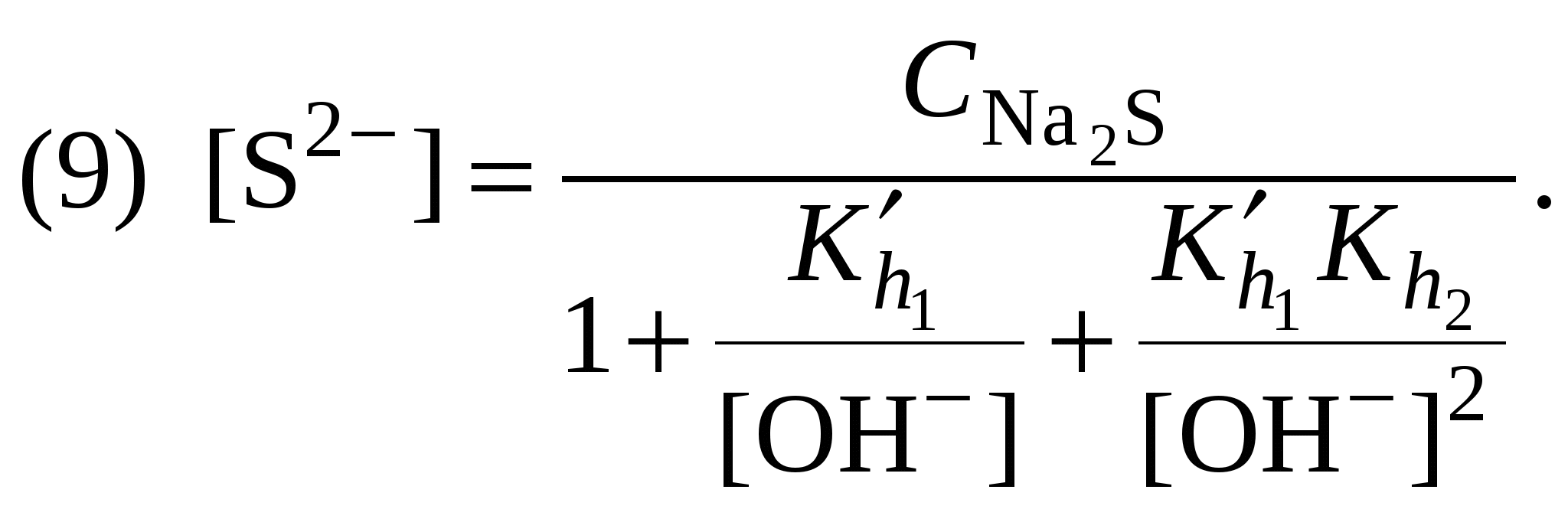 6. Уравнения (5) и (7) подставить в уравнения баланса зарядов С учетом уравнения (9) 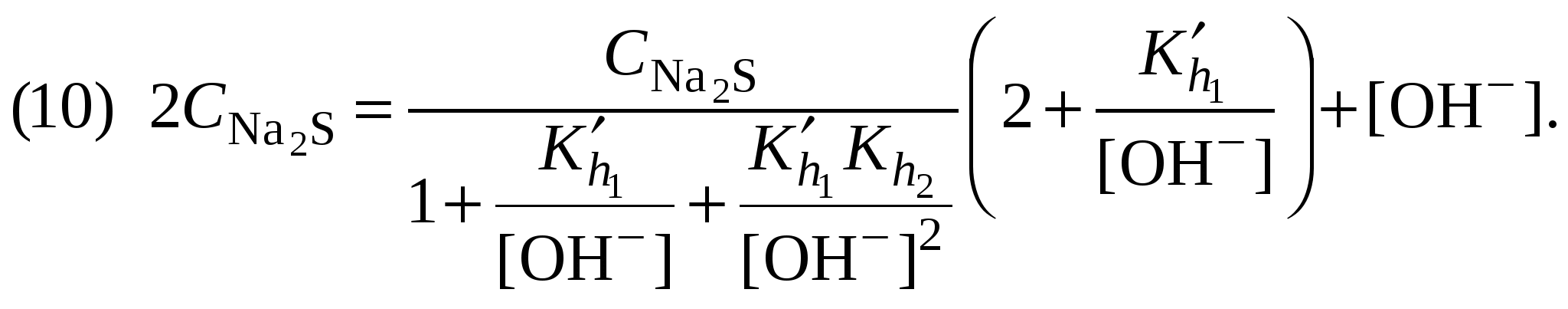 7. Уравнение (10) преобразовать в форму кубического уравнения: 8. Вычислить ионную силу раствора по концентрации сульфида натрия: коэффициенты активности ионов 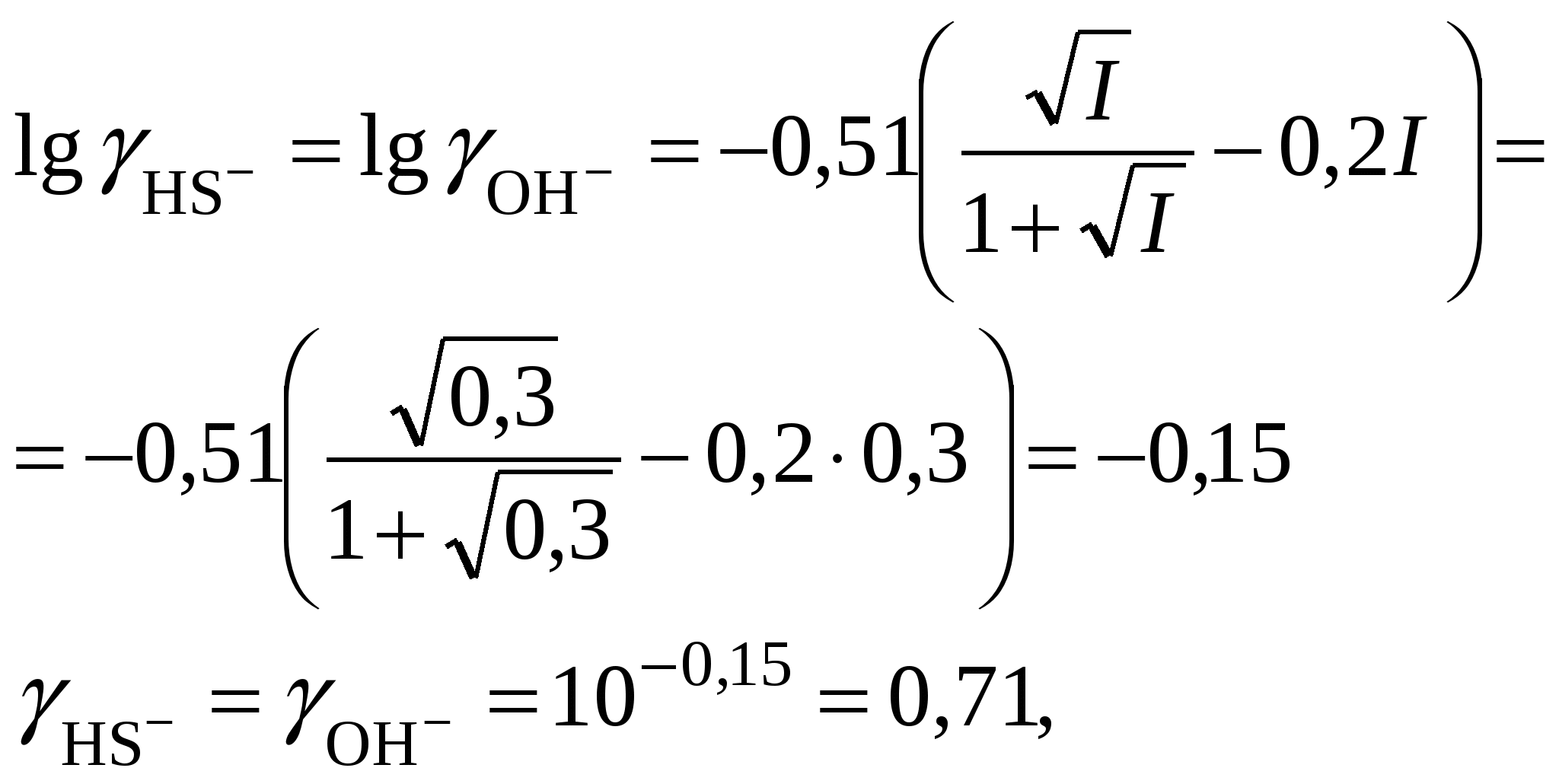 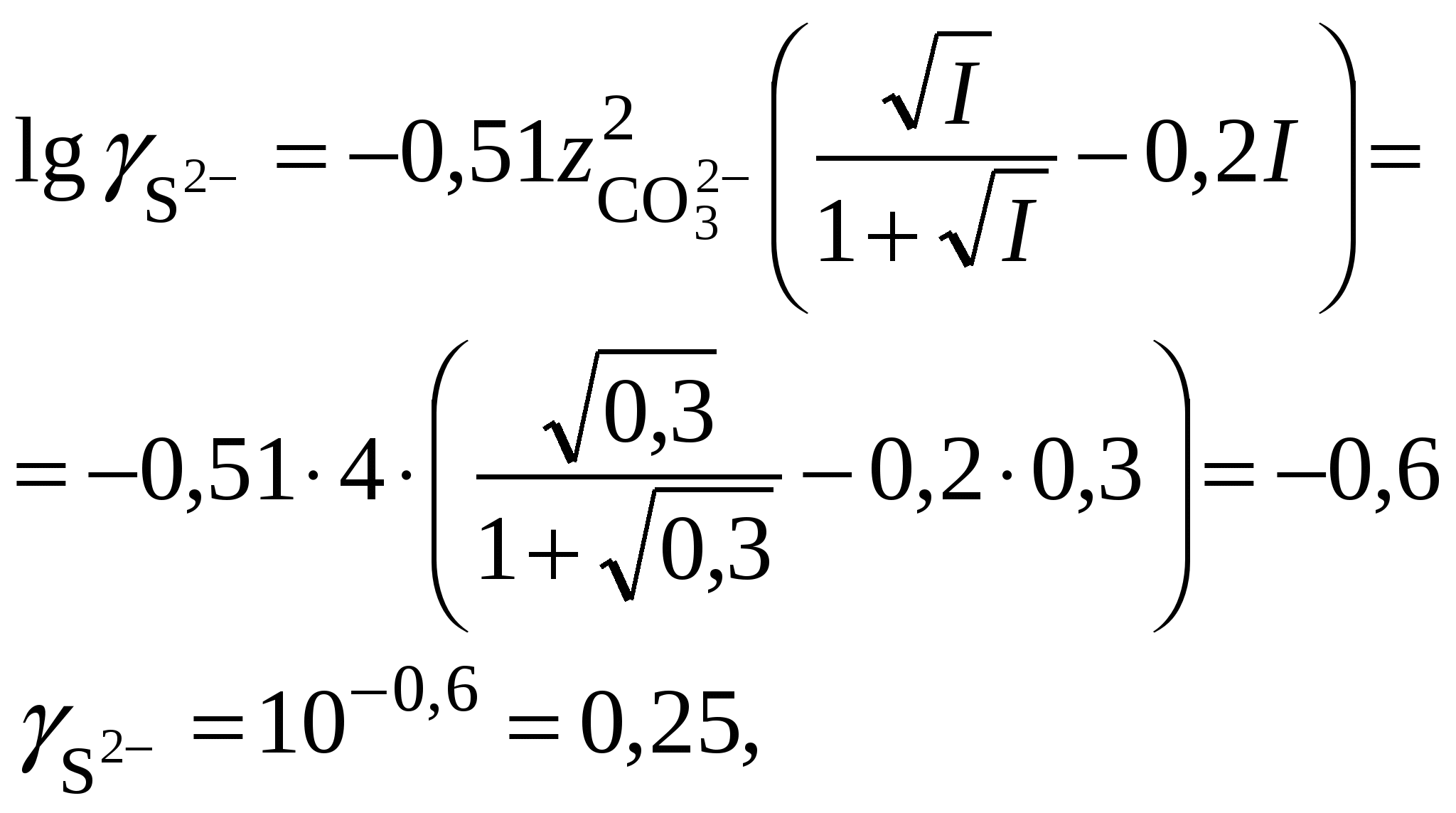 произведение активности и константы гидролиза 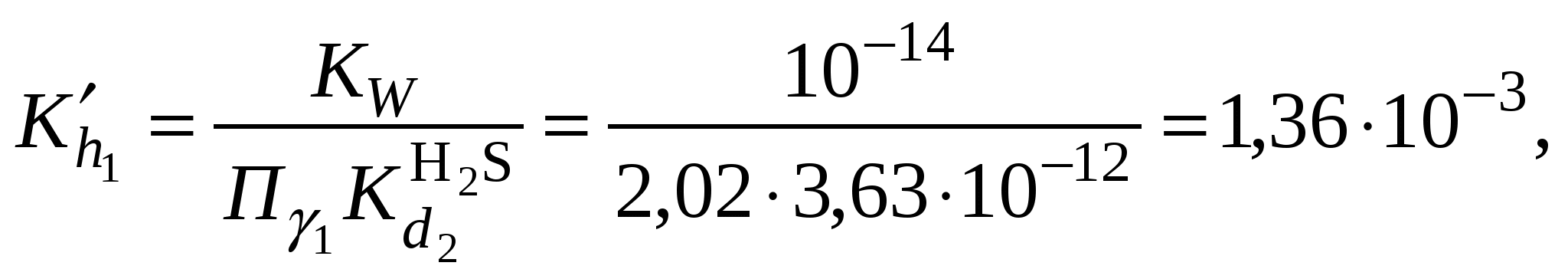 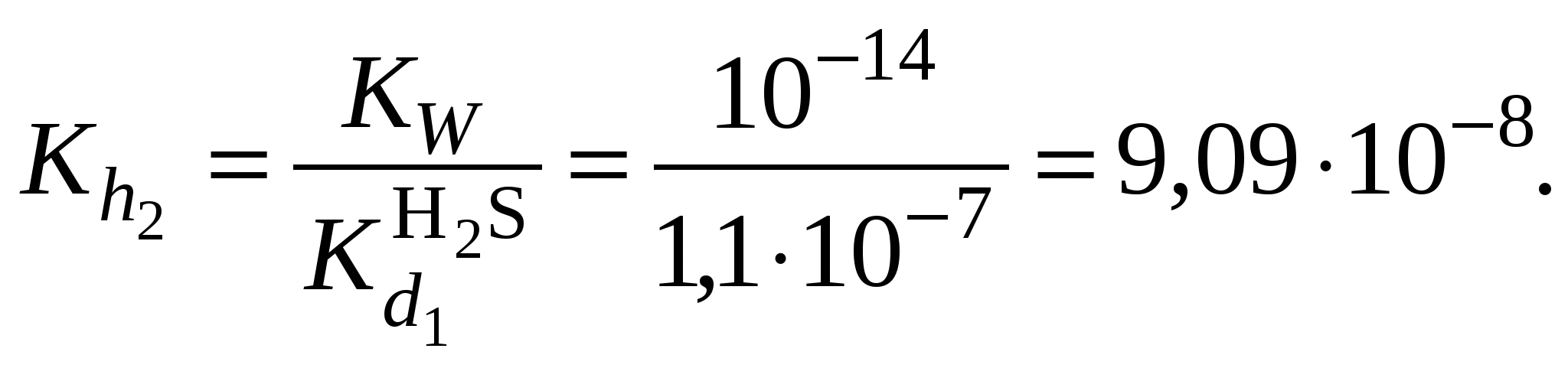 9. Подставить в уравнение (11) численные значенияоль 10. Оценить рН раствора сульфида натрия 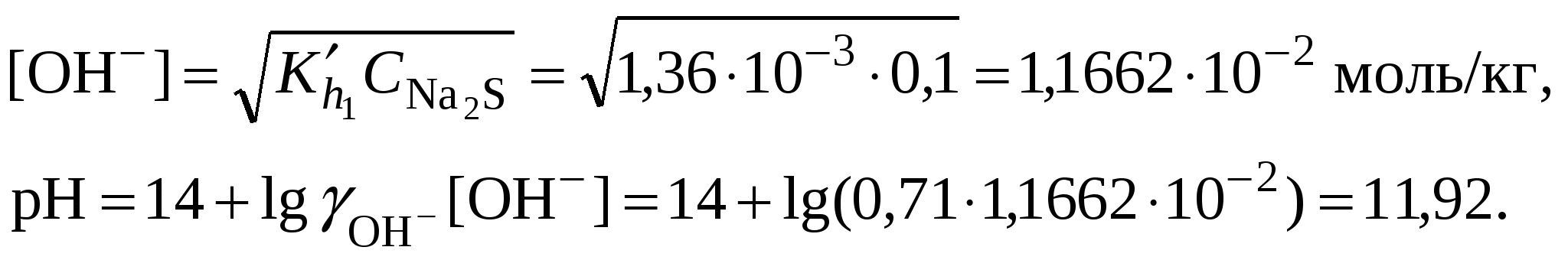 10. Методом подбора уточнить 11. Вычислить концентрацию сульфид-ионов по уравнению (9) 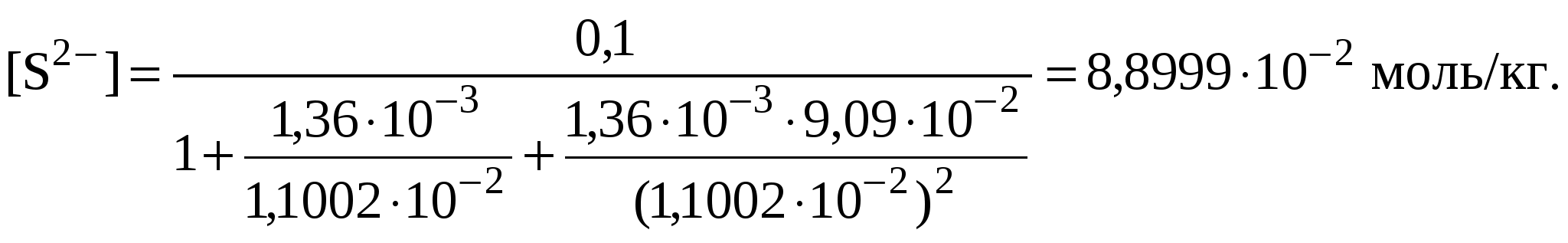 12. Вычислить концентрацию гидросульфид-ионов по уравнению (5) 13. Вычислить концентрацию H2S по уравнению (6) VII. Рассчитать ионный состав системы и построить график зависимости ионного состава (моль %) от рН среды.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
