Химия (расчет ионной силы раствора). 1. Расчет ионной силы раствора
 Скачать 0.98 Mb. Скачать 0.98 Mb.
|
3. Равновесия в насыщенных растворах3.1. Общие сведенияНасыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора. Равновесие между солью, состоящей из катионов металла Константу данного равновесия называют произведением растворимости соли и обозначают L. Согласно закону действующих масс: где Значения произведений растворимости обычно берут в справочной литературе 3.2. Растворимость в бинарной системе соль - водаРастворимость соли соответствует ее концентрации в насыщенном растворе, т.е. из которого следует уравнение расчета растворимости: 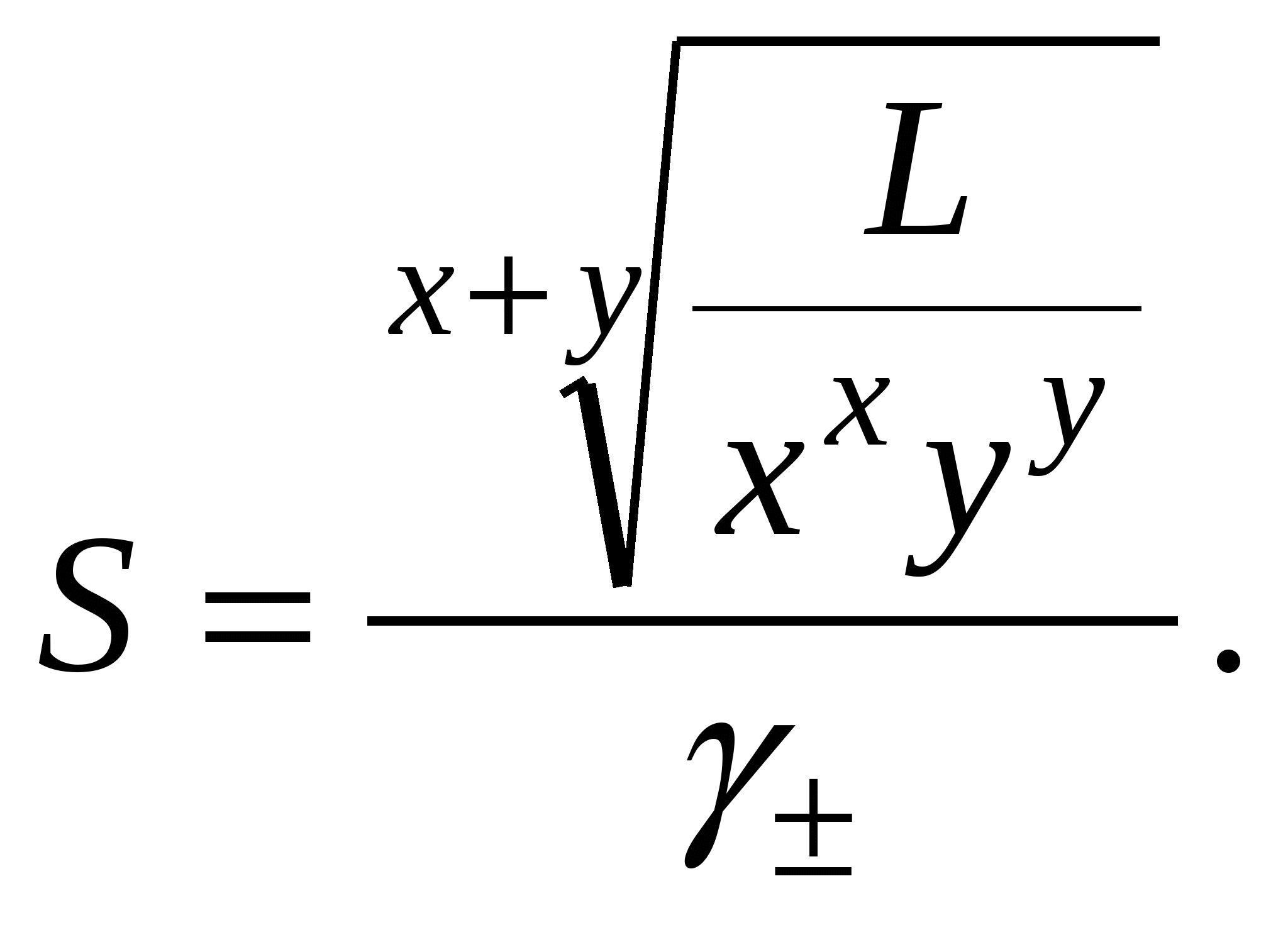 (3.9) (3.9)Расчет среднего ионного коэффициента активности следует выполнять по ориентировочному значению растворимости соли S0, которое высчитывают полагая Значение S0 используется в уравнении расчета ионной силы раствора (1.1): Далее следует вычислить значение коэффициента активности по уравнению (1.2) или (1.3) и произвести уточнение значения растворимости по уравнению (3.9) – S1. Если значения S0 и S1 совпадут (что вполне вероятно при низкой ионной силе раствора), то расчет растворимости считается завершенным. Если совпадение не достигнуто, то следует повторить расчет ионной силы раствора с использованием значения S1, пересчитать величину среднего ионного коэффициента активности с новым значением ионной силы раствора и снова уточнить величину растворимости. Расчеты следует повторять по тех пор, пока два значения растворимости не совпадут между собой. Пример 22.Рассчитать растворимость Ag2SO4 в воде при 25°С Решение. I. Вычисление растворимости сульфата серебра в воде 1. Составить уравнение диссоциации Ag2SO4, отвечающее равновесному растворению соли: согласно которому 2. Составить уравнение произведения растворимости Ag2SO4: 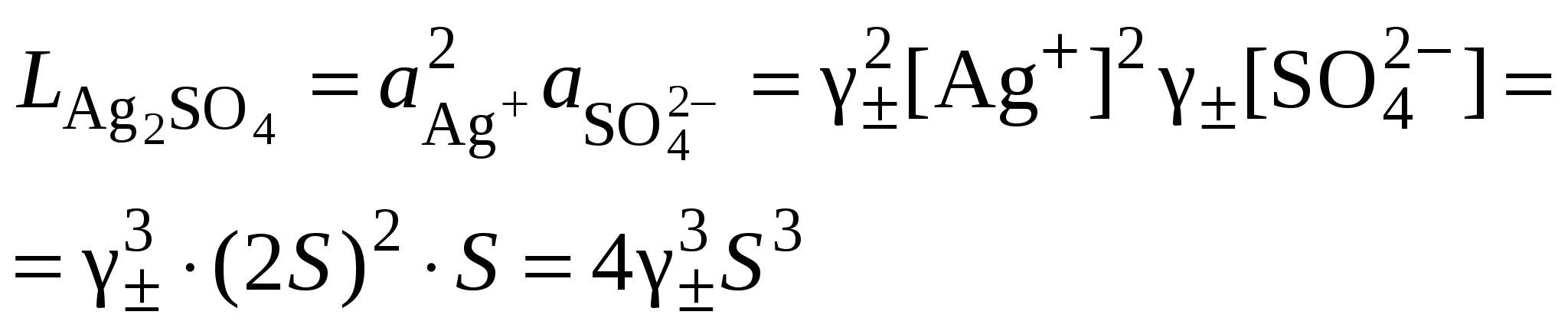 . .3. Вычислить ориентировочное значение растворимости Ag2SO4 принимая при этом значение 4. По найденному ориентировочному значению S0 вычислить ионную силу раствора 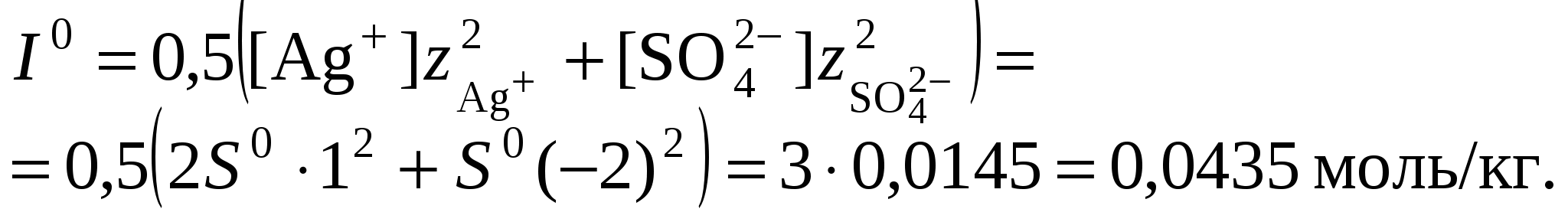 5. Вычислить средний ионный коэффициент активности 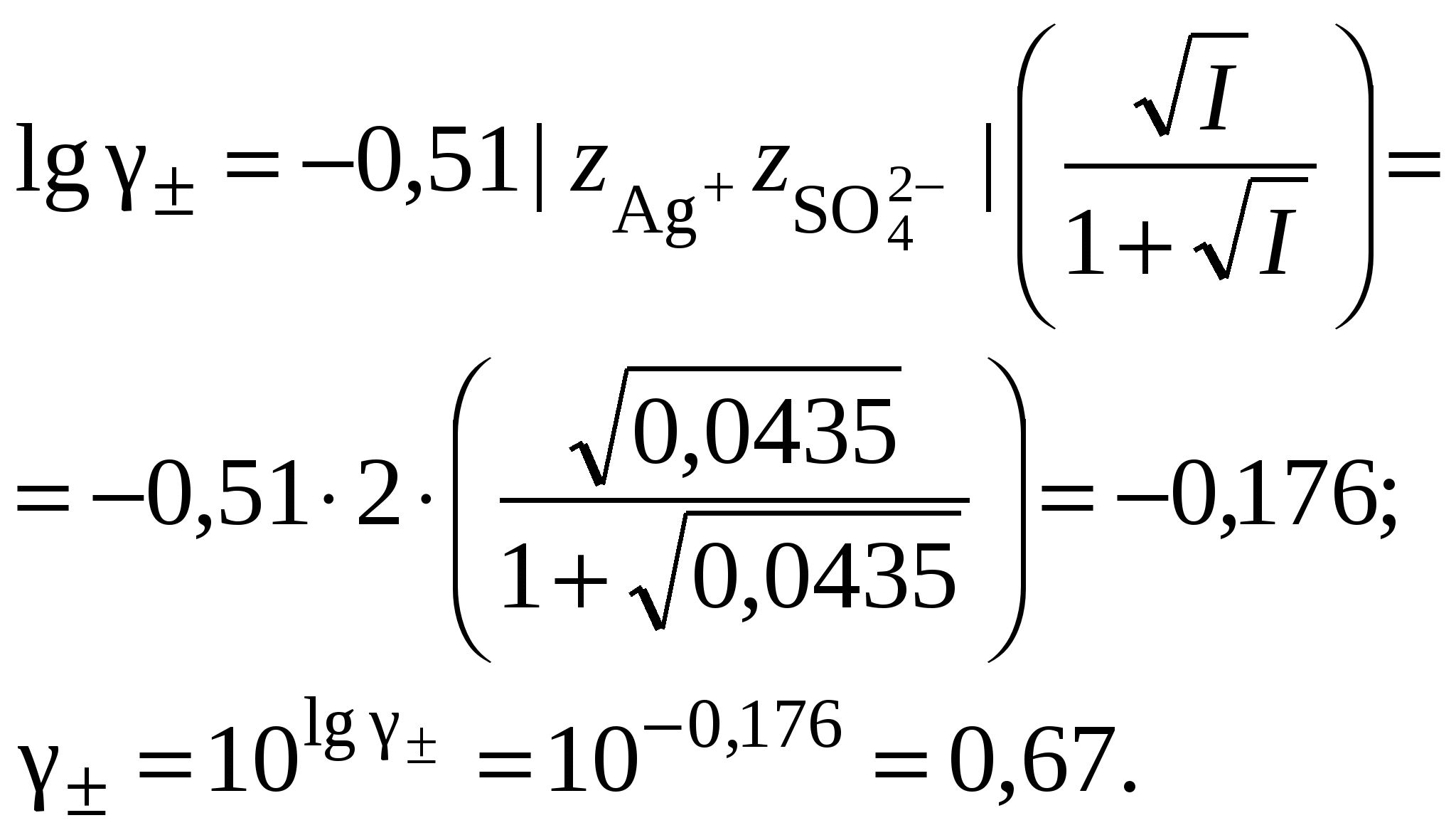 6. Вычислить растворимость сульфата серебра, учтя найденное значение среднего ионного коэффициента активности 7. По найденному ориентировочному значению SI вычислить ионную силу раствора 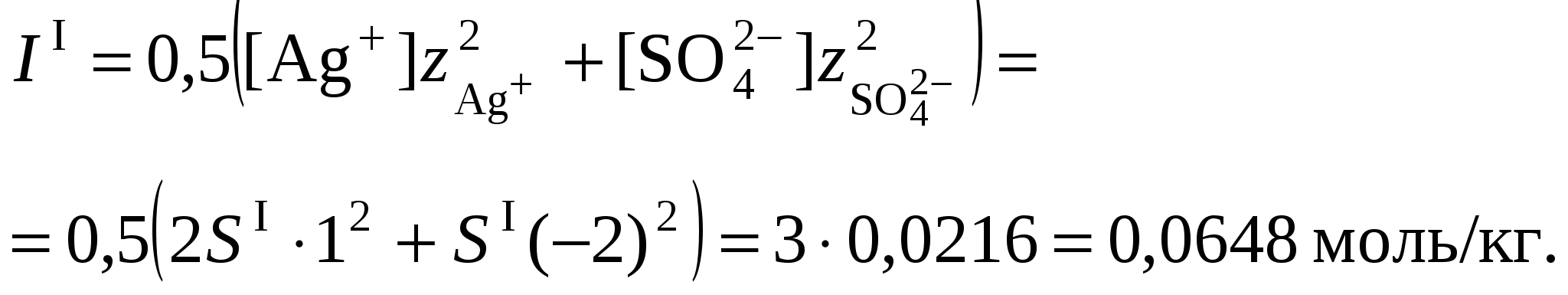 8. Вычислить средний ионный коэффициент активности 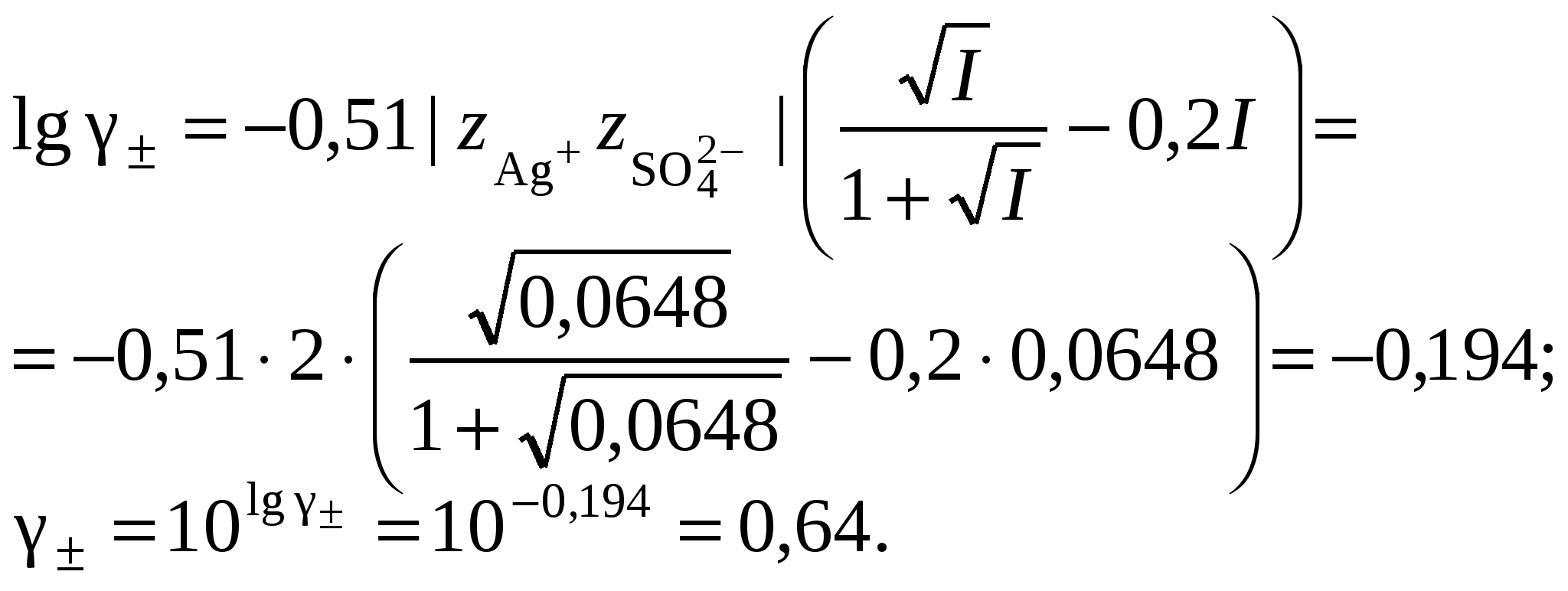 9. Уточнить растворимость сульфата серебра, учтя найденное значение среднего ионного коэффициента активности 10. Проверить правильность вычислений растворимости сульфата серебра. Для этого выполнить еще один цикл расчетов ионной силы раствора, среднего ионного коэффициента активности и значения растворимости 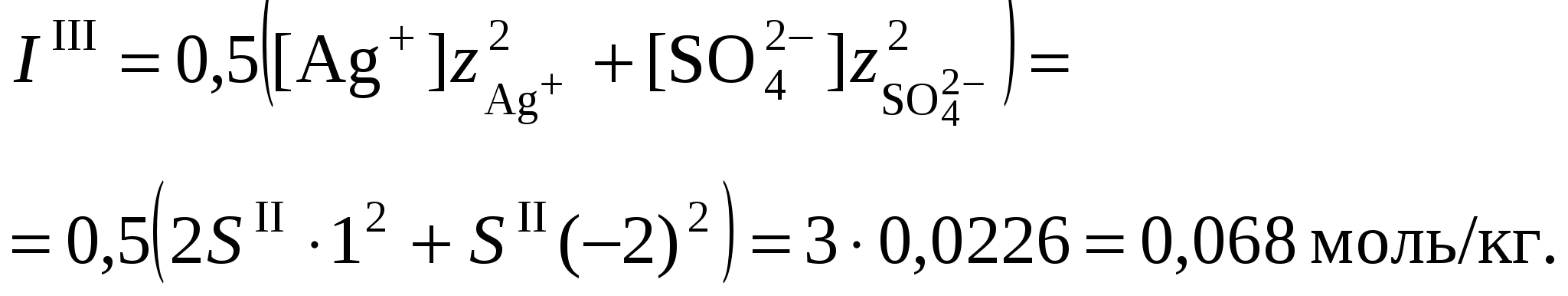 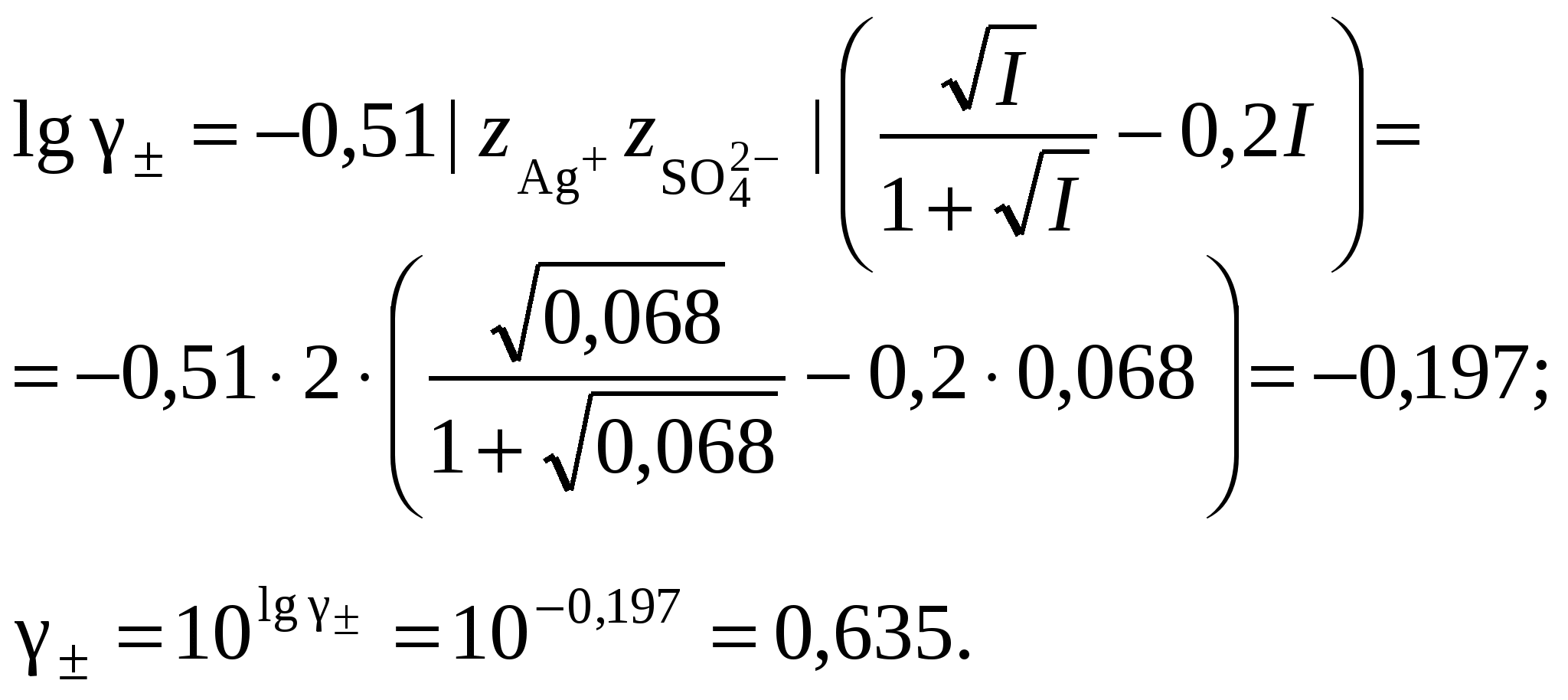 11. Так как значения SII и SIII не совпали, следует проделать еще один цикл вычислений 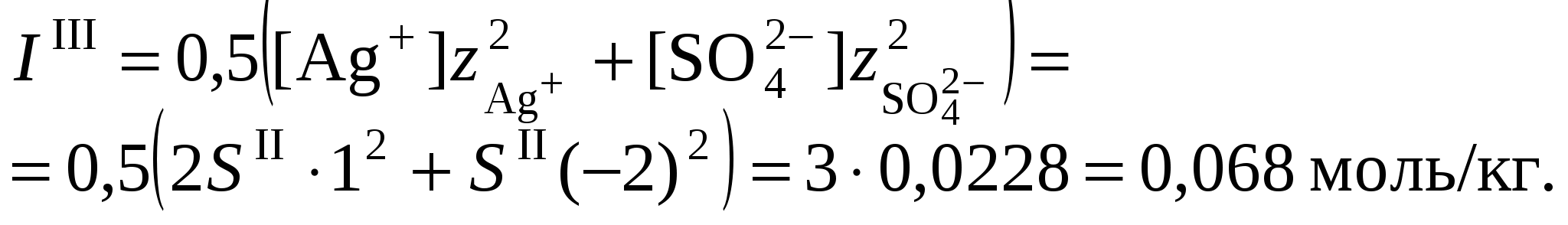 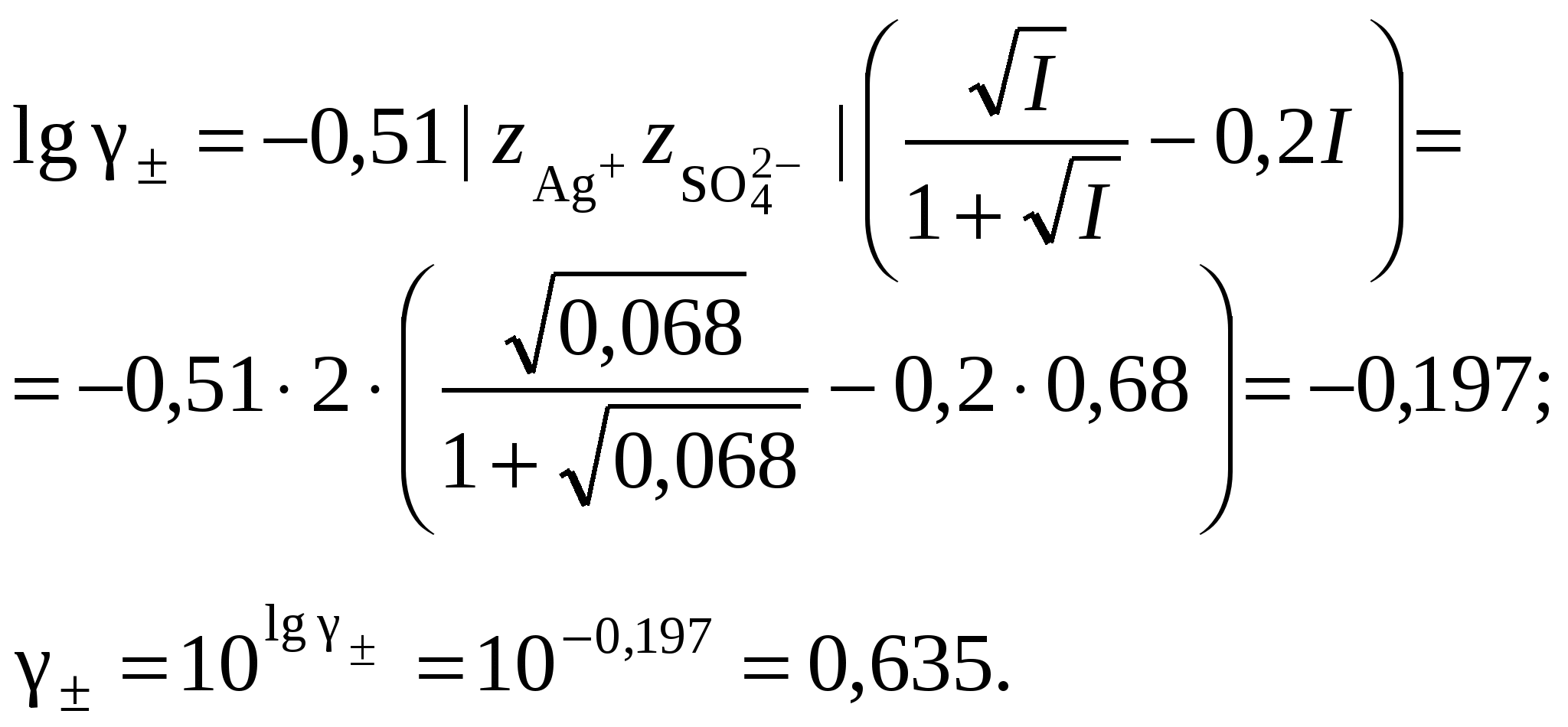 Значения SIII и SIV совпали, следовательно, расчеты можно остановить. В дальнейших вычислениях следует использовать растворимость сульфата серебра в воде, равную 0,0228 моль/кг. |
