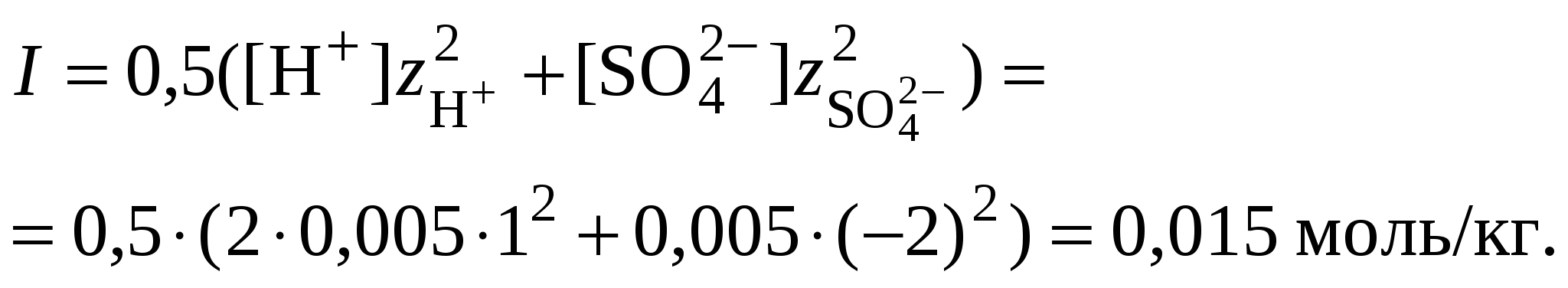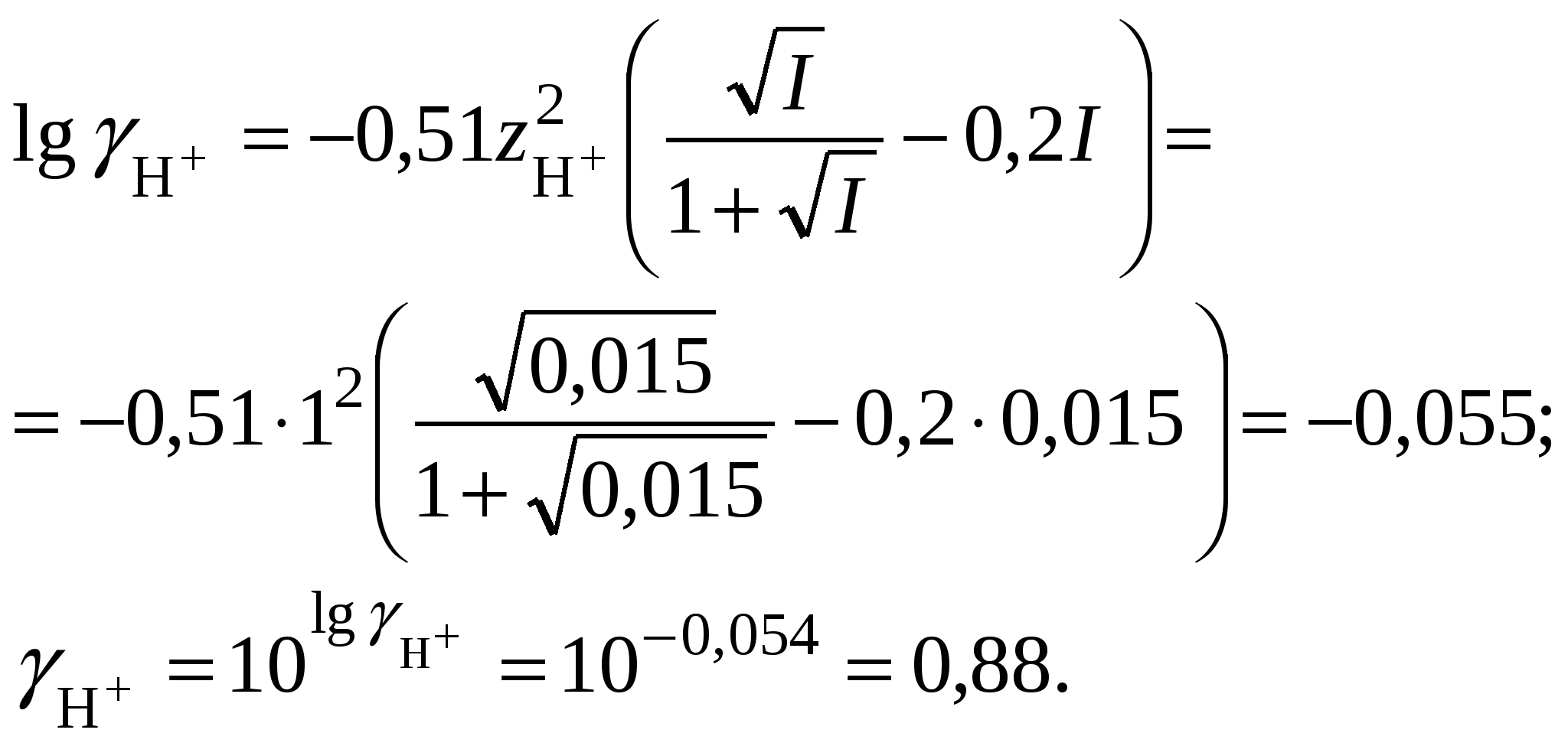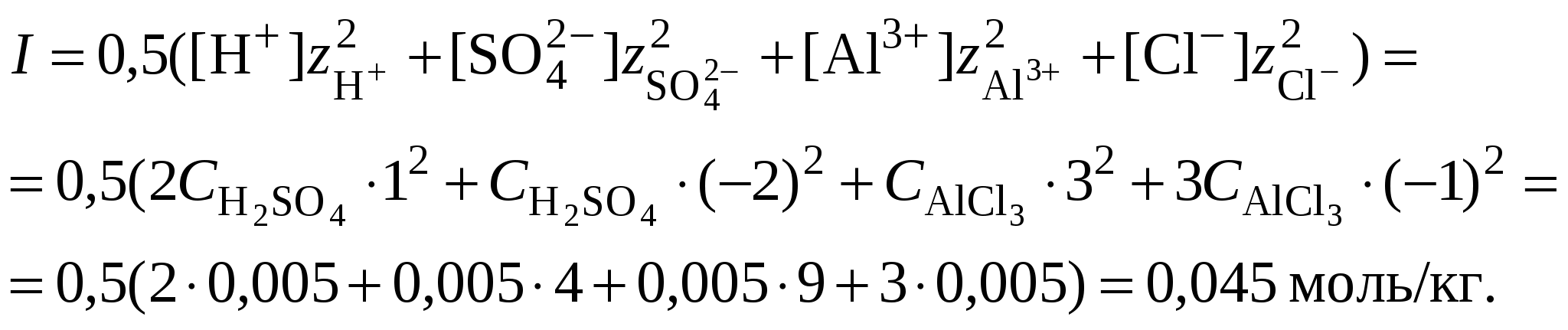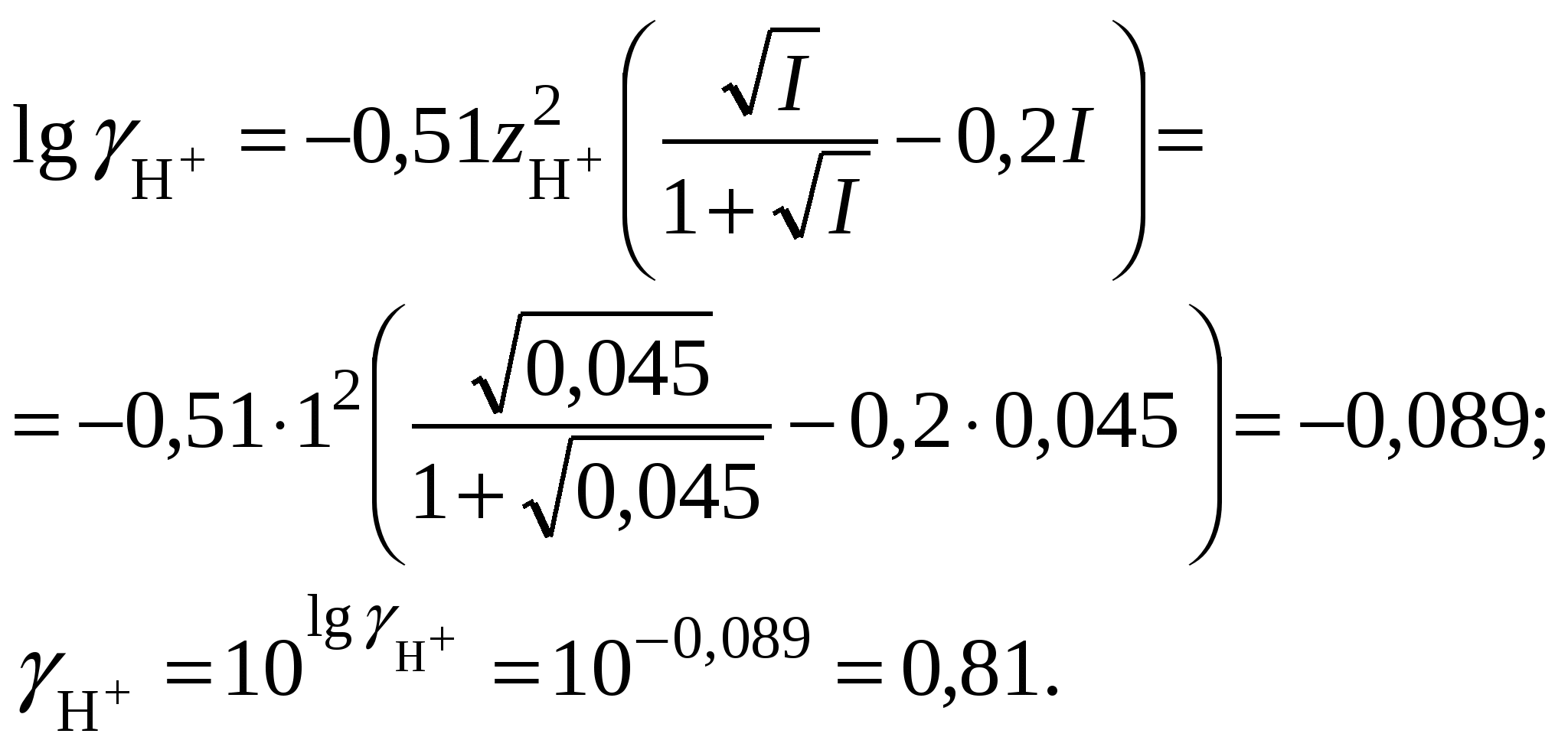Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма активности ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма активности ионов гидроксила:
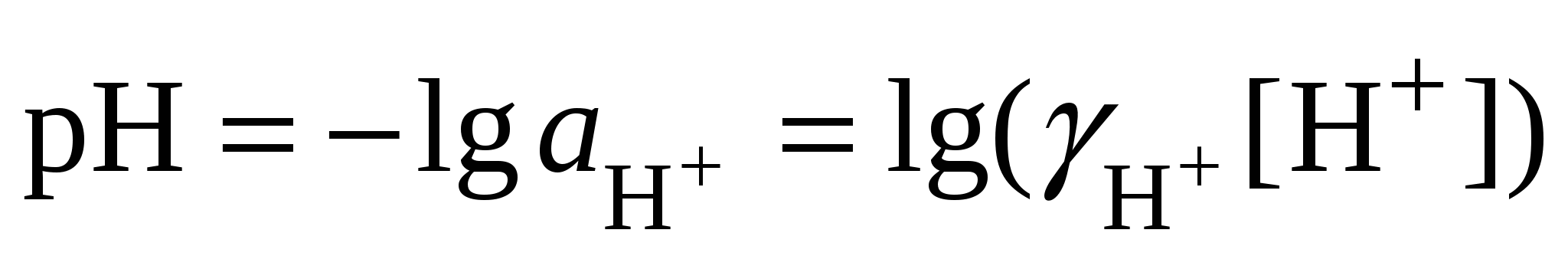 ; (2.1) ; (2.1)
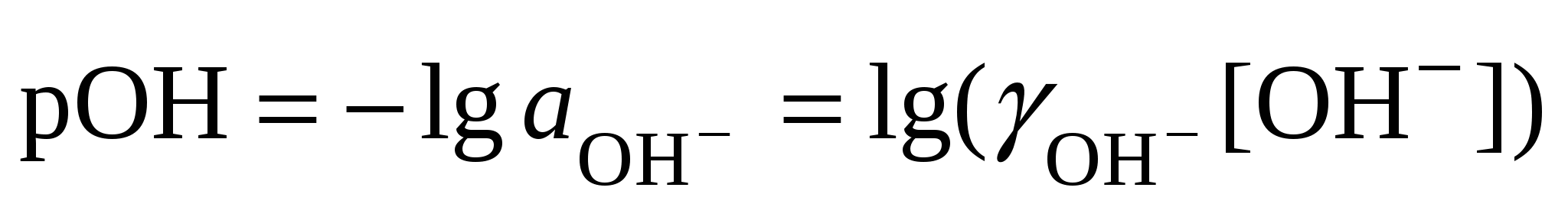 . (2.2) . (2.2)
рН + рОН = 14. (2.3)
2.1. Равновесия в растворах сильных кислот и оснований 2.1.1. Расчет рН в растворах сильных кислот и оснований
Для сильных кислот и щелочей, полностью диссоциированных на ионы,
Н+ = zCк и ОН = zCщ, (2.4)
где Ск и Сщ моляльные концентрации кислоты и, соответственно, щелочи, z основность кислоты или кислотность основания.
Пример 4.
Вычислить рН раствора серной кислоты концентрацией 0,005 моль/кг в воде и в растворе хлорида алюминия концентрацией 0,005 моль/кг.
Решение. 1. Составить уравнение диссоциации серной кислоты:
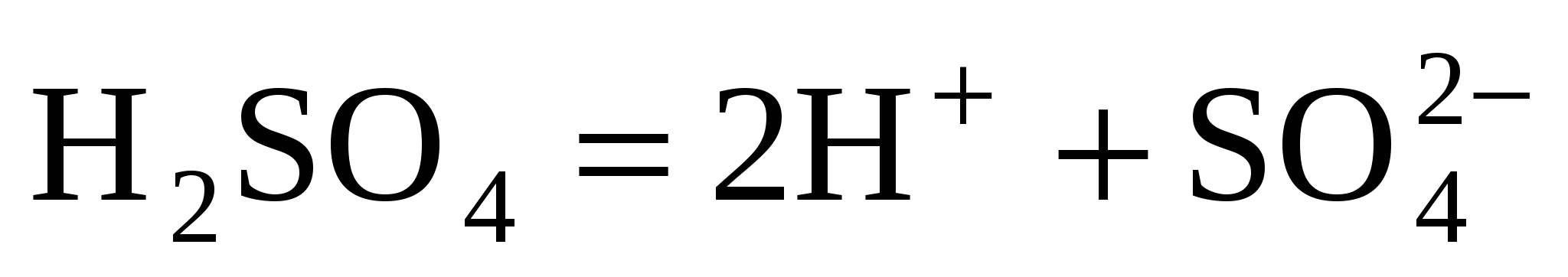 . .
2. Согласно уравнению диссоциации концентрация катионов водорода 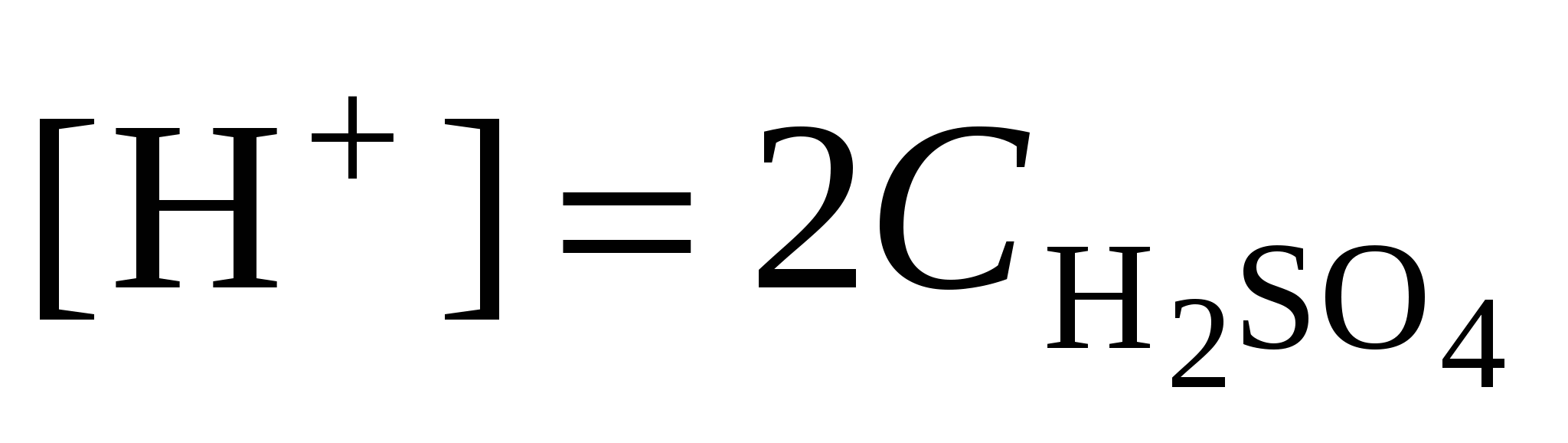 , концентрация сульфат-ионов , концентрация сульфат-ионов 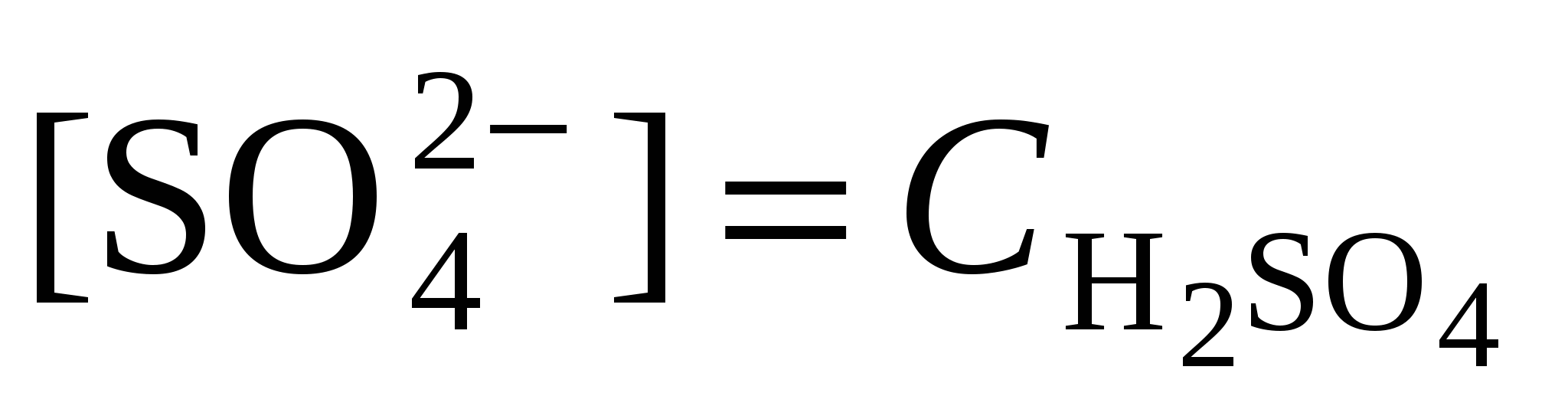 . .
3. Оценить рН раствора по концентрации катионов водорода:
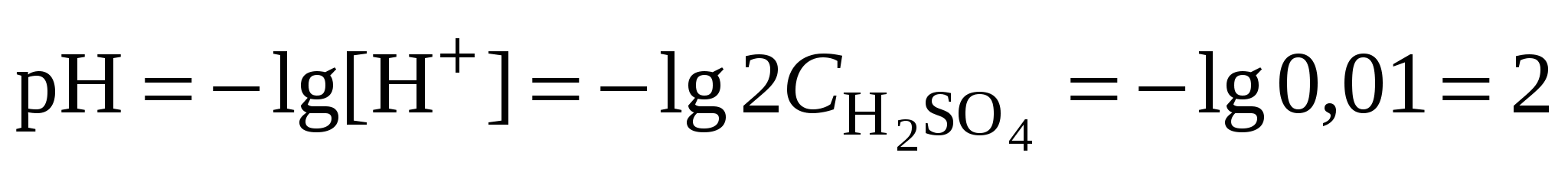 . .
4. Вычислить ионную силу раствора:
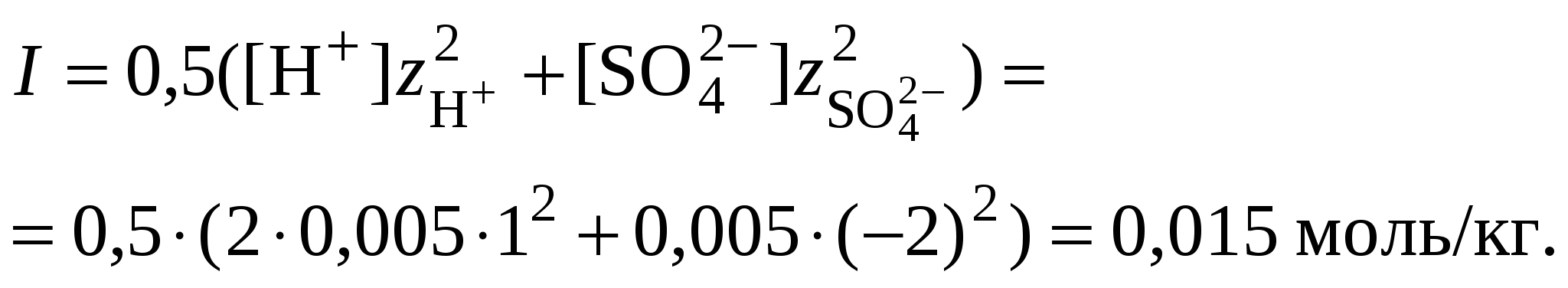
5. Вычислить значение коэффициента активности катионов водорода:
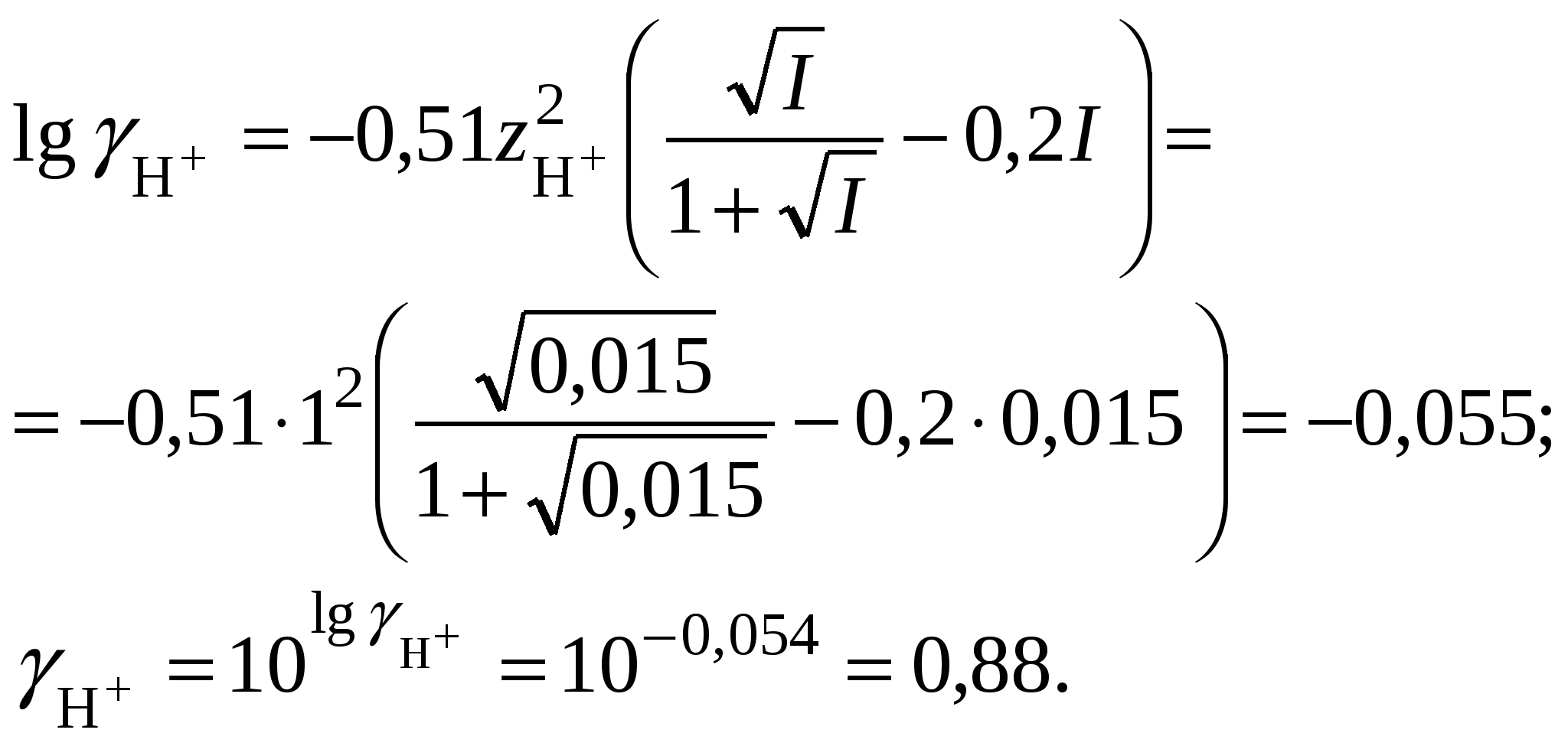
6. Вычислить значение активности катионов водорода в растворе серной кислоты:
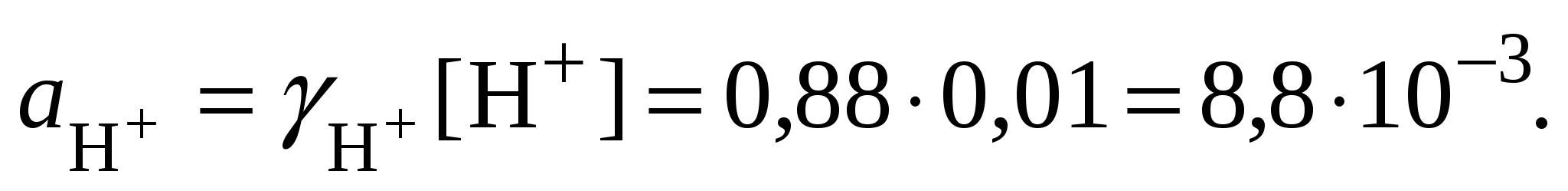
7. Вычислить значение рН:
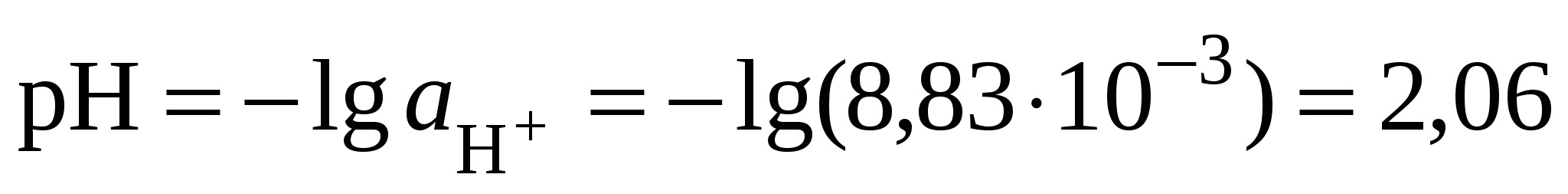 . .
8. Вычислить ионную силу раствора, содержащего серную кислоту и хлорид алюминия
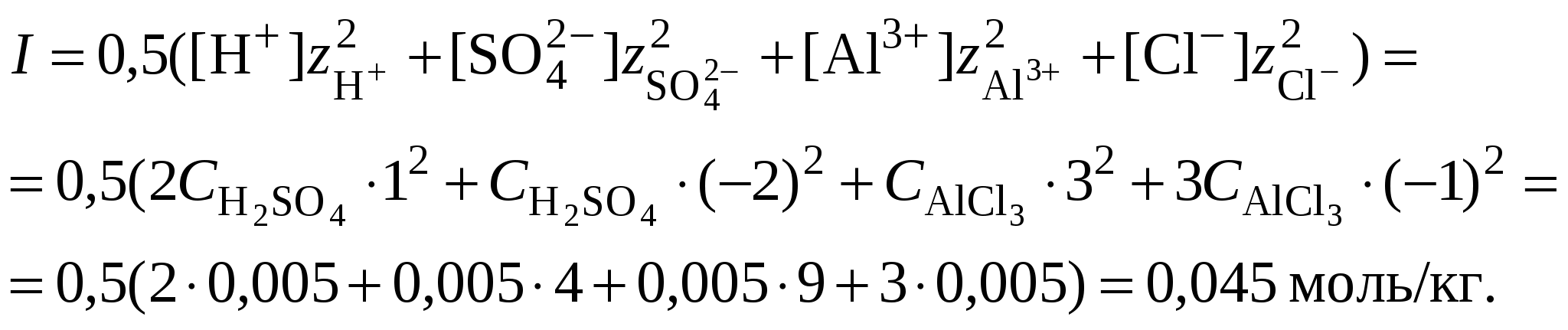
9. Вычислить коэффициент активности катионов водорода
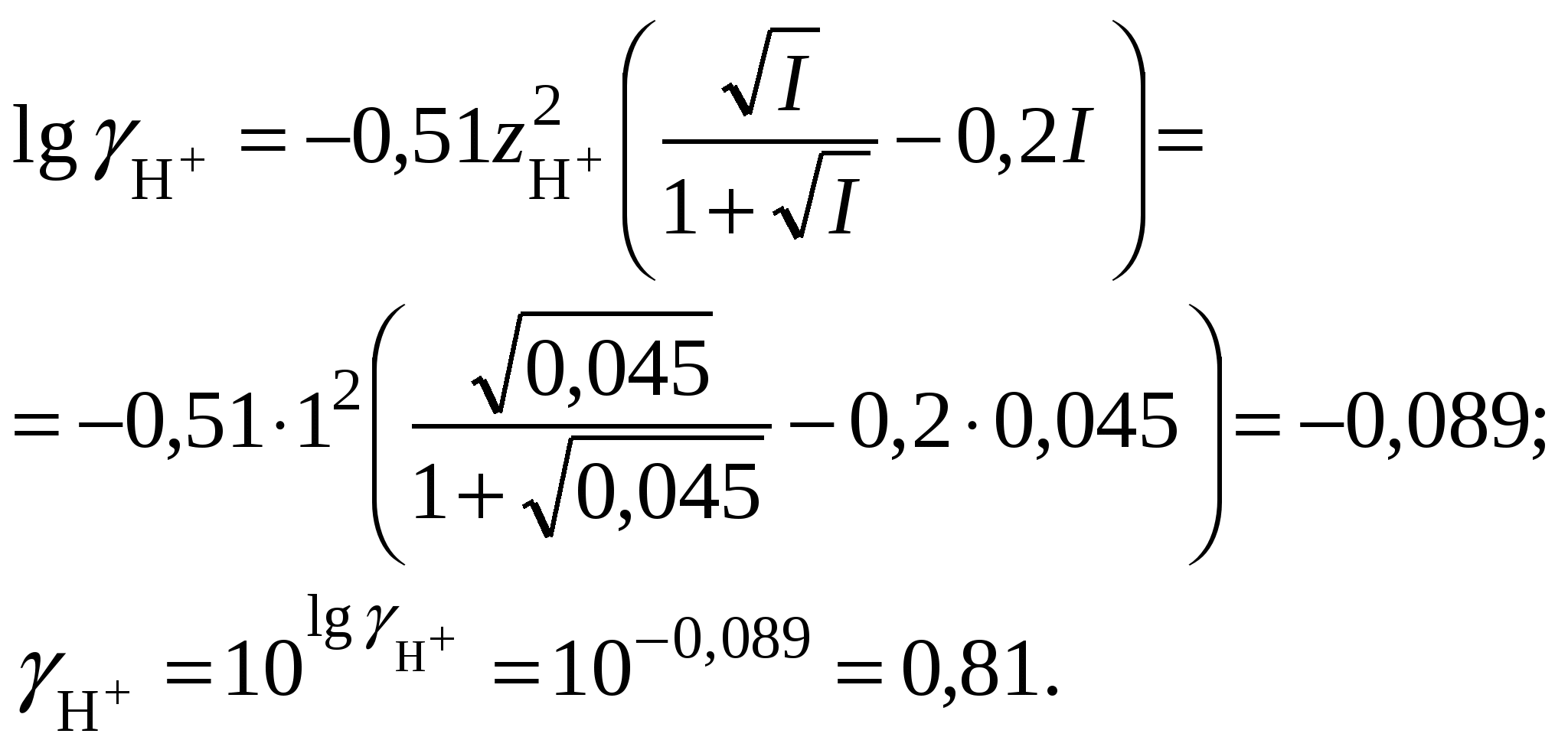
10. Вычислить рН раствора серной кислоты в присутствии хлорида алюминия
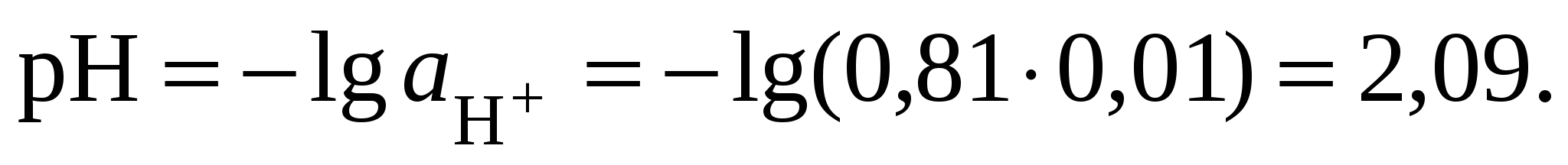
Вывод: увеличение ионной силы раствора приводит к снижению активности катионов водорода и снижению рН.
Задачи для решения
I. Вычислить рН раствора сильного электролита в воде и в присутствии индифферентного электролита
№
|
Электролит 1
|
С
|
Электролит 2
|
С2
|
d
|
|
Ba(OH)2
|
0,5 %
|
NaCl
|
2 %
|
|
|
Ba(OH)2
|
1 %
|
NaNO3
|
3 %
|
|
|
Ba(OH)2
|
0,01 М
|
KCl
|
5 %
|
|
|
Ba(OH)2
|
0,05 г/л
|
KNO3
|
5 %
|
|
|
Ba(OH)2
|
0,1 г/л
|
CaCl2
|
3 %
|
|
|
Ca(OH)2
|
0,07 %
|
Ca(NO3)2
|
3 %
|
|
|
Ca(OH)2
|
0,02 н.
|
BaCl2
|
5 %
|
|
|
Ca(OH)2
|
0,03 %
|
Ba(NO3)2
|
5 %
|
|
|
Ca(OH)2
|
0,09 г/л
|
NaCl
|
1 %
|
|
|
CsOH
|
0,05 %
|
NaNO3
|
3 %
|
|
|
CsOH
|
2 %
|
KCl
|
1,5 %
|
|
|
KOH
|
0,577 %
|
KNO3
|
2 г/л
|
|
|
KOH
|
0,001 н.
|
CaCl2
|
3 г/л
|
|
|
KOH
|
5,8 г/л
|
Ca(NO3)2
|
5 г/л
|
|
|
KOH
|
3 г/л
|
BaCl2
|
5 г/л
|
|
|
KOH
|
4 г/л
|
Ba(NO3)2
|
3 г/л
|
|
|
LiOH
|
0,008 н.
|
Na2SO4
|
4 г/л
|
|
|
LiOH
|
1 %
|
K2SO4
|
2 г/л
|
|
|
LiOH
|
1,6 %
|
LiCl
|
1 г/л
|
|
|
NaOH
|
2,5 г/л
|
LiNO3
|
2 %
|
|
|
NaOH
|
0,5 %
|
NaCl
|
3 %
|
|
|
NaOH
|
3 %
|
NaNO3
|
5 %
|
|
|
NaOH
|
1 %
|
KCl
|
5 %
|
|
|
RbOH
|
0,5 %
|
KNO3
|
3 %
|
|
|
RbOH
|
4 г/л
|
CaCl2
|
3 %
|
|
|
RbOH
|
0,3 г/л
|
Ca(NO3)2
|
5 %
|
|
|
Sr(OH)2
|
2 %
|
BaCl2
|
5 %
|
|
|
Sr(OH)2
|
1,73 %
|
Ba(NO3)2
|
1 %
|
|
|
Sr(OH)2
|
5104 М
|
KCl
|
3 %
|
|
|
Sr(OH)2
|
0,05 г/л
|
KNO3
|
1,5 %
|
|
|
H2SO4
|
0,1 н.
|
LiCl
|
2 г/л
|
|
|
H2SO4
|
0,5 %
|
LiNO3
|
3 г/л
|
|
|
H2SO4
|
0,005 М
|
Al2(SO4)3
|
5 г/л
|
|
|
H2SO4
|
0,6 %
|
FeCl3
|
5 г/л
|
|
|
H2SO4
|
0,3 %
|
CuSO4
|
3 г/л
|
|
|
H2SO4
|
0,03 н.
|
Cu(NO3)2
|
4 г/л
|
|
|
H2SO4
|
0,0012 М
|
FeSO4
|
2 г/л
|
|
|
H2SO4
|
0,1 %
|
NaCl
|
1 г/л
|
|
|
H2SO4
|
1,73 %
|
NaNO3
|
2 %
|
|
|
HCl
|
1,36 %
|
KCl
|
3 %
|
|
|
HCl
|
1,0 %
|
KNO3
|
5 %
|
|
|
HCl
|
0,3 %
|
CaCl2
|
5 %
|
|
|
HCl
|
0,01 н.
|
Ca(NO3)2
|
3 %
|
|
|
HCl
|
0,006 М
|
BaCl2
|
3 %
|
|
|
HCl
|
0,2 %
|
Ba(NO3)2
|
5 %
|
|
|
HCl
|
0,2 %
|
KCl
|
5 %
|
|
|
HBr
|
0,3 %
|
KNO3
|
1 %
|
|
|
HBr
|
0,01 н.
|
LiCl
|
3 %
|
|
|
HI
|
0,006 М
|
LiNO3
|
1,5 %
|
|
|
HI
|
0,2 %
|
Al2(SO4)3
|
2 г/л
|
|
|
HClO4
|
0,3 %
|
FeCl3
|
3 г/л
|
|
|
HClO4
|
0,8 %
|
CuSO4
|
5 г/л
|
|
|
HNO3
|
3 %
|
Cu(NO3)2
|
5 г/л
|
|
|
HNO3
|
0,7 %
|
NaCl
|
3 г/л
|
|
|
HNO3
|
0,05 г/л
|
NaNO3
|
4 г/л
|
|
|
HNO3
|
0,6 г/л
|
KCl
|
2 г/л
|
|
|
HNO3
|
0,06 г/л
|
KNO3
|
1 г/л
|
|
|
H2S2O3
|
5 г/л
|
KCl
|
4 г/л
|
|
|
H2S2O3
|
6 %
|
KNO3
|
2 г/л
|
|
|
H2S2O3
|
0,001 н.
|
LiCl
|
1 г/л
|
|
II. Вычислить рН конечного раствора при смешении электролитов. Плотность раствора принять равной 1.
|
Электролит 1
|
С
|
Электролит 2
|
С2
|
V1/V2
|
|
Ba(OH)2
|
0,5 %
|
Na2SO4
|
2 %
|
|
|
Ba(OH)2
|
1 %
|
K2SO4
|
3 %
|
|
|
Ba(OH)2
|
0,01 М
|
K2CrO4
|
5 %
|
|
|
Ba(OH)2
|
0,05 г/л
|
Na2CrO4
|
5 %
|
|
|
Ba(OH)2
|
0,1 г/л
|
K2Cr2O7
|
3 %
|
|
|
Ba(OH)2
|
0,5 %
|
Na2C2O4
|
3 %
|
|
|
Ba(OH)2
|
1 %
|
Na2CO3
|
5 %
|
|
|
Ba(OH)2
|
0,01 М
|
KMnO4
|
5 %
|
|
|
Ca(OH)2
|
0,07 %
|
K3PO4
|
3 %
|
|
|
Ca(OH)2
|
0,02 н.
|
Na2C2O4
|
5 %
|
|
|
Ca(OH)2
|
0,03 %
|
Na3PO4
|
5 %
|
|
|
Ca(OH)2
|
0,09 г/л
|
NaF
|
1 %
|
|
|
Ca(OH)2
|
0,1 %
|
Na2CO3
|
5 %
|
|
|
Ca(OH)2
|
1,73 %
|
K3PO4
|
1 %
|
|
|
Ca(OH)2
|
1,36 %
|
Na2C2O4
|
3 %
|
|
|
Sr(OH)2
|
4 г/л
|
Na2SO4
|
3 %
|
|
|
Sr(OH)2
|
0,3 г/л
|
K2SO4
|
5 %
|
|
|
Sr(OH)2
|
2 %
|
K2CrO4
|
5 %
|
|
|
Sr(OH)2
|
1,73 %
|
Na2CrO4
|
1 %
|
|
|
Sr(OH)2
|
5104 М
|
K2Cr2O7
|
3 %
|
|
|
Sr(OH)2
|
0,1 %
|
Na2CO3
|
5 г/л
|
|
|
Sr(OH)2
|
1,73 %
|
Na2C2O4
|
5 г/л
|
|
|
Sr(OH)2
|
1,36 %
|
NaF
|
3 г/л
|
|
|
H2SO4
|
0,05 г/л
|
BaCl2
|
1,5 %
|
|
|
H2SO4
|
0,1 н.
|
Ba(NO3)2
|
2 г/л
|
|
|
H2SO4
|
0,5 %
|
Mg(NO3)2
|
3 г/л
|
|
|
H2SO4
|
0,005 М
|
MgCl2
|
5 г/л
|
|
|
H2SO4
|
0,6 %
|
SrCl2
|
5 г/л
|
|
|
H2SO4
|
0,3 %
|
CeCl3
|
3 г/л
|
|
|
H2SO4
|
0,03 н.
|
Y(NO3)3
|
4 г/л
|
|
|
H2SO4
|
0,0012 М
|
Pb(NO3)2
|
2 г/л
|
|
|
H2SO4
|
0,1 %
|
AgNO3
|
1 г/л
|
|
|
HCl
|
1,73 %
|
Pb(NO3)2
|
2 %
|
|
|
HCl
|
1,36 %
|
AgNO3
|
3 %
|
|
|
HCl
|
1,0 %
|
Hg(NO3)2
|
5 %
|
|
|
HBr
|
0,2 %
|
Hg(NO3)2
|
5 %
|
|
|
HBr
|
0,2 %
|
Pb(NO3)2
|
3 %
|
|
|
HBr
|
0,3 %
|
AgNO3
|
3 %
|
|
|
HI
|
0,01 н.
|
Pb(NO3)2
|
5 %
|
|
|
HI
|
0,006 М
|
AgNO3
|
5 %
|
|
|
HI
|
0,2 %
|
Hg(NO3)2
|
1 %
|
|
|
HClO4
|
0,3 %
|
AgNO3
|
3 %
|
|
|
HClO4
|
0,8 %
|
Hg(NO3)2
|
1,5 %
|
|
|
H2Cr2O7
|
1,0 %
|
BaCl2
|
2 г/л
|
|
|
H2Cr2O7
|
0,2 %
|
Ba(NO3)2
|
3 г/л
|
|
|
H2Cr2O7
|
0,2 %
|
Pb(NO3)2
|
5 г/л
|
|
|
H2Cr2O7
|
3 %
|
AgNO3
|
5 г/л
|
|
|
H2CrO4
|
0,7 %
|
Pb(NO3)2
|
3 г/л
|
|
|
H2CrO4
|
0,05 г/л
|
AgNO3
|
4 г/л
|
|
|
H2CrO4
|
0,6 г/л
|
Hg(NO3)2
|
2 г/л
|
|
|
HMnO4
|
0,06 г/л
|
Ba(NO3)2
|
1 г/л
|
|
|
H2S2O3
|
5 г/л
|
Pb(NO3)2
|
4 г/л
|
|
|
HIO3
|
6 %
|
NiSO4
|
2 г/л
|
|
|
HIO3
|
0,001 н.
|
Pb(NO3)2
|
1 г/л
|
|
|
HIO3
|
6 %
|
BaCl2
|
6 г/л
|
|
|
HIO3
|
0,001 н.
|
Ba(NO3)2
|
3 %
|
|
|
H2WO4
|
0,6 г/л
|
Cu(NO3)2
|
5 %
|
|
|
H2WO4
|
0,001 н.
|
Pb(NO3)2
|
5 %
|
|
|
H2WO4
|
1,36 %
|
AgNO3
|
1 %
|
|
|
H2WO4
|
1,0 %
|
Ca(NO3)2
|
3 %
|
|
III. Вычислить рН раствора по приведенным ниже данным.
После выщелачивания боксита по следующим данным: масса руды 1 т; ω(Al2O3∙Н2O) = 80 %; V(NaOH)=3,1 м3; ω(NaOH)=15 %.
Если к 20 л раствора соляной кислоты концентрацией 10 % (d = 1,047 г/мл) было добавлено 5 м3 раствора гидроксида кальция концентрацией 0,02 экв/л.
Содержащего 4 г KOH и 5 г NaOH в одном литре воды.
Содержащего 0,005 моль/л серной кислоты и 0,006 моль/л соляной кислоты.
После выщелачивания руды по следующим данным: масса руды = 1 т; ω(Li2O∙Al2O3∙4SiO2)=70 %; V(H2SO4)=4 м3; ω(H2SO4)=5% (d=1,032 г/мл); уравнение реакции: Li2O∙Al2O3∙4SiO2 + H2SO4 = Li2SO4 + Al2O3∙4SiO2∙H2O↓.
После выщелачивания руды при следующих условиях: масса руды – 1 т, в ней содержится 6 % Cu4(SO4)(OH)6; ω(H2SO4)=3 %, d=1,03 г/мл, V(H2SO4)=3 м3.
Полученного при разбавлении 20 л 10 % соляной кислоты (d=1,047 г/мл) пятью кубометрами воды.
Азотнокислых стоков, если 10 л 5 % азотной кислоты сброшены в резервуар с водой емкостью 5 м3.
10 м3 раствора, содержащего по 50 г серной и дихромовой кислот.
Содержашего дихромовую кислоту (2 мг/мл Cr (VI)) и азотную кислоту (1 мг/мл).
После смешивания 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л.
Найти объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствора с рН = 4,03.
После смешивания 2 л серной кислоты концентрацией 0,01 моль/л и 3 л щелочи с рН=12,5.
После смешивания 0,2 л 0,5 н. HCl и 0,3 л 0,3 М NaOH.
После смешивания 200 мл 0,5 н. раствора серной кислоты и 300 мл раствора едкого натра с концентрацией 0,3 моль/л.
После смешивания 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты.
После смешивания 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария.
После смешивания 100 мл 0,2 % раствора едкого натра (NaOH) и 200 мл 0,1 % раствора NaOH.
После смешивания 200 мл 0,7 н. раствора серной кислоты и 3000 г воды.
После смешивания 54 мл 0,5 % раствора NaOH и 10 мл 0,2 % раствора NaOH.
После смешивания 500 мл 0,3 % раствора КОН и 500 мл воды?
После смешивания 4 мл 0,46 % серной кислоты и 200 мл серной кислоты, концентрацией 0,001 моль/л.
После смешивания 8 л раствора соляной кислоты концентрацией 0,04 моль/л и 11 л раствора ее же концентрацией 2 г/л.
После смешивания 30 мл раствора, содержащего 0,109 г серной кислоты в 100 мл раствора, и 40 мл раствора NaOH, содержащего 0,098 г гидроксида натрия в 100 мл раствора.
После смешивания 10 мл 0,12 % раствора HCl и 10 мл 0,076 % раствора HCl.
После смешивания 10 мл 6 % раствора соляной кислоты плотностью 1,03 г/см3 и 10 мл 1 % раствора гидроксида бария плотностью 1,0 г/см3.
После смешивания 31 мл 0,16 н. раствора щелочи и 317 мл 0,02 н. раствора серной кислоты.
После смешивания 150 мл 0,4 н. раствора соляной кислоты и 250 мл 0,2 н. раствора гидроксида натрия.
После смешивания 4 мл серной кислоты концентрацией 40 % (плотность 1,303 г/см3) и 200 мл серной кислоты, концентрацией 0,001 моль/л.
После смешивания 8 л раствора соляной кислоты концентрацией 4 моль/л и 11 л раствора ее же концентрацией 2 г/л.
После смешивания 30 мл раствора, содержащему 10 г серной кислоты в 100 мл раствора, и 40 мл раствора NaOH, содержащего 9 г гидроксида натрия в 100 мл раствора.
После смешивания 500 мл раствора силиката натрия концентрацией 11 г/л и 500 мл раствора серной кислоты концентрацией 4,6 г/л. Дополнительно определить массу оксида кремния.
После смешивания 500 мл раствора гидроксида бария концентрацией 1,5 % (плотность 1,008 г/см3) и 300 мл 2 % раствора серной кислоты (плотность 1,012 г/см3).
После смешивания 500 мл 4 % раствора гидроксида натрия (плотность 1,043 г/см3) и 30 мл 2 % раствора серной кислоты (плотность 1,012 г/см3).
После смешивания 2 г гидроксида алюминия и 350 мл 1 % раствора соляной кислоты.
После смешивания 100 м3 раствора хлорида кальция концентрацией 2 г/л и равного объема серной кислоты концентрацией 5 г/л.
После смешивания 5 м3 раствора хлорида бария концентрацией 1,5 % (плотность 1,5 г/см3) и 3 м3 серной кислоты концентрацией 2 % (плотность 1,012 г/см3).
После смешивания 5 г карбоната магния и 150 мл раствора азотной кислоты, концентрацией 4 % (плотность 1,01 г/см3).
После смешивания 1,5 л раствора гидроксида натрия концентрацией 4 г/л и 0,5 л гахзообразного хлороводорода (н.у.).
После смешивания 1,5 л 0,2 М раствора гидроксида кальция и 0,5 л углекислого газа (25°С, 1 атм.).
После смешивания 45 мл 0,3 н. раствора соляной кислоты и раствора, содержащий 0,32 г гидроксида натрия в 40 мл.
После смешивания одного литра раствора, содержащего 1,4 г гидроксида калия, и 60 мл 0,5 н. раствора серной кислоты.
После смешивания 1 л раствора азотной кислоты, содержащего 0,882 г кислоты и 40 мл 0,4 н. раствора гидроксида натрия. Прошла ли нейтрализация?
После смешивания 15 миллилитров 1 н. раствора едкого натра и 320 мл 0,1 М раствора серной кислоты.
После смешивания 20 мл раствора сульфата меди, в 1 л которого содержится 10 г меди, и 100 миллилитров 0,1 н. едкого натра (NaOH).
После смешивания 2 л раствора, содержащего 8,5 г гидроксида бария и 32 мл 10 % соляной кислоты плотностью 1,047 г/ см3.
После смешивания раствора гидроксида бария с концентрацией 100 г/л и 0,5 н. соляной кислоты в объемном отношении 1:2.
После смешивания 20 мл 0,2 н. раствора едкого кали и 13 мл 0,2 н. раствора кислоты.
После смешивания 20 мл 0,1 М раствора серной кислоты и 8 мл 0,5 н. раствора гидроксида натрия.
После смешивания 60 мл 0,2 н. раствора серной кислоты и раствора, содержащего 0,51 г гидроксида калия в 30 мл.
Хлороводород, образовавшийся при действии серной кислоты на 19 г безводного хлорида магния, пропустили в раствор объемом 500 мл, содержащий 10 г гидроксида калия. Найти рН полученного раствора.
После смешивания двух растворов объемом 0,5 л, содержащие 8,55 г нитрата свинца (II) и 3,75 г соляной кислоты.
Какое вещество, и в каком количестве останется в избытке в результате реакции между 14 г оксида кальция и 1 л раствора, содержащим 32 г азотной кислоты? Найти рН полученного раствора. Плотность раствора принять равной 1,02 г/см3.
Какое вещество, и в каком количестве останется в избытке в результате реакции между 4 г оксида магния и 10 г серной кислоты? Найти рН полученного раствора. Объем раствора серной кислоты – 0,5 л. Плотность раствора 1,01 г/см3.
Горячий KOH реагирует с хлором по реакции: 6 KOH + 3 Cl2 5 KCl + KClO3 + 3 H2O. Найти рН раствора после поглощения 0,8 л хлора (7°С и 98,64 кПа) 0,1 М раствором гидроксида калия объемом 600 мл.
Сколько граммов гидроксида железа выпадет в осадок, если к 500 мл 0,2 н. раствора хлорида железа (III) (плотность 1,03 г/см3) добавить 5 г гидроксида натрия? Вычислить pH раствора после реакции.
После смешивания 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л.
Найти объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствора с рН = 4,03.
После смешивания 10 мл 6 % раствора соляной кислоты плотностью 1,03 г/см3 и 10 мл 1 % раствора гидроксида бария плотностью 1,0 г/см3.
. После смешивания 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты.
|
 Скачать 0.98 Mb.
Скачать 0.98 Mb.