Химия Шпоры. 1. Сформулируйте определения понятий химический элемент, атом, молекула, ион, вещество. Хим элемент
 Скачать 302 Kb. Скачать 302 Kb.
|
|
32.Металлы и их классификация по периодической системе. Физические и химические свойства металлов. Хар-ые св-ва металлов: Мет связь в кристаллах, Метал блеск, Хорошие теплопроводность и электрическая проводимость,Ковкость и пластичность, Восстановители, Оксиды имеют ионный характер и при растворении в воде образуют основные растворы Граница между металлами и неметаллами размыта, между ними находятся полуметаллы (рис. 11.1). Полуметаллы обл-ют св-ми как металлов, так и неметаллов. Напр, серый мышьяк имеет метал блеск и электрическую проводимость, однако он хрупок, а желтый мышьяк - имеет чисто неметаллические свойства.  Физ свойства металлов. Как было показано в гл. 4, находящиеся в металлической решетке ионы связаны друг с другом не-локализованными подвижными электронами. Разность энергии молекулярных орбиталей в зоне проводимости металла невелика, поэтому электроны, возбуждаясь, относительно легко переходят из одной ор-битали в другую. Этим объясняется высокие электрическая проводимость и теплопроводность металлов. Максимальную электрическую проводимость имеют серебро, медь, золото и алюминий. Ионы металлов в кристалле могут скользить относительно друг друга. Этим объясняется ковкость (способность к расплющиванию) и пластичность (способность вытягиваться в проволоку и ленту). Физико-хим свойства металлов. Вследствие ненасыщенности и ненаправленности металлической связи для кристаллических решеток металлов характерна высокая плотность упаковки. Больш-во металлов кристаллизуется с обр-ем гексагональных или кубических (гранецентрированных или объемно центрированных) решеток. Так как разница энергий решеток металлов относительно невелика, то большинство металлов полиморфны. 33.Металлические сплавы и композиты. Металлические сплавы — вещ-ва, обладающие метал-ми свойствами и состоящие из двух или более элементов, из кот хотя бы один явл металлом. Их получают охлаждением расплавленных смесей, совместным осаждением из газовой фазы, электроосаждением из растворов и расплавов, диффузионным насыщением. Свойства сплавов значительно отличаются от свойств металлов. Например, прочность на разрыв сплава меди и цинка (латуни) в три раза выше, чем у меди и в шесть раз по сравнению с цинком. Железо хорошо растворимо, а его сплав с хромом и никелем (нержавеюща сталь) - устойчив в разбавленной серной кислоте. Различают однофазные сплавы (твердые растворы), механические смеси и химические соединения (интерметаллиды). Композиционные материалы. Керметы. Композиционные материалы (композиты) получают объемным сочетанием химически разнородных компонентов при сохранении границы раздела между ними. Свойства композитов существенно отличаются от свойств входящих в них компонентов. Композиционные материалы состоят из основы (матрицы) и добавок (порошков, волокон, стружки и т.д.). Композиты характеризуются высокой прочностью, твердостью, износостойкостью. Например, предел прочности на растяжение композита, состоящего из железного порошка и нитевидных кристаллов оксида алюминия в три раза выше, чем у неармированного железа. В пять раз возрастает усталостная прочность меди при ее армировании волокнами вольфрама. Композиты широко используются в качестве конструкционных материалов, материалов износостойких контактов, подшипников, штампов и инструментов. Многие из них обладают жаростойкостью, поэтому служат огнеупорами, материалами чехлов термопар, испарителей металлов, тепловыделяющих элементов, аварийных стержней в атомной энергетике и др. 34.Органические полимерные материалы. Методы получения полимеров. Полимеры - высокомолекулярные соединения, которые характеризуются молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров, называемые также макромолекулами, состоят из большого числа повторяющихся звеньев. Вследствие большой молекулярной массы макромолекул полимеры приобретают некоторые специфические свойства. Поэтому они выделены в особую группу химических соединений. Отдельную группу также составляют олигомеры, которые по значению молекулярной массы занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями. Различают неорганические, органические и элементоорганиче-ские полимеры. Органические полимеры, в свою очередь, подразделяют на природные и синтетические. В настоящей главе рассматриваются в основном органические синтетические полимеры. Полимеры получают методами полимеризации или поликонденсации. Полимеризация (полиприсоединение). Это реакция образования полимеров путем последовательного присоединения молекул низкомолекулярного вещества (мономера). Полимеризация — самопроизвольный экзотермический процесс (G<0, H<0 ), так как разрыв двойных связей ведет к уменьшению энергии системы. Реакция синтеза полимера из соединений, имеющих две или более функциональные группы, сопровождающаяся образованием низкомолекулярных продуктов (Н2О, NH3, HCl, СН2О и др.), называется поликонденсацией. 28.Электролиз. Сущность процесса электролиза. Факторы, определяющие последовательность разряда ионов на электродах. Электролизом наз процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита. Электрод, на кот идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. Сu2+ + 2е = Сu0. Последовательность разрядки ионов на аноде зависит как от природы аниона, так и от вещества, из которого сделан анод. Различают нерастворимые (инертные) аноды и растворимые (активные). К первым относят электроды из угля, графита, платины, ко вторым - из металлов. На инертных анодах окисляются в первую очередь элементарные ионы в порядке возрастания величины стандартного электродного потенциала, т. е. чем меньше 0, тем легче ионы окисляются (S2-, I-, Вг-, Сl-). При наличии кислородсодержащих ионов на аноде окисляются молекулы воды: 2Н2О - 4е = О2 + 4Н+ (рН <, 7) или гидроксильные ионы: 4ОН- - 4е = О2 + 2Н2О (рН>7). 29.Электролиз расплавов и растворов электролитов. Сложные кислородсодержащие ионы из водных растворов, практически, не окисляются. На активных электродах при электролизе будет окисляться кислород. Рассмотрим электролиз с нерастворимым анодом водных растворов солей Na2SO4 и NaCl: а)в растворе Na2SO4 имеются ионы: Na+, SO42-, Н+, ОН-: Na2SO4 2Na+ +SO42-, H2O Н+ + ОН- (рН = 7). К (-) | Na2SO4, H2O | (+) А. Na+SO42-Н2О Н2О К (-): 2Н2О + 2е = Н2 + 2ОН-, А(+):2Н2О-4е = О2 + 4Н+ Суммарной является реакция разложения воды: 2Н2О 2Н2 + О2; б)в растворе NaCl имеются ионы: Na+, Сl-, Н+, ОН-: NaCl Na+ + Сl-, Н2О Н+ + ОН-. К (-): 2Н2О + 2е = Н2 + 2ОН-, А(+):2Сl- - 2е = С12. 2Н2О + 2Сl- = Н2 + 2ОН- + С12, 2Н2О + 2NaCl = Н2 + 2NaOH + С12. Количество вещества, подвергшегося электрохимическим превращениям, зависит от количества электричества, прошедшего через электролит. 30.Коррозия металлов. Виды коррозии. Коррозия - это самопроизвольный процесс разрушения металлов под влиянием внешней среды.Причиной коррозии является более низкая термодинамическая стабильность металлов, чем их соединений (оксидов, гид-роксидов, солей). По механизму протекания коррозийного процесса различают химическую коррозию и электрохимическую коррозию. Химическая коррозия характерна для сред, не проводящих электрический ток. По условиям протекания коррозийного процесса различают: а)газовую коррозию - в газах, парах без конденсации влаги на поверхности металла (обычно при высоких температурах); б)жидкостную коррозию - в растворах неэлектролитов (агрессивных органических жидкостях). Разрушение металлов при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией. Электрохимическая коррозия в основном характерна для сред, имеющих ионную проводимость: а) в водных растворах солей, кислот, щелочей, морской воде; б)в атмосфере любого влажного газа; в)в почве. 31.Способы защиты металлов от коррозии. Выбор сп-в защиты от коррозии опр-ся характером коррозии и условиями ее протекания. Способы защиты металлов от коррозии. Легирование - эф метод повышения коррозийной стойкости металлов. При легировании вводят компоненты, вызывающие наряду с пассивированием металла, повышение его жаростойкости и жаропрочности (хром, никель, вольфрам и т. п.) Защитные покрытия бывают металлические и неметаллические. Металлические покрытия, в свою очередь, разделяются на анодные (металл-покрытие более активен, чем защищаемый) и катодные (металл-покрытие менее активен, чем защищаемый). Лакокрасочные покрытия, эмали относятся к неметаллическим покрытиям. Они должны быть стойкими к высоким температурам, кислотам, щелочам, бензину и др рессивным факторам. К электрохимическому способу защиты металлов от коррозии относят протекторную и катодную защиту. Протекторная защита наиболее часто исп для предохранения конструкций (подземных трубопроводов, кабелей, корпусов судов), находящихся в среде электролита (морской воде, почве). Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала, который, выполняя роль анода, разрушается. Сущность катодной защиты заключается в том, что защищаемые изделия подключают к отрицательному полюсу внешнего источника тока. В электродной среде изделие становится катодом, что и предотвращает его разрушение, а анодом служит вспомогательный электрод. Изменение свойств коррозийной среды. Снизить агрессивность коррозийной среды можно удалением кислорода, изменением рН среды, введением ингибиторов. Ингибиторы, адсорбируясь на коррозийной поверхности, тормозят процессы, тем самым уменьшая скорость коррозии. 26.Окислительно-восстановительные реакции. Степень окисления. Методы расстановки коэффициентов в ОВР. Любая окислительно-восстановительная реакция (ОВР) состоит из процессов окисления и восстановления. Окисление - это отдача электронов атомами вещества, т. е. повышение степени окисления атома. В качестве примера рассмотрим реакцию окисления цинка: Zn° - 2e Zn2+. Восстановление - это присоединение электронов к веществу и понижение степени окисления атомов. Например, реакция вос-становленя иона Сu2+: Сu2++2е Сu0. Под степенью окисления понимается воображаемый заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. Определение степени окисления проводят, используя следующие правила:
Существуют два метода расстановки коэффициентов в окислительно-восстановительных реакциях:
В данном пособии будет рассмотрен только метод электронного баланса, при котором учитываются: а) сумма электронов, отдаваемых всеми восстановителями, которая равна сумме электронов, принимаемых всеми окислителями; б) одинаковое число одноименных атомов в левой и правой частях уравнения; в) число молекул воды (в кислой среде) или ионов гидроксида (в щелочной среде), если в реакции участвуют атомы кислорода. Составление уравнений ОВР легче провести в несколько стадий:
27.Электрохимические процессы и явления. Электронные и ионные проводники. Уравнение Нернста. Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы: 1) процессы превращения химической энергии в электрическую (в гальванических элементах); 2) процессы превращения электрической энергии в химическую (электролиз). Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. Активность металлов в окислительно-восстановительном электрохимическом процессе «металл-ион металла», а следовательно, и величины электродного потенциала, зависят от природы электродов, концентрации ионов в растворе, рН раствора, давления, температуры и определяются уравнением Нернста: 2,3 - коэффициент перевода натурального логарифма в десятичный; R - универсальная газовая постоянная, равная 8,314 Дж/моль-К; Т- температура, равная 298 К; n - число электронов, участвующих в данной электродной реакции; F- число Фарадея, равное 96500 Кл/моль; После подстановки значений постоянных величин уравнение Нернста (7.1) приобретает следующий вид: 23.Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты. Распад полярных молекул вещества на ионы под воздействием полярных молекул растворителя называется электролитической диссоциацией. Вещества, растворы и расплавы, проводимость которых обусловлена движением ионов, называются электролитами. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. Количественной характеристикой распада вещества на ионы является степень диссоциации. Степень диссоциации. Сильные и слабые электролиты. В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита: где α— степень диссоциации; п - количество ионов в растворе; N— общее число молекул в растворе. По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли. Электролиты, степень диссоциации которых в растворах α< 2 % и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, ряд кислот: H2S, Н2СОз, HCN, H2Si03, органические кислоты, основания р-, d- и f-элементов и NH4OH. Между этими двумя группами нет четкой границы, одно и то же вещество в одном растворителе проявляет свойства сильного, а в другом - слабого электролита. Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку, при растворении в воде ведут себя как типичные сильные электролиты, при растворении же в ацетоне или уксусной кислоте эти вещества являются слабыми электролитами со степень диссоциации в растворах меньше единицы. Степень диссоциации зависит:
24.Ионное произведение воды, водородный показатель (pH). Вода является слабым электролитом и диссоциирует на ионы в незначительной степени. Процесс диссоциации воды может быть записан уравнением: НОН Н+ + ОН-. Константа диссоциации будет равна: Преобразуем выражение (5.7) к следующему виду: [Н+]-[ОН-] = Кдис[H2O]. (5.8) Концентрацию молекул воды можно рассчитать, разделив массу 1 дм3 на массу 1 моля: Произведение двух постоянных величин есть величина постоянная {Кдис[HгО] = const = KH20), тогда уравнение (5.8) принимает вид: [H+][OH-] = KH2O. (5.9) Полученное уравнение показывает, что для воды и разбавленных водных растворов при постоянной температуре произведение концентрации ионов водорода и гидроксила есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Численное значение ионного произведения равно: 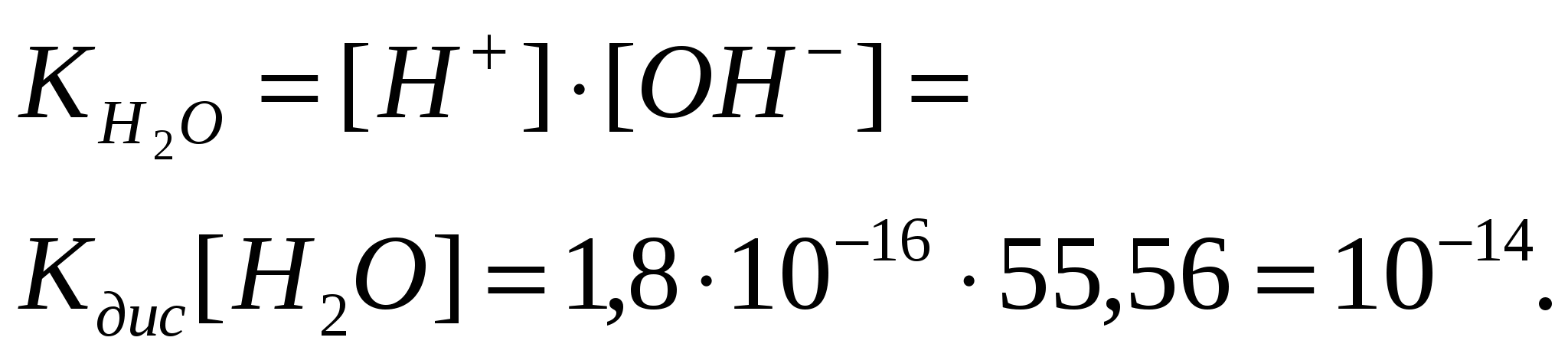 (5.10) (5.10)25.Реакции ионного обмена. Гидролиз солей. Согласно теории электролитической диссоциации, нес реакции в водных растворах электролитов являются реакциями между ионами. Такие реакции называются ионными, а уравнения этих реакций — ионными уравнениями. Обменная реакция между водой и соединением называется гидролизом. Гидролиз солей - взаимодействие в водных растворах катионов и (или) анионов солей с молекулами воды, при котором к катиону, оказавшемуся в растворе, присоединяется группа ОН- , а к аниону - ион Н+ молекулы воды. В результате гидролиза в растворе появляются ионы Н+ и ОН-, и среда становится соответственно кислой или щелочной. Возможны следующие случаи гидролиза солей: 1) по аниону, 2)катиону, 3) катиону и аниону одновременно. Рассмотрим подробно каждый из этих случаев. |
