Химия Шпоры. 1. Сформулируйте определения понятий химический элемент, атом, молекула, ион, вещество. Хим элемент
 Скачать 302 Kb. Скачать 302 Kb.
|
|
17.Что называется скоростью химической реакции? Какие факторы влияют на скорость химической реакции? Скорость хим реакции = изменению количества вещества в единицу времени в единице реакционного пространства Средняя скорость реакции равна: Факторы, влияющие на скорость химической реакции. Скорость химической реакции определяется следующими основными факторами:
Зав-ть скорости хим реакции от концентрации выражается основным законом химической кинетики - законом действующих масс. 18.Сформулируйте основной закон химической кинетики – закон действующих масс. Что такое константа скорости реакции? В 1865 г. профессор Н. Н. Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции: «... притяжение пропорционально произведению действующих масс». Эта гипотеза нашла подтверждение в законе действия масс, который был установлен в 1867 г. двумя норвежскими химиками К. М. Гульдбергом и П. Вааге. Современная формулировка закона действия масс такова: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степе нях, равных стехиометрическим коэффициентам в уравненш реакции. Для реакции аА + bВ = тМ + nN кинетическое уравнение за-кона действия масс имеет вид: где k - коэффициент пропорциональности, называемый константой скорости химической реакции (при Константа скорости химической реакции не зависит от концентрации реагентов, а определяется природой реагирующих веществ и условиями протекания реакций (температурой, наличием катализатора). Для конкретной реакции, протекающей при данных условиях, константа скорости есть величина постоянная. 19.Правило Вант-Гоффа. Температурный коэффициент скорости реакции. Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза. Математически правило Вант-Гоффа выражается так: где v(T2) и v(T1) - скорости реакций, соответственно при температурах Т2 и T1 (T2> T1); γ-температурный коэффициент скорости реакции. Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4. Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов. Поскольку скорость реакции и константа скорости химической реакции прямопропорциональны, то выражение (3.6) часто записывают в следующем виде: 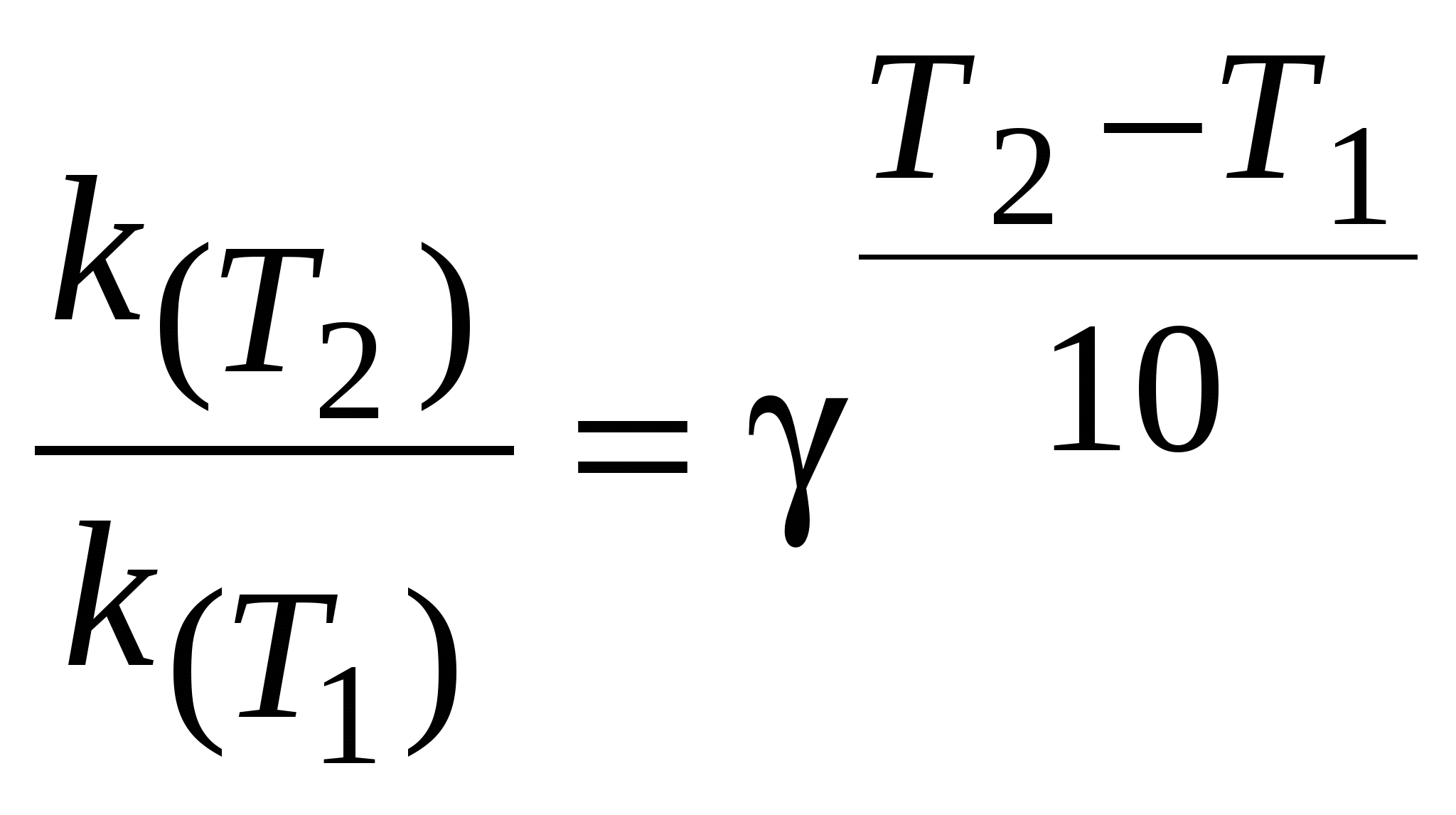 (3.7) (3.7)где k(T2), k(T1)- константы скорости реакции соответственно при температурах T2 и T1; γ-температурный коэффициент скорости реакции. 20.Химическое равновесие. Константа химического равновесия. Принцип Ле Шателье. Условие химического равновесия. Для любого химического процесса при некоторой темпер атуре энтальпийный и энтропийный факторы уравниваются. Две противоположные тенденции уравновешивают друг друга, т. е. Н= TS. В этом случае соблюдается уравнение: rG° = rH ° - TrS ° = 0, которое является термодинамическим условием химического равновесия. Химическое равновесие имеет динамический характер. Когда скорость реакции в прямом направлении равна скорости реакции в обратном направлении, наступает состояние химического равновесия. В условиях химического равновесия концентрации исходных веществ и продуктов реакции не изменяются во времени называются равновесными концентрациями веществ. В дальнейшем равновесные концентрации будем обозначать символом вещества в квадратных скобках. Например, равновесные концентрации водорода и аммиака будут обозначаться [Н2] и [NH3]. Константа химического равновесия. При равновесии химической реакции: где [L], [M],, [D], [В] - равновесные концентрации соответствующих веществ; l, m, d, b - показатели степени, равные стехиометрическим коэффициентам. О Характер смещения равновесия под влиянием внешних воз действий можно прогнозировать, применяя принцип Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то в результате протекающих в ней процессов равновесие смещается в таком направлении, которое ослабляет внешнее воздействие. 21.Растворы. Растворение как физико-химический процесс. Влияние температуры и давления на растворимость. Раствором наз гомогенную систему переменного состава, сост из двух или более инд-х вещ-в. Вещ-ва, сост-щие раствор, называют компонентами раствора. Компонентами раствора" явл раст-ль и растворенное вещ-о, равномерно распр-ное в раств-ле в виде молекул или ионов Растворение как физико-химический процесс. В зависимости от растворителя бывают водные и неводные растворы. При растворении происходит химическое взаимодействие частиц растворяемого вещества с молекулами растворителя, в результате чего образуются соединения, называемые сольватами. Если растворителем является вода, то эти соединения называют гидратами Процесс растворения кристаллических веществ в воде состоит из трех последовательных стадий, каждая из которых сопровождается тепловым эффектом: - стадия 1 - разрушение кристаллической решетки растворяемого вещества протекает с поглощением теплоты (rH01 > 0);
тепловой эффект растворения rH0 является алгебраической суммой трех тепловых эффектов: rH0 = rH01 + rH02 + rH03 Раст-ть вещ-в. Влияние температуры и давления на растворимость. Коэффициент растворимости вещества s - максимальная масса вещества, способная раствориться в 100 г воды при данной температуре с образованием насыщенного раствора. Растворимостью также наз молярную концентрацию вещ-ва в его насыщенном растворе, или любой сп-б выражения состава насыщенного раствора при данной температуре. Растворимость зависит:
Раствор-ть тв вещ-в при изм-и темп-ры зависит от знака теплового эффекта процесса раст-ния. Раст-ть газов увел-ся при понижении температуры и зависит от давления газа над жидкостью. Эта зависимость выражается законом Генри: растворимость газа при постоянной температуре прямо пропорциональна давлению газа над раствором. 22.Способы выражения состава растворов. Свойства раствора определяются качественным и количественным составом раствора. На практике количественный состав растворов выражают при помощи следующих величин: а) массовая, объемная и молярная доли, не имеющие единиц величины; б) молярная концентрация вещества, массовая концентрация вещества, имеющие единицы величины. 1.Массовая доля растворенного вещества w выражается в долях единицы, процентах (%). Массовая доля численно равна от ношению массы растворенного вещества к общей массе раствора: Масса раствора равна сумме масс растворенного вещества и растворителя: т(раствора) = т(вещества) +т{растворителя). 2.Объемная доля растворенного вещества ф выражается в долях единицы или процентах (%) и численно равна отношению объема жидкого или газообразного вещества к общему объему раствора или смеси: 3.Молярная концентрация вещества с численно равна отношению химического количества растворенного вещества к объему раствора: Единица СИ - моль/м3, внесистемные единицы величины: моль/дм3, моль/см3, моль/л, моль/мл. Используя формулу преобразуем уравнение (4.4): 35.Материалы, получаемые на основе полимеров. На основе полимеров получают волокна, пленки, резины, лаки, клеи, пластмассы и композиционные материалы (композиты). Волокна получают путем продавливания растворов или расплавов полимеров через тонкие отверстия (фильеры) в пластине с последующим затвердеванием. К волокнообразующим полимерам относятся полиамиды, полиакрилонитрилы и др. Полимерные пленки получают из расплавов полимеров методом продавливания через фильеры с щелевидными отверстиями или методом нанесения растворов полимеров на движущуюся ленту или методом каландрования' полимеров. Пленки используют в качестве электроизоляционного и упаковочного материала, основы магнитных лент и т.д. Лаки - растворы пленкообразующих веществ в органических растворителях. Кроме полимеров лаки содержат вещества, повышающие пластичность (пластификаторы), растворимые красители, отвердители и др. Применяются для электроизоляционных покрытий, а также в качестве основы грунтовочного материала и лакокрасочных эмалей. Клеи - композиции, способные соединять различные материалы вследствие образования прочных связей между их поверхностями и клеевой прослойкой. Синтетические органические клеи составляются на основе мономеров, олигомеров, полимеров или их смесей. Пластмассы - это материалы, содержащие полимер, который при формировании изделия находится в вязкотекучем состоянии, а при его эксплуатации - в стеклообразном. Все пластмассы подразделяются на реактопласты и термопласты. Композиционные материалы (композиты) - состоят из основы (органической, полимерной, углеродной, металлической, керамической), армированной наполнителем, в виде высокопрочных волокон или нитевидных кристаллов. В качестве основы используются синтетические смолы (алкидные, фенолоформальде-гидные, эпоксидные и др.) и полимеры (полиамиды, фторопласты, силиконы и др.). 36.Применение полимеров. Полиэтилен [-СН2-СН2-]n – термопласт. Из полиэтилена изготавливают трубы, электротехнические изделия, детали радиоаппаратуры, изоляционные пленки и оболочки кабелей, пленки, упаковочный материал, заменители стеклотары. Полипропилен - кристаллический термопласт, получаемый методом стереоспецифической полимеризации. Применяется для изготовления труб, пленок, аккумуляторных баков и др. Полистирол обладает высокой механической прочностью и диэлектрическими свойствами и используется как высококачественный электроизоляционный, а также конструкционный и декоративно-отделочный материал в приборостроении, электротехнике, радиотехнике, бытовой технике. Гибкий эластичный полистирол, получаемый вытяжкой в горячем состоянии, применяется для оболочек кабелей и проводов. На основе полистирола также выпускают пенопласты. Поливинилхлорид [-CH2-CHCl-]n - термопласт, изготовляемый полимеризацией винилхлорида, стоек к воздействию кислот, щелочей и окислителей. Применяется как изоляционный материал, который можно соединять сваркой. Из него изготовляют грампластинки, плащи, трубы и др. предметы. Политетрафторэтилен (фторопласт)[-CF2-CF2-]n - термопласт, получаемый методом радикальной полимеризации тетрафторэ-тилена. Как лучший диэлектрик применяется в условиях, когда требуется сочетание электроизоляционных свойств с химической стойкостью. Кроме того, его используют для нанесения антифрикционных, гидрофобных и защитных покрытий, покрытий сковородок. Полиамиды - термопласты, содержащие в основной цепи амидогруппу –NHCO. Применяются для получения волокон, изоляционных пленок, конструкционных, антифрикционных и электроизоляционных изделий. Полиуретаны - термопласты, содержащие в основной цепи группы -NH(CO)O-, а также эфирные, карбаматные и др Применяются в производстве волокон, лаков и эмалей, пленок, коагулянтов и флотореагентов, компонентов гидравлических жидкостей и др. Вопросы
|
