1. Способы выражения концентрации раствора
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
Тема 5. Поверхностное натяжение, ПАВ, ПНВ, ПИВ и адсорбция. Введение. Опять какая-то зловещая муть, плохо поддающаяся систематизации. Типичные вопросы:
Пример:  Из представленного ПАВ будет гексановая кислота и бутиламин, ПНВ-глицерин, ПИВ-гидроксид калия, он то и нужен. Как с этим бороться: ПАВ – понижают поверхностное натяжение с ростом концентрации, ПНВ – не влияют, ПИВ - увеличивают. К ПАВ относятся органические вещества, содержащие гидрофильную и гидрофобную части (это где то в другом месте еще было нужно) – то есть органические вещества, состоящие из радикала (метил, этил, пропил, …) и полярной группы – амин, спирт, кислота, и т. д. Еще ПАВ – желчь и фосфолипиды. К ПНВ относятся органические вещества с только полярными группами – глицерин, углеводы (сахароза, глюкоза). К ПИВ относятся неорганические электролиты, хлориды натирев и калиев всяких. И т.д.
Пример: Сорян, забыл заскринить. Как с этим бороться: Пример проявления правила Дюкло-Траубе. С ростом радикала поверхностная активность повышается, поверхностное натяжение понижается, а адсорбция этих ПАВ усиливается. Такие дела. На всякий случай, радикалы в порядке возрастания: метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил.
Пример:  . Как с этим бороться: Нужно иметь в виду, что на адсорбцию влияют:
На величину предельной адсорбции не влияет только масса адсорбента.
Пример: ? Видел один раз, подумал, что не так важно. Как с этим бороться: Скажу как есть, потому что вариант такого вопроса видел только один. На неполярном адсорбенте лучше всего адсорбируются неполярные адсорбаты из полярной среды, ну и наоборот, на полярном лучше всего адсорбируется полярное из неполярного.
Пример: ? нету. Как с этим бороться: Пока неизвестно Тема 6. Химическая кинетика. Введение. Весьма мудреный раздел, в моём родном РХТУ им. Менделеева вообще считается самым сложным предметом. Судя по тестам в 1 модуле, так оно и было, но концентрация треша и угара в итоговом тесте намного ниже. С чем это связано – непонятно. То ли я плохо проверил вопросы теста, то ли кафедра решила смилостивиться и выпилила самые зловещие вопросы. Типичные вопросы:
Пример:  Муть. Как с этим бороться: Если кафедра таки хотела выпилить самые сложные и оставить самые простые вопросы, то с этим они промахнулись. Вопрос суров и сложен по внешнему виду, но прост в алгоритме. Просто нужно найти в дебрях учебников фразу, что самая медленная (лимитирующая) стадия в последовательных реакциях – это стадия с наибольшей энергией активации. Если лимитирующая стадия первая, то больше всего будет продукта С, а если лимитирующая вторая- то В, это распространяется и на последовательные, и на параллельные реакции.
Пример: 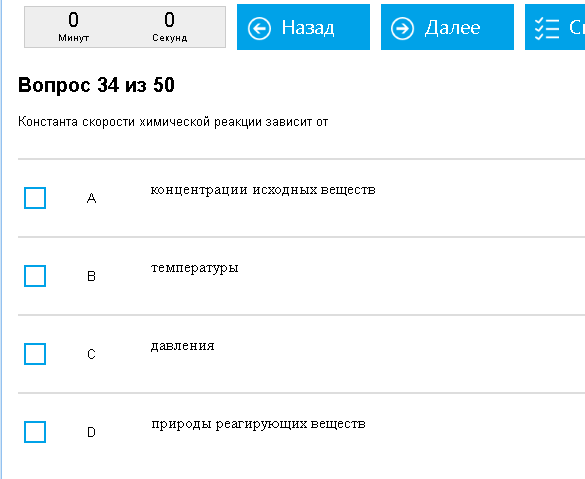 Мутная константа скорости. Как с этим бороться: Снова скажу как есть: константа зависит от температуры и наличия катализаторов и ингибиторов, и, естественно, от природы веществ реагирующих и не зависит ни от чего иного, например не зависит от концентрации реагирующих веществ и давления.
Пример:   Мда... Обратите внимание на третий пример, там про уменьшение скорости, а не повышение. Как с этим бороться: По примеру – скорость реакции в газовой фазе зависит от природы реагирующих веществ, концентраций реагирующих веществ (с увеличением концентрации растет скорость), температуры (с увеличением Т растет скорость) и давления (с увеличением Р растет скорость). Скорость реакции в растворе, буде таковая попадется, зависит от всего того же кроме давления. Энергия активации, где то я ее видел, зависит от природы реагирующих веществ, наличия катализаторов (понижают ее) и ингибиторов (повышают ее). Вроде все. Тема 7. Электролиты. рН. Введение: На самом деле, хорошо помогает справляться с этим - осознать теорию Бренстеда-Лоури. Кислота – отдает (донор) Н+, основание – присоединяет Н+, но эта теория настолько проста и охватывает все разделы, что понять ее не получается. Еще нужен список «Сильные и слабые кислоты и основания». Это
Всегда держите в голове, что есть кислоты сильные, есть слабые, есть основания сильные, есть слабые, а соли – продукты их взаимодействия – образованы кислотой (сильной или слабой) и основанием (тоже сильным или слабым). Ахтунг!!! Если вы не поняли то, попытки решить эти задачи бессмысленны. Типичные вопросы:
Пример: 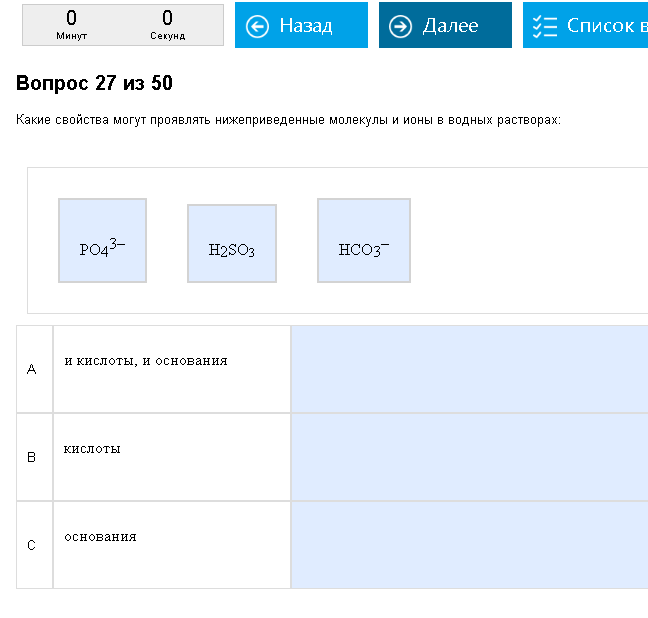 Кислоты и основания… Как с этим бороться: Вроде и просто, а вроде и сложно. Кислота может отдать Н+, а основание принять его. Соответственно, чтобы отдать Н+, его нужно предварительно иметь. Кислота – это что то с Н, способное его отрывать (Н2S, HS, H3PO4, H2PO4, HPO4, NH4+… то есть или кислоты с хотя бы 1 Н, или слабые основания с присоединенным лишним Н) а основания – обычно что-нибудь с «-», чтобы лучше присоединять Н+, хотя и не обязательно. (Хорошие основания = полностью обезводороженые остатки кислот или собственно разные основания ОН, NH3, CO3, PO4)
Пример: 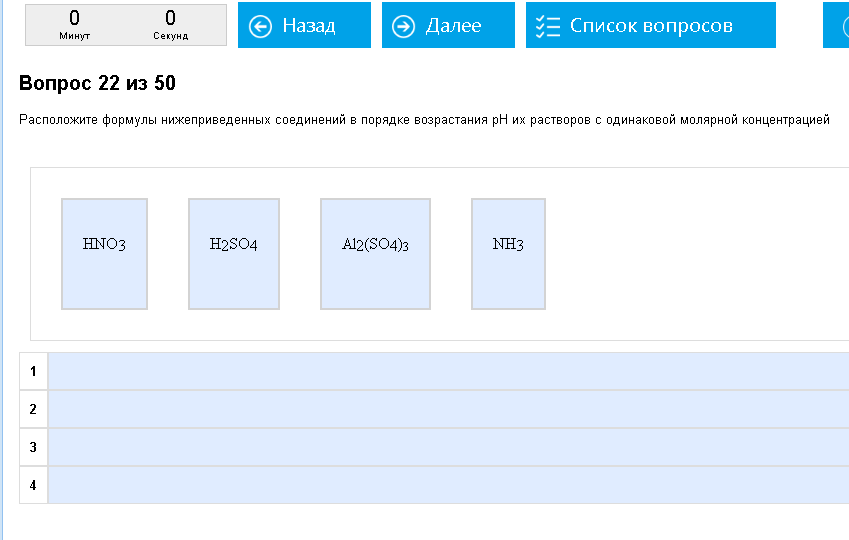 Ряд разных электролитов. Представлены, уже верно расположенные по возрастанию рН: сильная двухосновная кислота (H2SO4), сильная одноосновная кислота (HNO3), соль слабого основания и сильной кислоты (Al2(SO4)3), слабое основание (NH3). Как с этим бороться: Тут может хорошо помочь шкала электролитов по возрастанию рН: Сильная двухосновная кислота (H2SO4) > сильная одноосновная кислота (HCl) > слабая кислота (список) > соль сильной кислоты и слабого основания > соль сильной кислоты и сильного основания > соль сильного основания и слабой кислоты > слабое основание (список) > сильное одноосновное основание (KOH, NaOH…) > сильное двухосновное основание (Ba(OH)2) Смотрим, какие у нас 4 электролита, определяем их тип и располагаем в соответствии со шкалой.
Пример: 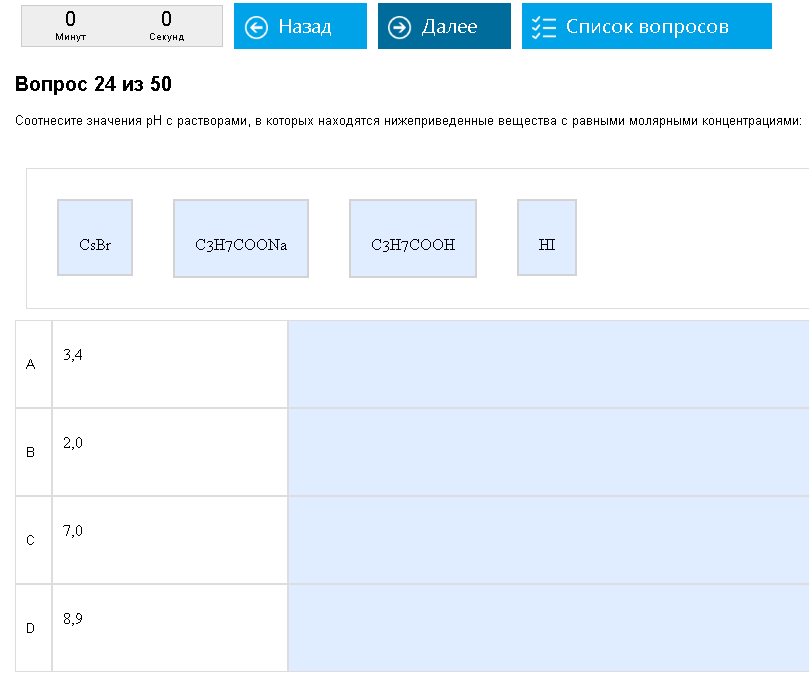 Суровые электролиты. Как с этим бороться: Аналогично предыдущему вопросу, но вместо порядка возрастания-убывания надо соотносить с цифрами рН. Самый кислый электролит соотносят с самой маленькой из данных цифр и далее идут по возрастанию. Определяйте тип электролитов грамотно, не путайте соли с кислотами, а сильные кислоты со слабыми кислотами.
Пример:  Области рН. Электролиты в порядке как даны: соль сильного основания и слабой кислоты, слабая кислота, соль слабого основания и слабой кислоты. Как с этим бороться: Даже легче, чем предыдущие вопросы. Определяем тип электролитов опять, и из табл узнаем, у какого электролита какая область рН.
Пример: 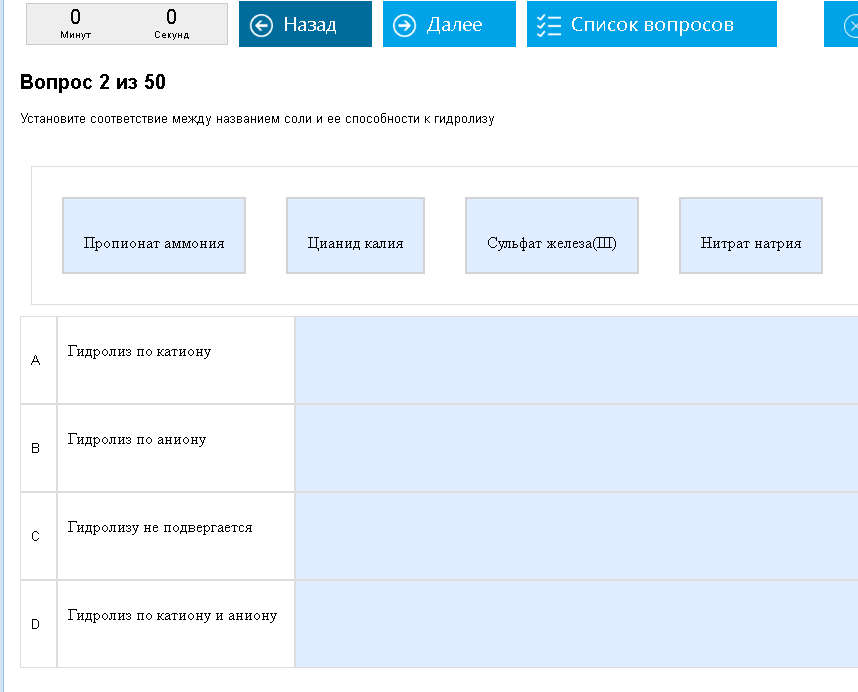 И тут тоже номенклатура, уже неорганических веществ. Ну что за твою мать?. Как с этим бороться: А вот так:
Определили тип электролита (умеем же?), и автоматом определяется тип гидролиза. Сильно запутывает ситуацию то, что соли даны через названия. Вспоминаем, что такое есть сульфат, сульфит и сульфид, и прочие радости ЕГЭшно-школьной жизни.
Пример: ? нет. Как с этим бороться: Пока неизвестно. Тема 8. Буферные растворы. Введение. Средней запутанности тема. Буферный раствор – система, сохраняющая рН примерно постоянным при добавлении небольших количеств кислот и щелочей и разбавлении. Достигается это за счет особой, химической магии. Буферный раствор содержит пару веществ: сопряженную-кислоту и сопряженное-основание. Если к буферному раствору добавляют злую сильную кислоту, ее нейтрализует сопряженное-основание, а если к этому же раствору добавляют сильную щелочь, то ее нейтрализует уже сопряженная-кислота. При этом сами сопряженные кислота и основание друг друга не нейтрализуют, они же сопряженные. Подробнее, с примерами – методичка. Типичные вопросы:
Пример: 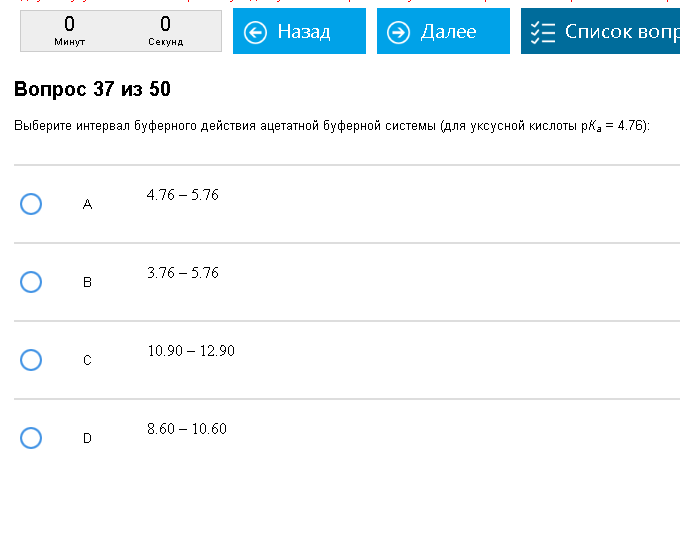 Просто, очень просто. Как с этим бороться: Просто. Интервал буферного действия – это область рН от рКа-1 до рКа+1. То есть если рКа=6, то интервал от 5 до 7. И т. д. Трабл может получиться, если у кислоты несколько рКа. В этом случае находим буферную систему в таблице примеров в голубой методичке, а из формулы справа узнаем, какая константа должна использоваться для расчетов. Например, гидрофосфатная – по рКа2. Фэйл – если такой системы нет в этой таблице.
Пример: 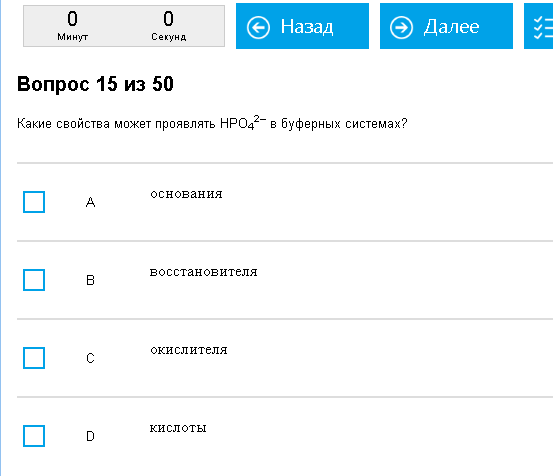 Гидрофосфат коварен. Как с этим бороться: Вопрос относится к предыдущей теме про электролиты. Если частица способна отдавать Н+, то кислота, принимать – основание. Вот и гадайте на примере НРО4. Отдать способен, ведь есть же РО4. И принять способен, потому что Н2РО4 тоже существует. Значит, и кислота и основание. Хотя таковое гадание делать просто удается далеко не всегда. Глядя на диполярную форму глицина +NH3CH2COO- сразу и не поймешь, могут ли отрываться вся эта куча водородов и может ли присоединяться еще один лишний. Такие дела.
Пример: 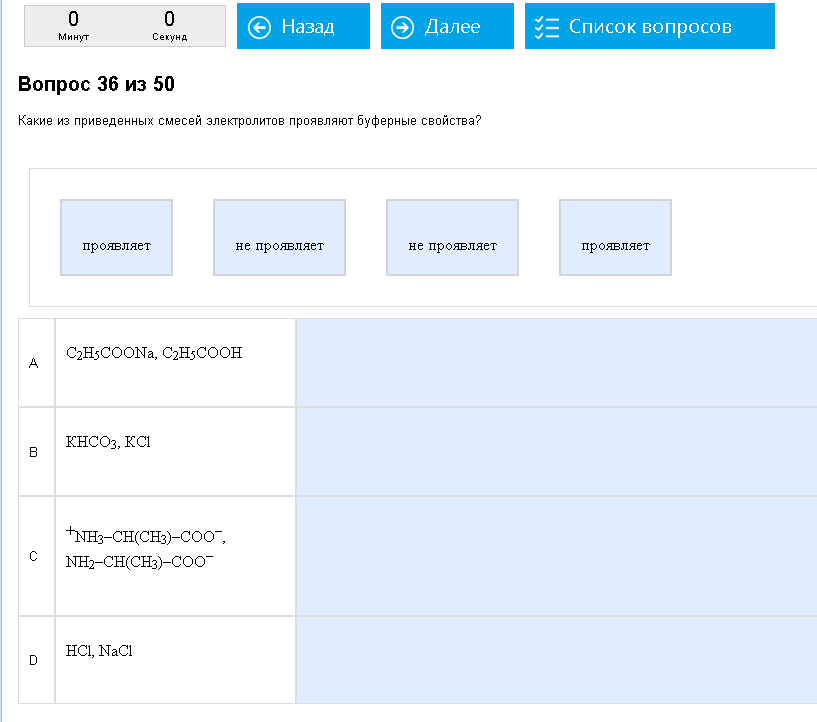 Такие вот примеры. Как с этим бороться: Буферными будут системы, состоящими из сопряженной-кислоты и сопряженного-основания. Это пара веществ, отличающимися на 1 Н, у кислоты есть, у основания нету. NH3/NH4, CH3COOH/CH3COO, H2PO4/HPO4, и так далее. Естественно, водород не может отсутствовать просто так, он или чем то замещен, или еще как-то, поэтому можно ожидать что типа CH3COOH/CH3COONa и т.д. Исключения – сильные кислоты. Система HCl/NaCl, по внешним признакам похожая на буферную, на самом деле не буферная.
Пример: 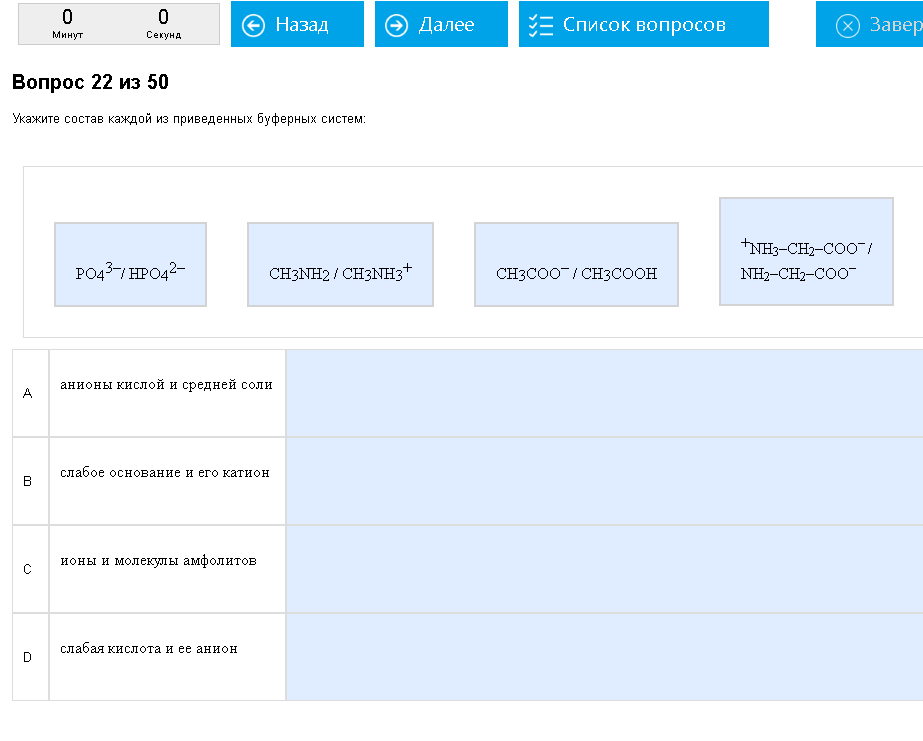 Какая то путанная хрень. Как с этим бороться: Слабая кислота – вы должны узнавать ее, если честно изучили предыдущую тему. Слабые основания – тоже, в таком же случае. Амфолиты – это буферные системы на основе аминокислот, это самые большие формулы. Кислая и средняя соль – то что осталось, но! Не перепутайте со слабой кислотой, у кислых солей кислоты многоосновные (Н3РО4, Н2СО3), а под слабыми кислотами обычно дают только одноосновные. (СН3СООН).
Пример: ? нету Как с этим бороться: Бояться и надеяться на лучшее. |
